 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Diborano (6) | |
| Otros nombres Boroetano Hidruro de boro Diboron hexahidruro | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.039.021 |
| Número CE |
|
PubChem CID |
|
| Número RTECS |
|
| UNII | |
| un numero | 1911 |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| B 2 H 6 | |
| Masa molar | 27,67 g · mol −1 |
| Apariencia | Gas incoloro |
| Olor | repulsivo y dulce |
| Densidad | 1,131 g / L [1] |
| Punto de fusion | −164,85 ° C (−264,73 ° F; 108,30 K) [1] |
| Punto de ebullición | −92,49 ° C (−134,48 ° F; 180,66 K) [1] |
| Reacciona [2] | |
| Solubilidad en otros disolventes. | Ligeramente soluble en diglima y éter dietílico , [3] |
| Presión de vapor | 39,5 atmósferas (16,6 ° C) [2] |
| Estructura | |
| Tetraédrico (para boro) | |
| ver texto | |
| 0 D | |
| Termoquímica | |
Capacidad calorífica ( C ) | 56,7 J / (mol · K) [4] |
Entropía molar estándar ( S | 232,1 J / (mol · K) [4] |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | 36,4 kJ / mol [4] |
| Riesgos | |
| Principales peligros | Fácilmente inflamable, reacciona con el agua. |
| Ficha de datos de seguridad | Ver: página de datos |
| Pictogramas GHS |      |
| Palabra de señal GHS | Peligro |
Declaraciones de peligro GHS | H220 , H280 , H314 , H318 , H330 , H370 , H372 |
Consejos de prudencia del SGA | P210 , P260 , P264 , P270 , P271 , P280 , P284 , P301 + 330 + 331 , P303 + 361 + 353 , P304 + 340 , P305 + 351 + 338 , P307 + 311 , P310 , P314 , P320 , P321 , P363 , P377 , P381 , P403 , P403 + 233 , P405 , P410 + 403 , P501 |
| NFPA 704 (diamante de fuego) | [6]  4 4 3 W |
autoignición temperatura | 38 ° C (100 ° F; 311 K) |
| Límites explosivos | 0,8–88% [2] |
| Dosis o concentración letal (LD, LC): | |
LC 50 ( concentración media ) | 40 ppm (rata, 4 h ) 29 ppm (ratón, 4 h) 40-80 ppm (rata, 4 h) 159-181 ppm (rata, 15 min ) [5] |
LC Lo ( menor publicado ) | 125 ppm (perro, 2 h) 50 ppm (hámster, 8 h) [5] |
| NIOSH (límites de exposición a la salud de EE. UU.): | |
PEL (permitido) | TWA 0,1 ppm (0,1 mg / m 3 ) [2] |
REL (recomendado) | TWA 0,1 ppm (0,1 mg / m 3 ) [2] |
IDLH (peligro inmediato) | 15 ppm [2] |
| Compuestos relacionados | |
Compuestos de boro relacionados | Decaborano BF 3 |
| Página de datos complementarios | |
Estructura y propiedades | Índice de refracción ( n ), constante dieléctrica (ε r ), etc. |
Datos termodinámicos | Comportamiento de fase sólido-líquido-gas |
Datos espectrales | UV , IR , RMN , MS |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El diborano (6) , generalmente conocido como diborano , es el compuesto químico formado por boro e hidrógeno con la fórmula B 2 H 6 . Es un gas pirofórico incoloro con un olor repulsivamente dulce. Los sinónimos incluyen boroetano, hidruro de boro y hexahidruro de diboro. El diborano es un compuesto de boro clave con una variedad de aplicaciones. Ha atraído gran atención por su estructura electrónica. Sus derivados son reactivos útiles.
Estructura y vinculación
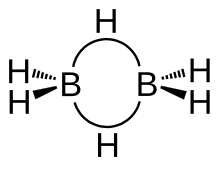
La estructura del diborano tiene simetría D 2h . Cuatro hidruros son terminales, mientras que dos puentes entre los centros de boro. Las longitudes de los enlaces puente B – H y los enlaces terminales B – H son 1,33 y 1,19 Å respectivamente. Esta diferencia en la longitud de los enlaces refleja la diferencia en sus fortalezas, siendo los enlaces puente B – H relativamente más débiles. La debilidad del puente B – H en comparación con los enlaces terminales B – H está indicada por sus firmas vibratorias en el espectro infrarrojo , siendo ≈2100 y 2500 cm −1 respectivamente. [7]
El modelo determinado por la teoría de los orbitales moleculares describe los enlaces entre el boro y los átomos de hidrógeno terminales como enlaces covalentes convencionales de 2 centros y 2 electrones . Sin embargo, el enlace entre los átomos de boro y los átomos de hidrógeno puente es diferente al de moléculas como los hidrocarburos. Cada boro usa dos electrones para unirse a los átomos de hidrógeno terminales y le queda un electrón de valencia para un enlace adicional. Los átomos de hidrógeno puente proporcionan un electrón cada uno. El anillo B 2 H 2 se mantiene unido por cuatro electrones que forman dos enlaces de 2 electrones de 3 centros . Este tipo de vínculo a veces se denomina "vínculo de plátano".
B 2 H 6 es isoelectrónico con C 2 H 6 2+ , que surgiría de la diprotonación de la molécula plana etileno . [8] El diborano es uno de los muchos compuestos con enlaces tan inusuales. [9]
De los otros elementos del grupo IIIA, se sabe que el galio forma un digallano compuesto similar , Ga 2 H 6 . De aluminio forma un hidruro polimérico, (ALH 3 ) n ; aunque inestable, el Al 2 H 6 se ha aislado en hidrógeno sólido y es isoestructural con diborano. [10]
Producción y síntesis
Los estudios extensos del diborano han conducido al desarrollo de múltiples síntesis. La mayoría de las preparaciones implican reacciones de donantes de hidruros con haluros o alcóxidos de boro. La síntesis industrial de diborano implica la reducción de BF 3 por hidruro de sodio , hidruro de litio o hidruro de litio y aluminio : [11]
- 8 BF 3 + 6 LiH → B 2 H 6 + 6 LiBF 4
Dos métodos de laboratorio parten de tricloruro de boro con hidruro de litio y aluminio o de una solución de éter de trifluoruro de boro con borohidruro de sodio . Ambos métodos dan como resultado hasta un 30% de rendimiento:
- 4 BCl 3 + 3 LiAlH 4 → 2 B 2 H 6 + 3 LiAlCl 4
- 4 BF 3 + 3 NaBH 4 → 2 B 2 H 6 + 3 NaBF 4
Los métodos más antiguos implican la reacción directa de las sales de borohidruro con un ácido no oxidante , como el ácido fosfórico o el ácido sulfúrico diluido .
- 2 BH 4 - + 2 H + → 2 H 2 + B 2 H 6
De manera similar, se ha demostrado la oxidación de las sales de borohidruro y sigue siendo conveniente para preparaciones a pequeña escala. Por ejemplo, usando yodo como oxidante:
- 2 NaBH
4 + Yo
2 → 2 NaI + B
2H
6 + H
2
Otra síntesis a pequeña escala utiliza hidroborato de potasio y ácido fosfórico como materiales de partida. [12]
Reacciones

El diborano es un reactivo muy reactivo y versátil. [14]
Aire, agua, oxígeno
Como sustancia pirofórica , el diborano reacciona exotérmicamente con el oxígeno para formar trióxido de boro y agua:
- 2 B 2 H 6 + 6 O 2 → 2 B 2 O 3 + 6 H 2 O ( Δ H r = −2035 k J / mol = −73,47 kJ / g )
El diborano reacciona violentamente con el agua para formar hidrógeno y ácido bórico :
- B 2 H 6 + 6 H 2 O → 2 B (OH) 3 + 6 H 2 (Δ H r = −466 kJ / mol = −16.82 kJ / g )
El diborano también reacciona con alcoholes de manera similar. Por ejemplo, el metanol da hidrógeno y borato de trimetilo : [15]
- B 2 H 6 + 6 MeOH → 2 B (OMe) 3 + 6 H 2
Acidez de Lewis
Un patrón de reacción dominante implica la formación de aductos con bases de Lewis . A menudo, tales aductos iniciales proceden rápidamente para dar otros productos. Por ejemplo, el borano-tetrahidrofurano, que a menudo se comporta de manera equivalente al diborano, se degrada a ésteres de borato. Su aducto con sulfuro de dimetilo es un reactivo importante en la síntesis orgánica .
Con amoniaco diborano para formar el diamoniato de diborano, DADB, con menores cantidades de amoniaco borano , según las condiciones.
Hidroboración
En la reacción de hidroboración , el diborano también reacciona fácilmente con los alquenos para formar tri alquilboranos . Este patrón de reacción es bastante general y los boratos de alquilo resultantes pueden derivatizarse fácilmente, por ejemplo, en alcoholes. Aunque los primeros trabajos sobre hidroboración se basaron en el diborano, este ha sido reemplazado por dimetilsulfuro de borano, que se maneja de manera más segura.
Otro
La pirólisis del diborano da hidrógeno y diversos grupos de hidruro de boro. Por ejemplo, el pentaborano se preparó primero mediante pirólisis de diborano a aproximadamente 200 ° C. [16] [17] Aunque esta ruta de pirólisis rara vez se emplea, marcó el comienzo de un gran tema de investigación de la química de los conglomerados de borano .
El tratamiento de diborano con amalgama de sodio produce NaBH 4 y Na [B 3 H 8 ] [15] Cuando el diborano se trata con hidruro de litio en éter dietílico , se forma borohidruro de litio: [15]
- B 2 H 6 + 2 LiH → 2 LiBH 4
El diborano reacciona con cloruro de hidrógeno anhidro o gas bromuro de hidrógeno para dar un halohidruro de boro: [15]
- B 2 H 6 + HX → B 2 H 5 X + H 2 (X = Cl, Br)
El tratamiento del diborano con monóxido de carbono a 470 K y 20 bar da H 3 BCO . [15]
Reactivo en síntesis orgánica
El diborano y sus variantes son reactivos de síntesis orgánicos centrales para la hidroboración . Los alquenos se agregan a través de los enlaces B – H para dar trialquilboranos, que se pueden elaborar más. [18] El diborano se utiliza como agente reductor aproximadamente complementario a la reactividad del hidruro de litio y aluminio . El compuesto reduce fácilmente los ácidos carboxílicos a los correspondientes alcoholes , mientras que las cetonas reaccionan lentamente.
Historia
El diborano se sintetizó por primera vez en el siglo XIX mediante la hidrólisis de boruros metálicos, pero nunca se analizó. De 1912 a 1936, Alfred Stock , el principal pionero en la química de los hidruros de boro, llevó a cabo su investigación que condujo a los métodos para la síntesis y manipulación de hidruros de boro altamente reactivos, volátiles y, a menudo, tóxicos. Propuso la primera estructura similar al etano del diborano. [19] Las mediciones de difracción de electrones de S. H. Bauer inicialmente parecían apoyar su estructura propuesta. [20] [21]
Debido a una comunicación personal con L. Pauling (quien apoyó la estructura similar al etano), H. I. Schlessinger y A. B. Burg no discutieron específicamente el enlace de 2 electrones de 3 centros en su revisión clásica de principios de la década de 1940. [22] Sin embargo, la revisión analiza la estructura puente D 2h con cierta profundidad: "Debe reconocerse que esta formulación explica fácilmente muchas de las propiedades químicas del diborano ..."
En 1943, H. Christopher Longuet-Higgins , cuando todavía era estudiante en Oxford, fue el primero en explicar la estructura y la unión de los hidruros de boro. El artículo que reporta el trabajo, escrito con su tutor R. P. Bell , [23] también revisa la historia del tema a partir de la obra de Dilthey. [24] Poco después, el trabajo teórico de Longuet-Higgins fue confirmado en un estudio infrarrojo de diborano por Price. [25] La estructura fue reconfirmada por medición de difracción de electrones en 1951 por K. Hedberg y V. Schomaker, con la confirmación de la estructura que se muestra en los esquemas de esta página. [26]
William Nunn Lipscomb Jr. confirmó aún más la estructura molecular de los boranos utilizando cristalografía de rayos X en la década de 1950 y desarrolló teorías para explicar su unión. Más tarde, se aplicó los mismos métodos a los problemas relacionados, incluyendo la estructura de carboranos, en la que dirigió la investigación del futuro 1981 Premio Nobel ganador Roald Hoffmann . El Premio Nobel de Química de 1976 fue otorgado a Lipscomb "por sus estudios sobre la estructura de los boranos que esclarecían los problemas de los enlaces químicos". [27]
Tradicionalmente, el diborano se ha descrito a menudo como deficiente en electrones , porque los 12 electrones de valencia solo pueden formar 6 enlaces convencionales de 2 centros y 2 electrones, que son insuficientes para unir los 8 átomos. [28] [29] Sin embargo, la descripción más correcta que utiliza enlaces de 3 centros muestra que el diborano es realmente con precisión de electrones, ya que hay suficientes electrones de valencia para llenar los 6 orbitales moleculares de enlace . [30] No obstante, algunos libros de texto importantes todavía utilizan el término "deficiencia de electrones". [31]
Otros usos
Debido a la exotermicidad de su reacción con el oxígeno, el diborano ha sido probado como propulsor de cohetes . [32] La combustión completa es fuertemente exotérmica. Sin embargo, la combustión no es completa en el motor cohete, ya que se produce algo de monóxido de boro , B 2 O. Esta conversión refleja la combustión incompleta de hidrocarburos para producir monóxido de carbono (CO). El diborano también resultó difícil de manejar. [33] [34] [35]
El diborano se ha investigado como precursor de las películas de boruro metálico [36] y para el dopado p de semiconductores de silicio. [37]
Seguridad
El diborano es un gas pirofórico. En su lugar, se utilizan típicamente aductos disponibles comercialmente, al menos para aplicaciones en química orgánica. Estos aductos incluyen borano-tetrahidrofurano (borano-THF) y borano-dimetilsulfuro . [14] Los efectos tóxicos del diborano se mitigan porque el compuesto es muy inestable en el aire. Se ha investigado la toxicidad en ratas de laboratorio. [38]
Referencias
- ↑ a b c Haynes, pág. 4.52.
- ^ a b c d e f Guía de bolsillo de NIOSH sobre peligros químicos. "# 0183" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Yerazunis, S., et al. "Solubilidad del diborano en dimetiléter y dietilenglicol, en mezclas de borohidruro de sodio y dimetiléter de dietilenglicol y en sulfuro de butilo diterciario". Journal of Chemical & Engineering Data, vol. 7, no. 3, julio de 1962, págs. 337–39, doi: 10.1021 / je60014a004.
- ↑ a b c Haynes, pág. 5.6.
- ^ a b "Diborano" . Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "CDC - DIBORANE - Tarjetas internacionales de seguridad química - NIOSH" . Archivado desde el original el 7 de octubre de 2018 . Consultado el 7 de octubre de 2018 .
- ^ Cooper, CB, III; Shriver, DF; Onaka, S. (1978). "Cap. 17. Espectroscopía vibratoria de compuestos de metales de transición con puentes de hidruro" . Hidruros metálicos de transición . Avances en Química. 167 . págs. 232–247 . doi : 10.1021 / ba-1978-0167.ch017 . ISBN 9780841203907.CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Rasul, G .; Prakash, GKS; Olah, GA (2005). " Estudio comparativo ab initio de las estructuras y estabilidades de la dicación del etano C 2 H 6 2+ y sus análogos de silicio Si 2 H 6 2+ y CSiH 6 2+ ". Journal of Physical Chemistry A . 109 (5): 798–801. Código bibliográfico : 2005JPCA..109..798R . doi : 10.1021 / jp0404652 . PMID 16838949 .
- ^ Laszlo, P. (2000). "Una historia de Diborano". Angewandte Chemie International Edition . 39 (12): 2071–2072. doi : 10.1002 / 1521-3773 (20000616) 39:12 <2071 :: AID-ANIE2071> 3.0.CO; 2-C . PMID 10941018 .
- ^ Andrews, L .; Wang, X. (2003). "El espectro infrarrojo de Al 2 H 6 en hidrógeno sólido". Ciencia . 299 (5615): 2049-2052. Código bibliográfico : 2003Sci ... 299.2049A . doi : 10.1126 / science.1082456 . PMID 12663923 . S2CID 45856199 .
- ^ Brauer, Georg (1963). Manual de química inorgánica preparativa . 1 (2ª ed.). Nueva York: Academic Press. pag. 773. ISBN 978-0121266011.
- ^ Norman, AD; Jolly, WL; Saturnino, D .; Shore, SG (1968). Diborano . Síntesis inorgánica. 11 . págs. 15-19. doi : 10.1002 / 9780470132425.ch4 . ISBN 9780470132425.
- ^ Hutchins, Robert O .; Cistone, Frank (1981). "Utilidad y aplicaciones del dimetilsulfuro de borano en síntesis orgánica. Una revisión". Preparaciones y Procedimientos Orgánicos Internacional . 13 (3–4): 225. doi : 10.1080 / 00304948109356130 .
- ↑ a b Mikhailov, BM (1962). "La química del diborano". Reseñas de productos químicos rusos . 31 (4): 207–224. Código bibliográfico : 1962RuCRv..31..207M . doi : 10.1070 / RC1962v031n04ABEH001281 .
- ^ a b c d e Housecroft, CE; Sharpe, AG (2008). "Capítulo 13: Los elementos del Grupo 13". Química inorgánica (3ª ed.). Pearson. pag. 336 . ISBN 978-0-13-175553-6.
- ↑ Stock, A. (1933). Los hidruros de boro y silicio . Nueva York: Cornell University Press. ISBN 0-8014-0412-6.
- ^ Miller, VR; Ryschkewitsch, GE (1974). "Pentaborano (9) (B 5 H 9 )". Síntesis inorgánica . 15 : 118-122. doi : 10.1002 / 9780470132463.ch26 .
- ^ Carril, Clinton F. (1976). "Reducción de compuestos orgánicos con diborano". Revisiones químicas . 76 (6): 773–799. doi : 10.1021 / cr60304a005 .
- ↑ Stock, A. (1933). Los hidruros de boro y silicio . Nueva York: Cornell University Press.
- ^ Bauer, SH (1937). "La estructura del diborano". Revista de la Sociedad Química Estadounidense . 59 (6): 1096-1103. doi : 10.1021 / ja01285a041 .
- ^ Bauer, SH (1942). "Estructuras y propiedades físicas de los hidruros de boro y de sus derivados". Revisiones químicas . 31 (1): 43–75. doi : 10.1021 / cr60098a002 .
- ^ Schlesinger, HI; Burg, AB (1942). "Desarrollos recientes en la química de los hidruros de boro". Revisiones químicas . 31 (1): 1–41. doi : 10.1021 / cr60098a001 .
- ^ Longuet-Higgins, HC ; Bell, RP (1943). "64. La estructura de los hidruros de boro". Revista de la Sociedad Química (reanudado) . 1943 : 250-255. doi : 10.1039 / JR9430000250 .
- ^ Dilthey, W. (1921). "Über die Konstitution des Wassers" . Angewandte Chemie . 34 (95): 596. doi : 10.1002 / ange.19210349509 .
- ^ Precio, WC (1948). "El espectro de absorción del diborano". J. Chem. Phys . 16 (9): 894. Código bibliográfico : 1948JChPh..16..894P . doi : 10.1063 / 1.1747028 .
- ^ Hedberg, K .; Schomaker, V. (1951). "Una reinvestigación de las estructuras de diborano y etano por difracción de electrones". Revista de la Sociedad Química Estadounidense . 73 (4): 1482-1487. doi : 10.1021 / ja01148a022 .
- ^ "El Premio Nobel de Química 1976" . Nobelprize.org . Consultado el 1 de febrero de 2012 .
- ^ Longuet-Higgins, HC (1957). "Las estructuras de moléculas deficientes en electrones" . Reseñas trimestrales, Chemical Society . 11 (2): 121-133. doi : 10.1039 / qr9571100121 . Consultado el 15 de julio de 2020 .
- ^ Murrell, JN ; Hervidor, SFA; Tedder, JM (1965). Teoría de valencia . John Wiley e hijos. pag. 243.
- ^ Lipscomb, William N. (11 de diciembre de 1976). "Los Boranos y sus parientes (Conferencia Nobel)" (PDF) . nobelprize.org . Fundación Nobel. págs. 224–245 . Consultado el 16 de julio de 2020 .
Una de las consecuencias simples de estos estudios fue que las moléculas deficientes en electrones, definidas por tener más orbitales de valencia que electrones, no son realmente deficientes en electrones.
- ^ Housecroft, Catherine E .; Sharpe, Alan G. (2005). Química inorgánica (2ª ed.). Pearson Prentice-Hall. pag. 326. ISBN 0130-39913-2.
Una especie deficiente en electrones posee menos electrones de valencia de los necesarios para un esquema de enlace localizado.
- ^ Bilstein, Roger. "Etapas de Saturno" . capítulo 5: Oficina de Asuntos Públicos de la NASA. pag. 133 . Consultado el 14 de noviembre de 2015 .Mantenimiento de CS1: ubicación ( enlace )
- ^ Gammon, Benson E .; Genco, Russell S .; Gerstein, Melvin (1950). Una evaluación preliminar experimental y analítica del diborano como combustible para reactores (PDF) . Comité Asesor Nacional de Aeronáutica.
- ^ Torre, Leonard K .; Breitwieser, Roland; Gammon, Benson E. (1958). Rendimiento de combustión teórico de varios combustibles de alta energía para motores Ramjet (PDF) . Comité Asesor Nacional de Aeronáutica.
- ^ "HIDRÓGENO LÍQUIDO COMO COMBUSTIBLE DE PROPULSIÓN, 1945-1959. Parte II: 1950-1957. Capítulo 5. Investigación de NACA sobre propulsores de alta energía" . history.nasa.gov .
- ^ Brotherton, Robert J .; Weber, C. Joseph; Guibert, Clarence R .; Pequeño, John L. (2000). Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a04_309 .
- ^ Mehta, Bhavesh; Tao, Meng (2005). "Un modelo cinético para el dopaje de boro y fósforo en la epitaxia de silicio por CVD". Revista de la Sociedad Electroquímica . 152 (4): G309. doi : 10.1149 / 1.1864452 .
- ^ Nomiyama, Tetsuo; Omae, Kazuyuki; Ishizuka, Chizuru; Hosoda, Kanae; Yamano, Yuko; Nakashima, Hiroshi; Uemura, Takamoto; Sakurai, Haruhiko (1996). "Evaluación de la toxicidad por inhalación pulmonar y testicular subaguda de diborano en ratas". Toxicología y Farmacología Aplicada . 138 (1): 77–83. doi : 10.1006 / taap.1996.0100 . PMID 8658516 .
Fuentes citadas
- Haynes, William M., ed. (2011). Manual CRC de Química y Física (92ª ed.). Prensa CRC . ISBN 978-1439855119.
- Yerazunis, S. y col. "Solubilidad del diborano en dimetiléter y dietilenglicol, en mezclas de borohidruro de sodio y dimetiléter de dietilenglicol y en sulfuro de butilo diterciario". Journal of Chemical & Engineering Data , vol. 7, no. 3, julio de 1962, págs. 337–39, doi: 10.1021 / je60014a004.
Enlaces externos
- Tarjeta internacional de seguridad química 0432
- Inventario Nacional de Contaminantes - Boro y compuestos
- Guía de bolsillo de NIOSH sobre peligros químicos
- Niveles de guía de exposición aguda de la EPA de EE. UU.






