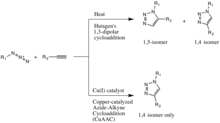
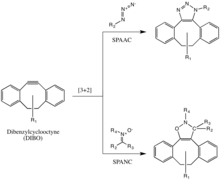
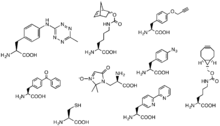
Haga clic en química
En la síntesis química , la química de "clic" es una clase de reacciones de moléculas pequeñas biocompatibles que se utilizan comúnmente en la bioconjugación , lo que permite la unión de sustratos elegidos con biomoléculas específicas. La química del clic no es una sola reacción específica, sino que describe una forma de generar productos que siguen ejemplos en la naturaleza , que también genera sustancias uniendo pequeñas unidades modulares. En muchas aplicaciones, las reacciones de clic unen una biomolécula y una molécula informadora . La química del clic no se limita a las condiciones biológicas: el concepto de una reacción de "clic" se ha utilizado en quimioproteómica., farmacológicas y diversas aplicaciones biomiméticas. Sin embargo, se han hecho notablemente útiles en la detección, localización y cualificación de biomoléculas.
Las reacciones de clic ocurren en una olla , no se ven perturbadas por el agua , generan subproductos mínimos e inofensivos y están "cargadas por resorte", caracterizadas por una alta fuerza impulsora termodinámica que las impulsa rápida e irreversiblemente a un alto rendimiento de un solo producto de reacción, con alta especificidad de reacción (en algunos casos, con especificidad tanto regio como estereo). Estas cualidades hacen que las reacciones de clic sean especialmente adecuadas para el problema de aislar y seleccionar moléculas en entornos biológicos complejos. En tales entornos, los productos deben ser fisiológicamente estables y cualquier subproducto debe ser no tóxico (para sistemas in vivo ).
Mediante el desarrollo de reacciones bioortogonales específicas y controlables , los científicos han abierto la posibilidad de alcanzar objetivos específicos en lisados celulares complejos. Recientemente, los científicos han adaptado la química del clic para su uso en células vivas, por ejemplo, utilizando sondas de moléculas pequeñas que encuentran y se adhieren a sus objetivos mediante reacciones de clic. A pesar de los desafíos de la permeabilidad celular, la bioortogonalidad, el etiquetado de fondo y la eficiencia de la reacción, las reacciones de clic ya han demostrado ser útiles en una nueva generación de experimentos desplegables (en los que se pueden aislar objetivos particulares utilizando, por ejemplo, moléculas indicadoras que se unen a una determinada columna) y espectrometría de fluorescencia (en la que el fluoróforose adjunta a un objetivo de interés y el objetivo cuantificado o localizado). Más recientemente, se han utilizado métodos novedosos para incorporar compañeros de reacción de clic en biomoléculas, incluida la incorporación de aminoácidos no naturales que contienen grupos reactivos en proteínas y la modificación de nucleótidos . Estas técnicas representan una parte del campo de la biología química , en el que la química del clic juega un papel fundamental al acoplar intencional y específicamente unidades modulares para varios fines.
El término "química del clic" fue acuñado por K. Barry Sharpless en 1998, y Sharpless, Hartmuth Kolb y MG Finn del Instituto de Investigación Scripps lo describieron completamente por primera vez en 2001. [1] [2]
La química de clic es un método para unir una sonda o sustrato de interés a una biomolécula específica, un proceso llamado bioconjugación . La posibilidad de unir fluoróforos y otras moléculas indicadoras ha convertido a la química del clic en una herramienta muy poderosa para identificar, localizar y caracterizar biomoléculas antiguas y nuevas.
Uno de los primeros y más importantes métodos de bioconjugación fue expresar un reportero en el mismo marco de lectura abierto que una biomolécula de interés. En particular, GFP se expresó primero (y aún se expresa) de esta manera en el extremo N o C de muchas proteínas. Sin embargo, este enfoque presenta varias dificultades. Por ejemplo, GFP es una unidad muy grande y, a menudo, puede afectar el plegamiento de la proteína de interés. Además, al expresarse en cualquiera de los extremos, el aducto de GFP también puede afectar el direccionamiento y la expresión de la proteína deseada. Finalmente, con este método, las GFP solo se pueden unir a proteínas y no postraduccionalmente, dejando otras clases biomoleculares importantes ( ácidos nucleicos , lípidos , carbohidratos, etc.) fuera de su alcance.