Ácido dihidroximalónico
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ácido dihidroxipropanodioico | |
| Otros nombres Ácido mesoxálico monohidrato Ácido oxomalónico monohidrato Ácido cetomalónico monohidrato | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.008.372 |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 3 H 4 O 6 | |
| Masa molar | 136,059 g · mol −1 |
| Punto de fusion | 119 a 120 ° C (246 a 248 ° F; 392 a 393 K) |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
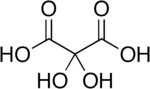
El ácido dihidroximalónico es un compuesto orgánico de fórmula C 3 H 4 O 6 o HO- (C = O) -C (OH) 2 - (C = O) -OH, que se encuentra en algunas plantas como la alfalfa y la melaza de remolacha . [2]
El compuesto también se llama ácido dihidroximesoxálico y ácido dihidroxipropanodioico . Puede verse como un derivado hidrato del ácido mesoxálico y, a menudo, se le llama ácido mesoxálico monohidrato y nombres similares. [3] Este compuesto es inusual por contener grupos hidroxi geminales estables .
El ácido dihidroximalónico es un sólido blanco soluble en agua. Se cristaliza en delicuescentes prismas que se funden entre 113 ° C y 121 ° C sin pérdida de agua. [4] Se ha utilizado en la investigación médica como un agente hipoglucemiante [5] y fue patentado en los Estados Unidos en 1997 como una acción rápida antídoto para el cianuro envenenamiento. [6]
Síntesis
El ácido dihidroximalónico se puede obtener sintéticamente por hidrólisis de aloxano con agua de barita , [2] calentando ácido caffúrico [7] con una solución de acetato de plomo , [4] por electrólisis de ácido tartárico en solución alcalina, [8] o a partir de diacetato de glicerina y concentrado ácido nítrico en el frío. El producto puede obtenerse también por oxidación de ácido tartrónico [9] o glicerol . [10]
Reacciones
Como los ácidos cetónicos hidratados típicos, se reduce en solución acuosa mediante amalgama de sodio a ácido tartrónico y también se combina con fenilhidrazina e hidroxilamina . Reduce las soluciones de plata amoniacal . Cuando se calienta con urea a 100 ° C, forma alantoína . Al hervir continuamente su solución acuosa, se descompone en dióxido de carbono y ácido glioxílico .
Ver también
- Ácido malónico
Referencias
- ^ Índice Merck , 12a edición, 5971 .
- ↑ a b Deichsel, Theodor (1864). "Ueber die Mesoxalsäure" . J. Prakt. Chem. (en alemán). 93 (1): 193-208. doi : 10.1002 / prac.18640930139 .
- ^ ET Urbansky, WJ Bashe (2000). Journal of Chromatography A, volumen 867, págs. 143-149.
- ↑ a b Henry Enfield Roscoe (1888), Tratado de Química , volumen 3, parte 2 Química orgánica , p. 161. D. Appleton and Co., Nueva York.
- ^ Yoshito KOBAYASHI, Shigeru OHASHI, Shinzaburo TANAKA y Akitoshi SHIOYA (1955), Acción hipoglucémica del mesoxalato de sodio con especial referencia a la hiperfunción del sistema cortical pituitario-adrenal en perros expuestos al frío [ enlace muerto permanente ] . Proceedings of the Japan Academy, volumen 31, número 8, págs. 493–497.
- ^ Método para el tratamiento de la intoxicación por cianuro
- ↑ La estructura química del ácido cafeúrico se dio en Allen, WF (1932). La preparación y reordenamiento molecular pirolítico [sic] de los 8-éteres de cafeína: y su conversión en 8-metil y 8-etilcafeína. Ann Arbor, Michigan: Edwards Brothers.
- ↑ (1922), Chem. Zentralblatt III, 871
- ^ Ciriminna, Rosaria (2004). "Oxidación de ácido tartrónico y dihidroxiacetona a mesoxalato de sodio mediada por TEMPO". Letras de tetraedro . 45 (34): 6381–6383. doi : 10.1016 / j.tetlet.2004.07.021 .
- ^ Ciriminna, Rosaria (2003). "Oxidación homogénea y heterogénea de un solo recipiente de glicerol a ácido cetomalónico mediada por TEMPO". Síntesis y catálisis avanzada . 345 (3): 383–388. doi : 10.1002 / adsc.200390043 .
- Ácidos dicarboxílicos
- Dioles geminales