 | |
 | |
| Nombres | |
|---|---|
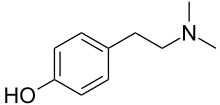
| Nombre IUPAC 4- (2-dimetilaminoetil) fenol | |
| Otros nombres N , N- dimetiltiramina; Peyocactina; Anhaline | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.007.920 |
| KEGG | |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 10 H 15 N O | |
| Masa molar | 165,236 g · mol −1 |
| Apariencia | sólido incoloro |
| Punto de fusion | 116 a 117 ° C (241 a 243 ° F; 389 a 390 K) |
| Punto de ebullición | 173 ° C (343 ° F; 446 K) a 11 mm Hg; sublima a 140-150 ° C |
| alto en: etanol; éter; cloroformo | |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
La hordenina ( N , N -dimetiltiramina ) es un alcaloide de la clase fenetilamina que se encuentra naturalmente en una variedad de plantas, y toma su nombre de una de las más comunes, la cebada ( especie Hordeum ). Químicamente, la hordenina es el N -metil derivado de N -metiltiramina , y el N , N -dimetil derivado de la conocida amina tiramina biogénica , de la que se deriva biosintéticamente y con la que comparte algunas propiedades farmacológicas (véase más adelante). A septiembre de 2012[actualizar], la hordenina se vende ampliamente como ingrediente de suplementos nutricionales, con las afirmaciones de que es un estimulante del sistema nervioso central y tiene la capacidad de promover la pérdida de peso al mejorar el metabolismo. En animales de experimentación, administrados en dosis suficientemente grandes por vía parenteral (por inyección), la hordenina produce un aumento de la presión arterial, así como otras alteraciones de los sistemas cardiovascular, respiratorio y nervioso. Estos efectos generalmente no se reproducen mediante la administración oral del fármaco en animales de prueba, y prácticamente no se han publicado informes científicos sobre los efectos de la hordenina en seres humanos.
Ocurrencia [ editar ]
El primer informe del aislamiento de una fuente natural del compuesto que ahora se conoce como hordenina fue realizado por Arthur Heffter en 1894, quien extrajo este alcaloide del cactus Anhalonium fissuratus (ahora reclasificado como Ariocarpus fissuratus ), nombrándolo "anhalin". [1] Doce años más tarde, E. Léger aisló de forma independiente un alcaloide al que llamó hordenina a partir de semillas germinadas de cebada ( Hordeum vulgare ). [2] Ernst Späth demostró posteriormente que estos alcaloides eran idénticos y propuso la estructura molecular correcta para esta sustancia, por lo que finalmente se retuvo el nombre "hordenina". [3]
La hordenina está presente en una gama bastante amplia de plantas, especialmente entre los cactus, [4] pero también se ha detectado en algunas algas y hongos. [5] [6] [7] Ocurre en pastos y se encuentra en concentraciones significativamente altas en las plántulas de cereales como la cebada ( Hordeum vulgare ) (alrededor de 0.2%, o 2000 μg / g), mijo proso ( Panicum miliaceum ) (alrededor de 0,2%) y sorgo ( Sorghum vulgare ) (alrededor de 0,1%). [6] Reti, en su revisión de 1953 de fenetilaminas naturales, señala que la fuente más rica de hordenina es el cactus Trichocereus candicans.(ahora reclasificado como Echinopsis candicans ), que se encontró que contenía 0.5–5.0% del alcaloide. [8]
Dado que la cebada, a través de su conversión en malta , se utiliza ampliamente en la producción de cerveza , varios grupos de investigadores han examinado la cerveza y la malta para detectar la presencia de hordenina. Citando un estudio de 1965 de McFarlane, [9] Poocharoen informó que la cerveza contenía ~ 12-24 mg / L, el mosto contenía aproximadamente 11-13 mg / ly la malta contenía aproximadamente 67 μg / g de hordenina. [10] El contenido de hordenina de varias maltas y fracciones de malta fue ampliamente estudiado por el propio Poocharoen, quien también proporcionó una buena cobertura de la literatura relacionada hasta 1983. Este investigador encontró una concentración media de hordenina en la cebada cruda [a]alrededor de 0,7 μg / g; en maltas verdes (es decir, cebada que se remojó en agua durante 2 días y luego germinó durante 4 días), la concentración media fue de aproximadamente 21 μg / g, y en maltas horneadas (es decir, maltas verdes que se habían calentado en un horno durante 1– 2 días), la concentración media fue de aproximadamente 28 μg / g. Cuando solo se examinaron las raíces de malta verde, su contenido medio de hordenina fue de aproximadamente 3363 μg / g, mientras que el nivel medio en las raíces de malta en horno fue de alrededor de 4066 μg / g. [10]
En la cebada, los niveles de hordenina alcanzan un máximo entre 5 y 11 días después de la germinación, luego disminuyen lentamente hasta que solo quedan trazas después de un mes. Además, la hordenina se localiza principalmente en las raíces. [11] Al comparar los valores de la literatura para las concentraciones de hordenina en la "cebada" o la "malta" de cebada, por lo tanto, debe tenerse en cuenta la edad y las partes de la planta que se analizan: la cifra de alrededor de 2000 μg / g citada en la revisión de Smith, [6] por ejemplo, es consistente con las cifras de Poocharoen [10] para los niveles de hordenina en las raíces de la cebada malteada, pero no en la malta "entera", donde sus cifras de 21-28 μg / g son más consistentes con las de McFarlane. cifra de aproximadamente 67 μg / g. [9]Sin embargo, se observa una amplia gama de variabilidad; un estudio de Lovett y colaboradores de 43 líneas de cebada diferentes encontró concentraciones de hordenina en las raíces que iban de 1 a 2625 μg / g de peso fresco. Estos investigadores concluyeron que la producción de hordenina no estaba bajo un control genético significativo, pero era mucho más susceptible a factores ambientales como la duración de la luz. [12]
Biosíntesis [ editar ]
La hordenina se biosintetiza mediante la N- metilación escalonada de tiramina , que primero se convierte en N -metiltiramina y que, a su vez, se metila en hordenina. El primer paso en esta secuencia se logra mediante la enzima tiramina N-metiltransferasa (tiramina metilferasa), pero no se sabe si la misma enzima es responsable de la segunda metilación que realmente produce hordenina. [11] [13]
Química [ editar ]
Basicidad [ editar ]
Dado que la molécula de hordenina contiene un grupo funcional básico (amina) y ácido (fenol), es anfótera .
Los pK a s aparentes (véase el artículo original para la discusión) para la hordenina protonada son 9,78 (H fenólico) y 10,02 (H amonio). [14]
Las sales comunes son clorhidrato de hordenina, [15] R-NH 3 + Cl - , pf 178 ° C, y sulfato de hordenina, [16] (R-NH 3 + ) 2 SO 4 2− , pf 211 ° C.
El " clorhidrato de metilhordenina " que figura como ingrediente en las etiquetas de algunos suplementos nutricionales es con toda probabilidad simplemente clorhidrato de hordenina, ya que la "descripción" de "clorhidrato de metilhordenina" proporcionada por prácticamente todos los proveedores a granel de esta sustancia corresponde a la siguiente para el clorhidrato de hordenina (o posiblemente solo hordenina). [17] Cinco compuestos regioisoméricos corresponderían al nombre "metil hordenina HCl", si se interpretara de acuerdo con las reglas de la nomenclatura química: α-metil hordenina , β-metil hordenina , 2-metil hordenina , 3-metil hordenina y 4-O-metil hordenina- cada uno en forma de su sal de HCl; La N -metilhordenina se conoce mejor como el producto natural candicina , pero se excluye de las posibilidades porque es una sal de amonio cuaternario que no puede protonarse y, por lo tanto, no puede formar una sal de hidrocloruro.
Síntesis [ editar ]
La primera síntesis de hordenina se debe a Barger: el alcohol 2-feniletílico se convirtió primero en cloruro de 2-feniletilo usando PCl 5 ; este cloruro se hizo reaccionar con dimetilamina para formar N, N-dimetil-feniletilamina, que después se nitra usando HNO 3 ; la N, N-dimetil-4-nitrofenetilamina se redujo a N, N-dimetil-4-aminofetilamina con Sn / HCl; esta amina finalmente se convirtió en hordenina mediante diazotación / hidrólisis usando NaNO 2 / H 2 SO 4 / H 2 O. [18]
Chang y colaboradores describieron una ruta sintética más eficiente, y también proporcionaron referencias a síntesis anteriores. Esta síntesis comenzó con alcohol p -metoxi-feniletílico, que se desmetiló en O simultáneamente y se convirtió en yoduro por calentamiento con HI; El yoduro de p-hidroxi-feniletilo resultante se calentó luego con dimetilamina para dar hordenina. [19]
La hordenina radiomarcada se ha preparado mediante la hidrogenación de una mezcla de 2- [ 14 C] -tiramina y 40% de formaldehído en presencia de un 10% de catalizador de Pd sobre carbón. La C etiquetada en la hordenina es, por tanto, la C que es β- a la N. [20]
También se ha preparado hordenina marcada con 14 C en la posición α- con respecto al N, [21] al igual que la hordenina con una marca 14 C en ambos grupos N-metilo. [22]
Farmacología [ editar ]
El primer estudio farmacológico de la hordenina que se registra es el de Heffter, quien también fue el primero en aislarla. Usando la sal de sulfato (ver "Química"), Heffter administró una dosis subcutánea de 0,3 g a un gato de 2,8 kg (aproximadamente 107 mg / kg) y no observó efectos además de vómitos violentos; el gato se comportó normalmente en 45 minutos. También tomó una dosis de 100 mg por vía oral él mismo, sin experimentar ningún efecto observable. Sin embargo, se observó que el alcaloide produce una parálisis del sistema nervioso en las ranas. [1]
Trabajando con el sulfato de hordenina de Léger (ver "Ocurrencia"), Camus determinó dosis letales mínimas para el perro, conejo, cobaya y rata (ver "Toxicología"). Los síntomas asociados de toxicidad después de dosis parenterales fueron: excitación, vómitos, dificultades respiratorias, convulsiones y parálisis, y la muerte se produjo como resultado de un paro respiratorio. [23] En un artículo posterior, Camus informó que la administración intravenosa (IV) de algunos cientos de mg de sulfato de hordenina a perros o conejos provocó un aumento de la presión arterial y cambios en el ritmo y la fuerza de contracción del corazón, destacando también que el fármaco no era activo por vía oral. [24]
Los efectos cardiovasculares y de otro tipo de la hordenina fueron revisados en detalle por Reitschel, escribiendo en 1937. [25]
Frank et al., Llevaron a cabo estudios más modernos, quienes informaron que la administración intravenosa de 2 mg / kg de hordenina a los caballos producía una dificultad respiratoria sustancial, aumentaba la frecuencia respiratoria en un 250%, duplicaba la frecuencia cardíaca y provocaba sudoración sin cambios en la frecuencia cardíaca. temperatura corporal basal o comportamiento. Todos los efectos desaparecieron en 30 minutos. La misma dosis de hordenina administrada por vía oral no produjo ninguno de los efectos observados después de la administración parenteral. [26]
En un estudio de 1995, Hapke y Strathmann informaron que en perros y ratas, la hordenina produjo un efecto inotrópico positivo en el corazón (es decir, aumentó la fuerza de contracción), aumentó la presión arterial sistólica y diastólica y aumentó el volumen del flujo sanguíneo periférico. Se inhibieron los movimientos del intestino. Experimentos adicionales en tejido aislado llevaron a estos investigadores a concluir que la hordenina era un agente adrenérgico de acción indirecta que producía sus efectos farmacológicos al liberar norepinefrina (NE) almacenada . [27]
Se encontró que la hordenina es un sustrato selectivo para MAO-B , de hígado de rata, con K m = 479 μM y V max = 128 nM / mg de proteína / h. No fue desaminado por MAO-A del epitelio intestinal de rata. [28]
A diferencia de la tiramina , la hordenina no produjo la contracción de los conductos deferentes de rata aislados , pero una concentración de 25 µM del fármaco potenció su respuesta a dosis submáximas de NE e inhibió su respuesta a la tiramina. Sin embargo, la respuesta a la NE de los conductos deferentes aislados tomados de ratas tratadas crónicamente con guanetidina no se vio afectada por la hordenina. Los investigadores concluyeron que la hordenina actuaba como inhibidor de la recaptación de NE en los conductos deferentes de las ratas. [28]
Se ha encontrado que la hordenina es un potente estimulante de la liberación de gastrina en la rata, siendo esencialmente equipotente con N-metiltiramina : 83 nM / kg de hordenina (correspondiente a aproximadamente 14 mg / kg de la base libre) mejorando la liberación de gastrina en aproximadamente un 60%. . [29]
En un estudio de los efectos de una gran cantidad de compuestos en un receptor de trazas de amina de rata (rTAR1) expresado en células HEK 293 , la hordenina, a una concentración de 1 μM, tenía una potencia casi idéntica a la de la misma concentración de β-fenetilamina. en la estimulación de la producción de AMPc a través de rTAR1. La potencia de la tiramina en esta preparación de receptor fue ligeramente superior a la de la hordenina. [30]
Toxicología [ editar ]
DL 50 en ratones, por administración intraperitoneal (IP): 299 mg / kg. [31] Otros valores de DL 50 dados en la literatura son:> 100 mg / kg (ratón; IP), [32] como sal de HCl: 113,5 mg / kg (ratón; vía de administración no especificada) [33] Dosis letal mínima ( como sal sulfato): 300 mg / kg (perro; IV); 2000 mg / kg (perro; oral); 250 mg / kg (conejo; IV); 300 mg / kg (conejillo de indias; IV); 2000 mg / kg (conejillo de indias; subcutáneo); aproximadamente 1000 mg / kg (rata; subcutáneo). [23]
A partir de experimentos destinados a identificar la toxina responsable de producir el trastorno locomotor ("tambaleos") y la toxicosis cardíaca rápidamente letal ("muerte súbita") que se observan periódicamente en el ganado que se alimenta de la hierba Phalaris aquatica , los investigadores australianos determinaron que las dosis más bajas de hordenina que induciría síntomas de "tambaleo" en ovejas fueron 20 mg / kg IV y 800 mg / kg por vía oral. Sin embargo, la hordenina no pudo evidenciar los síntomas cardíacos de "muerte súbita". [34]
Aunque la hordenina es capaz de reaccionar con agentes nitrosantes (por ejemplo, ion nitrito, NO 2 - ) para formar el carcinógeno N-nitrosodimetilamina (NDMA), y se investigó como un posible precursor de las cantidades significativas de NDMA que alguna vez se encontraron en la cerveza, [10] finalmente se estableció que los niveles de hordenina presentes en la malta eran demasiado bajos para explicar los niveles observados de NDMA. [35]
Farmacocinética [ editar ]
Se ha estudiado la farmacocinética de la hordenina en caballos. Después de la administración intravenosa del fármaco, se encontró que la fase α T 1/2 era de aproximadamente 3 minutos y la fase β T 1/2 era de aproximadamente 35 minutos. [26]
Interacciones de insectos [ editar ]
Se ha descubierto que la hordenina actúa como un elemento disuasorio de la alimentación de los saltamontes ( Melanoplus bivittatus ), [36] y de las orugas de Heliothis virescens y Heliothis subflexa ; la concentración estimada de hordenina que redujo la duración de la alimentación al 50% del control fue 0,4 M para H. virescens y 0,08 M para H. subflexa . [37]
Interacciones de plantas [ editar ]
La hordenina tiene algunas propiedades inhibidoras del crecimiento de las plantas: Liu y Lovett informaron que, a una concentración de 50 ppm, redujo la longitud de la radícula en las plántulas de mostaza blanca ( Sinapis alba ) en alrededor de un 7%; la mezcla con una cantidad igual de gramina mejoró notablemente este efecto inhibidor. [38]
Ver también [ editar ]
- Tiramina
- N-metiltiramina
- Candicina
- N, N-dimetildopamina
- 4-hidroxianfetamina
- Pholedrine
- O-desmetilvenlafaxina
- Venlafaxina
Notas [ editar ]
- ^ El nivel de hordenina en la cebada sin germinar es insignificante, pero aumenta a medida que avanza la germinación (la primera parte del proceso de "malteado"). [10]
Referencias [ editar ]
- ↑ a b Heffter, A. (1894). "Ueber Pellote". Arco. Exp. Sendero. Pharmakol . 34 : 6586.
- ^ Léger, E. (1906). "Sur l'hordenine: alcaloide nouveau retiré des germes, dits touraillons, de l'orge". Compt. Desgarrar. (en francés). 142 : 108-10.
- ↑ Späth, E. (1919). "Über die Anhalonium-Alkaloide. I. Anhalin und Mezcalin". Monatschefte für Chemie (en alemán). 40 : 129–54.
- ^ "Guía de cactus visionario" . erowid.org . Consultado el 14 de enero de 2021 .
- ^ Wheaton, TA; Stewart, I. (junio de 1970). "La distribución de tiramina, N-metiltiramina, hordenina, octopamina y sinefrina en plantas superiores". Lloydia . 33 : 244–54. PMID 5495514 .
- ↑ a b c Smith, TA (1977). "Fenetilamina y compuestos relacionados en plantas". Fitioquímica . 16 : 9-18.
- ^ Lundstrom, J. (1989). A. Brossi (ed.). "β-Fenetilaminas y efedrinas de origen vegetal". Los alcaloides . 35 : 77-154.
- ↑ Reti, L. (1953). RHF Manske; HL Holmes (eds.). "Revisar". Los alcaloides . Nueva York: Academic Press. 3 : 313–38.
- ↑ a b McFarlane, WD (1965). "Aminas derivadas de tirosina y fenoles en mosto y cerveza". Proc. Europ. Elaborar cerveza. Conv. : 387.
- ↑ a b c d e Poocharoen, B. (1983). Determinación de alcaloides amínicos secundarios y terciarios seleccionados en malta de cebada (Tesis doctoral) . oregonstate.edu (Tesis). La Universidad Estatal de Oregon.
- ^ a b Mann, JD; Mudd, SH (1963). "Alcaloides y metabolismo vegetal IV. La tiramina metilferasa de las raíces de la cebada" . Revista de Química Biológica . 238 : 381–85 . Consultado el 14 de enero de 2021 .
- ^ Lovett, JV; Hoult, AHC; Christen, O. (1994). "Metabolitos secundarios biológicamente activos de la cebada. IV. Producción de hordenina por diferentes líneas de cebada". J. Chem. Ecol . 20 : 1945–54.
- ^ "Metabolismo de la tirosina - vía de referencia" . Enciclopedia de genes y genomas de Kyoto , a través de genome.jp.
- ^ Kappe, T .; Armstrong, MD (1965). "Espectros de absorción ultravioleta y constantes de disociación ácida aparente de algunas aminas fenólicas". J. Med. Chem . 8 : 368–74.
- ^ CAS No. 6027-23-2
- ^ CAS No. 622-64-0
- ^ Ver, por ejemplo: http://www.alibaba.com/showroom/methyl-hordenine-hcl.html
- ^ G. Barger (1909). "Síntesis de hordenina, el alcaloide de la cebada". J. Chem. Soc., Trans. 95 2193-2197.
- ^ C.-S. Chang y col. (1951). "Una nueva síntesis de hordenina y otros p-dialquilaminoetilfenoles y algunos de sus derivados". J. Am Chem. Soc. " 73 4081-4084.
- ^ GA Digenis, JW Burkett y V. Mihranian (1972). "Una síntesis conveniente de 2- [ 14 C] -hordenina". J. Cmpds etiquetados. 8 231-235.
- ^ CA Russo y EG Gross (1981). "Síntesis de 4- (2- (dimetilamino) etil-2- 14 C) fenol (hordenina-α- 14 C)". J. Cmpds etiquetados. y Radiopharm. 18 1185.
- ^ CA Russo y EG Gross (1983). "Metabolismo de [metil- 14 C 2 ] hordenina enplantas de Hordeum vulgare ". Fitoquímica 22 1839-1840.
- ↑ a b L. Camus (1906). "L'hordénine, son degré de toxicité, symptômes de l'intoxication". Compt. Desgarrar. 142 110-113.
- ^ L. Camus (1906), "Action de sulfate d'hordenine sur circulación". Compt. Desgarrar. 142 237-239.
- ^ HG Reitschel (1937). "Zur Pharmakologie des Hordenins". Arco. Exp. Sendero. Pharmakol. 186 387-408.
- ^ a b M. Frank y col. (1990). "Hordenina: farmacología, farmacocinética y efectos conductuales en el caballo". Veterinario equino. J. 22 437-441.
- ^ HJ Hapke y W. Strathmann (1995). "Efectos farmacológicos de la hordenina". Dtsch. Tierarztl. Wochenschr. 102 228-232.
- ^ a b C. J. Barwell y col. (1989). "Desaminación de la hordenina por la monoamino oxidasa y su acción sobre los conductos deferentes de la rata". J. Pharm. Pharmacol. 41 421-423.
- ^ Yokoo, Y .; et al. (1999). "Aislamiento de la cerveza y determinación estructural de un potente estimulante de la liberación gástrica" . Alcohol y alcoholismo . 34 : 161–68.
- ^ Bunzow, JR; Sonders, MS; Arttamangkul, S .; et al. (2001). "La anfetamina, la 3,4-metilendioximetanfetamina, la dietilamida del ácido lisérgico y los metabolitos de los neurotransmisores de catecolaminas son agonistas de un receptor de trazas de amina de rata" (PDF) . Farmacología molecular . La Sociedad Estadounidense de Farmacología y Terapéutica Experimental. 60 : 1181–88 - a través de semanticscholar.org. CS1 maint: varios nombres: lista de autores ( enlace )
- ^ M. Shinoda y col. (1977) Yakugaku Zasshi 97 1117-1124
- ^ LM Batista y RN de Almeida (1997) Acta Farm. Bonaerense 16 83-86.
- ^ Índice Merck (10ª ed.). Rahway, Nueva Jersey: Merck & Co. 1983. p. 687.
- ^ CA Bourke, MJCarrigan y RJ Dixon (1988) Aust. Veterinario. J. 65 218-220.
- ^ B. Poocharoen y col. (1992). "Precursores de N-nitrosodimetilamina en cebada malteada. 1. Determinación de hordenina y gramina". J. Agric. Food Chem. 40 2216-2221.
- ^ KLS Harley (1967). "La influencia de los productos químicos de las plantas en el comportamiento de alimentación, el desarrollo y la supervivencia del saltamontes de dos rayas, Melanoplus bivittatus (Sap), Aeridae: Orthoptera". Can J. Zool. 45 305-319.
- ^ EA Bernays y col. (2000). "La sensibilidad gustativa de los insectos herbívoros a los elementos de disuasión es mayor en los especialistas que en los generalistas: una prueba de comportamiento de la hipótesis con dos orugas estrechamente relacionadas". J. Chem. Ecol. 26 547-563.
- ^ Liu, DL; Lovett, JV (1993). "Metabolitos secundarios biológicamente activos de la cebada. II. Fitotoxicidad de los aleloquímicos de la cebada". J. Chem. Ecol . 19 : 2231–44.