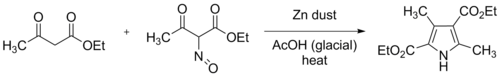Síntesis de pirrol de Knorr
| Síntesis de pirrol de Knorr | |
|---|---|
| Lleva el nombre de | Ludwig Knorr |
| Tipo de reacción | Reacción de formación de anillo |
| Identificadores | |
| ID de ontología RSC | RXNO: 0000497 |
La síntesis de pirrol de Knorr es una reacción química ampliamente utilizada que sintetiza pirrol sustituidos (3) . [1] [2] [3] El método implica la reacción de una α- amino - cetona (1) y un compuesto que contiene un grupo atractor de electrones (por ejemplo, un éster como se muestra) α a un grupo carbonilo (2) . [4]
Método
El mecanismo requiere zinc y ácido acético como catalizadores. Procederá a temperatura ambiente. Debido a que las α-amino-cetonas se autocondensan muy fácilmente, deben prepararse in situ . La forma habitual de hacer esto es a partir de la oxima relevante , a través de la transposición de Neber . [5] [6]
La síntesis original de Knorr empleó dos equivalentes de acetoacetato de etilo , uno de los cuales se convirtió en 2-oximinoacetoacetato de etilo disolviéndolo en ácido acético glacial y agregando lentamente un equivalente de nitrito de sodio acuoso saturado , bajo enfriamiento externo. Luego se agitó el polvo de zinc , reduciendo el grupo oxima a la amina. Esta reducción consume dos equivalentes de zinc y cuatro equivalentes de ácido acético.
La práctica moderna consiste en añadir la solución de oxima resultante de la nitrosación y el polvo de zinc gradualmente a una solución bien agitada de acetoacetato de etilo en ácido acético glacial. La reacción es exotérmica y la mezcla puede alcanzar el punto de ebullición si no se aplica enfriamiento externo. El producto resultante, 3,5-dimetilpirrol-2,4-dicarboxilato de dietilo, se ha denominado pirrol de Knorr desde entonces. En el esquema anterior, R 2 = COOEt y R 1 = R 3 = Me representan esta reacción original.
El pirrol de Knorr puede derivatizarse de varias formas útiles. Un equivalente de hidróxido de sodio saponificará selectivamente el 2-éster. Disolver el pirrol de Knorr en ácido sulfúrico concentrado y luego verter la solución resultante en agua hidrolizará selectivamente el grupo 4-éster. El grupo 5-metilo se puede oxidar de diversas formas a funcionalidad clorometilo, aldehído o ácido carboxílico mediante el uso de cloruro de sulfurilo estequiométrico en ácido acético glacial. [7] Alternativamente, el átomo de nitrógeno puede alquilarse. Las dos posiciones de éster se pueden diferenciar más suavemente incorporando bencilo o terc- butilogrupos a través de los correspondientes ésteres de acetoacetato. Los grupos bencilo se pueden eliminar mediante hidrogenólisis catalítica sobre paladio sobre carbono , y los grupos butilo terciario se pueden eliminar mediante tratamiento con ácido trifluoroacético o ácido acético acuoso hirviendo. R 1 y R 3 (así como R 2 y "Et") pueden ser variadas mediante la aplicación de beta-cetoésteres apropiados fácilmente hechas por una síntesis que emana de cloruros de ácido , ácido de Meldrum y el alcohol de la elección de uno. Los ésteres etílico y bencílico se preparan fácilmente de este modo, y la reacción es notable porque incluso el alcohol terc- butílico altamente impedidoda rendimientos muy altos en esta síntesis. [8]
Levi y Zanetti ampliaron la síntesis de Knorr en 1894 al uso de acetilacetona (2,4-pentanodiona) en reacción con 2-oximinoacetoacetato de etilo. El resultado fue acetato de 4-acetil-3,5-dimetilpirrol-2-carboxilato de etilo, en donde "OEt" = R 1 = R 3 = Me, y R 2 = COOEt. [9] El grupo 4-acetilo podría convertirse fácilmente en un grupo 4-etilo por reducción de Wolff-Kishner (hidrazina y álcali, calentados); hidrogenólisis o el uso de diborano . Los acetoacetatos de bencilo o terc- butilo también funcionan bien en este sistema, y con un control estricto de la temperatura, el sistema de terc- butilo da un rendimiento muy alto (cercano al 80%). [10] Las N , N- dialquil pirrol-2- y / o 4-carboxamidas pueden prepararse mediante el uso de N , N- dialquil acetoacetamidas en la síntesis. Incluso se han preparado con éxito tioésteres utilizando el método. [11] En cuanto a la nitrosación de β-cetoésteres, a pesar de las numerosas especificaciones bibliográficas de estricto control de temperatura en la nitrosación, la reacción se comporta casi como una titulación, y se puede permitir que la mezcla alcance incluso 40 ° C sin afectar significativamente el resultado final. producir.
El mecanismo de la síntesis de pirrol de Knorr comienza con la condensación de la amina y la cetona para dar una imina. Luego, la imina se tautomeriza a una enamina, seguida de ciclación, eliminación de agua e isomerización a pirrol.
Síntesis relacionada
Hay una serie de síntesis importantes de pirroles que funcionan a la manera de la síntesis de Knorr, a pesar de tener mecanismos de conectividad muy diferentes entre los materiales de partida y el producto pirrólico.
Hans Fischer y Emmy Fink encontraron que la síntesis de Zanetti a partir de 2,4-pentanodiona y 2-oximinoacetoacetato de etilo dio 3,5-dimetilpirrol-2-carboxilato de etilo como un subproducto de trazas. De manera similar, el dietil acetal de 3-cetobutiraldehído condujo a la formación de 5-metilpirrol-2-carboxilato de etilo. Ambos productos resultaron de la pérdida del grupo acetilo del intermedio 2-aminoacetoacetato de etilo inferido. Un producto importante de la síntesis de Fischer-Fink fue el 4,5-dimetilpirrol-2-carboxilato de etilo, elaborado a partir de 2-oximinoacetoacetato de etilo y 2-metil-3-oxobutanal, a su vez elaborado por la condensación de Claisen de 2-butanona con formiato de etilo. . [12]
George Kleinspehn informó que la conectividad Fischer-Fink podría verse forzada a ocurrir exclusivamente, mediante el uso de dietil oximinomalonato en la síntesis, con 2,4-pentanodiona, o sus derivados 3-alquil sustituidos. Los rendimientos fueron elevados, en torno al 60%, y esta síntesis acabó siendo una de las más importantes del repertorio. [13] Los rendimientos mejoraron significativamente mediante el uso de aminomalonato de dietilo preformado (preparado mediante la hidrogenólisis de oximinomalonato de dietilo en etanol, sobre Pd / C), y la adición de una mezcla de aminomalonato de dietilo y la β-dicetona a ácido acético glacial hirviendo activamente. . [14]
Mientras tanto, Johnson había ampliado la síntesis de Fischer-Fink haciendo reaccionar ésteres de 2-oximinoacetoacetato (etilo, bencilo o butilo terciario), con 2,4-pentanodionas sustituidas con 3-alquilo. [15] La síntesis de Kleinspehn se amplió con David Dolphin mediante el uso de β-dicetonas asimétricas (como 2,4-hexanodionas sustituidas con 3-alquilo), que reaccionaron preferentemente inicialmente en el grupo acetilo menos impedido y produjeron el 5-metilpirrol correspondiente. Ésteres de -2-carboxilato. N , NTambién se encontró que las 2-dialquil 2-oximinoacetoacetamidas dan pirroles cuando reaccionan en condiciones de Knorr con 2,4-pentanodionas 3-sustituidas, en rendimientos comparables a los ésteres correspondientes (alrededor del 45%). Sin embargo, cuando se usaron dicetonas asimétricas, se encontró que el grupo acetilo de la acetoacetamida se retenía en el producto y uno de los grupos acilo de la dicetona se había perdido. [16] Este mismo mecanismo ocurre en menor grado en los sistemas de ésteres de acetoacetato, y previamente había sido detectado radioquímicamente por Harbuck y Rapoport . [17] La mayoría de las síntesis descritas anteriormente tienen aplicación en la síntesis de porfirinas, pigmentos biliares y dipirrinas.
Referencias
- ^ Knorr, Ludwig (1884). "Synthese von Pyrrolderivaten" [Síntesis de derivados de pirrol]. Berichte der deutschen chemischen Gesellschaft (en alemán). 17 (2): 1635–1642. doi : 10.1002 / cber.18840170220 .
- ^ Knorr, Ludwig (1886). "Synthetische Versuche mit dem Acetessigester" [Experimentos sintéticos con el éster de ácido acetoacético]. Annalen der Chemie (en alemán). 236 (3): 290–332. doi : 10.1002 / jlac.18862360303 .
- ^ Knorr, L .; Lange, H. (1902). "Ueber die Bildung von Pyrrolderivaten aus Isonitrosoketonen" [Sobre la formación de derivados de pirrol a partir de isonitrosocetonas]. Berichte der deutschen chemischen Gesellschaft (en alemán). 35 (3): 2998–3008. doi : 10.1002 / cber.19020350392 .
- ^ Corwin, Alsoph Henry (1950). "La química del pirrol y sus derivados". En Elderfield, Robert Cooley (ed.). Compuestos heterocíclicos . 1 . Nueva York: Wiley . págs. 287 y sigs.
- ^ Fischer, Hans (1935). "2,4-dimetil-3,5-dicarbetoxipirrol (ácido 2,4-pirrolledicarboxílico, 3,5-dimetil-, éster dietílico)" . Síntesis orgánicas . 15 : 17. doi : 10.15227 / orgsyn.015.0017 .; Volumen colectivo , 2 , p. 202
- ^ Fischer, Hans (1941). "Criptopirrol (pirrol, 2,4-dimetil-3-etilo)" . Síntesis orgánicas . 21 : 67. doi : 10.15227 / orgsyn.021.0067 .; Volumen colectivo , 3 , p. 513
- ^ Corwin, Alsoph H .; Bailey, William A .; Viohl, Paul (1942). "Investigaciones estructurales sobre un dipirrilmetano sustituido. Una relación de simetría de punto de fusión inusual". Revista de la Sociedad Química Estadounidense . 64 (6): 1267–1273. doi : 10.1021 / ja01258a007 .
- ^ Oikawa, Yuji; Sugano, Kiyoshi; Yonemitsu, Osamu (1978). "Ácido de Meldrum en síntesis orgánica. 2. Una síntesis general y versátil de β-cetoésteres". La Revista de Química Orgánica . 43 (10): 2087-2088. doi : 10.1021 / jo00404a066 .
- ^ Zanetti, CU; Levi, E. (1894). "Sintesi di composti pirrolici dai nitrosochetoni" [Síntesis de compuestos pirrol a partir de nitrosocetonas]. La Gazzetta Chimica Italiana (en italiano). 24 (1): 546–554.
- ^ Treibs, Alfred ; Hintermeier, Karl (1954). " tert -Butylester von Pyrrolcarbonsäuren". Chemische Berichte (en alemán). 87 (8): 1167-1174. doi : 10.1002 / cber.19540870818 .
- ^ Bullock, E .; Chen, TS; Cargador, CE (1966). "Preparación y reacciones de algunos ésteres de piriltiol". Revista canadiense de química . 44 (9): 1007-1111. doi : 10.1139 / v66-149 .
- ^ Fischer, Hans ; Fink, Emmy (1948). "Über eine neue Pyrrolsynthese" [Sobre una nueva síntesis de pirroles]. Zeitschrift für Physiologische Chemie (en alemán). 283 (3–4): 152–161. doi : 10.1515 / bchm2.1948.283.3-4.152 .
- ^ Kleinspehn, George G. (1955). "Una ruta novedosa hacia ciertos ésteres y nitrilos 2-pirrolcarboxílicos". Revista de la Sociedad Química Estadounidense . 77 (6): 1546-1548. doi : 10.1021 / ja01611a043 .
- ^ Paine, John B .; Delfín, David (1985). "Química de pirrol. Una síntesis mejorada de ésteres de etil pirrol-2-carboxilato de dietil aminomalonato". La Revista de Química Orgánica . 50 (26): 5598–5604. doi : 10.1021 / jo00350a033 .
- ^ Bullock, E .; Johnson, AW; Markham, E .; Shaw, KB (1958). "287. Una síntesis de coproporfirina III". Revista de la Sociedad Química (reanudación) : 1430-1440. doi : 10.1039 / JR9580001430 .
- ^ Paine, John B .; Brough, Jonathan R .; Buller, Kathy K .; Erikson, Erika E .; Delfín, D. (1987). "Mecanismo de formación de N , N -dialquil-2-pirrolcarboxamidas a partir de 1,3-dicetonas y N , N -dialquiloximinoacetoacetamidas". La Revista de Química Orgánica . 52 (18): 3993–3997. doi : 10.1021 / jo00227a010 .
- ^ Rapoport, Henry ; Harbuct, John W. (1971). "Mecanismo de una condensación pirrol modificada de Knorr". La Revista de Química Orgánica . 36 (6): 853–855. doi : 10.1021 / jo00805a030 .
Ver también
- Síntesis de pirrol de Hantzsch
- Síntesis de Paal-Knorr
- Reacciones de formación de anillos
- Reacciones de formación de heterociclo de nitrógeno
- Reacciones de formación de heterociclo
- Reacciones de formación de enlaces carbono-heteroátomo
- Reacciones de formación de enlaces carbono-carbono
- Reacciones de nombres