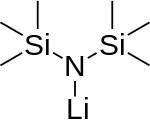
 Monómero (no existe) | |
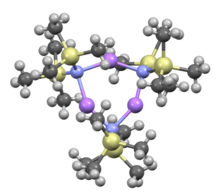
 Trímero cíclico | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 1,1,1-trimetil- N - (trimetilsilil) silanaminida de litio | |
| Otros nombres Hexametildisilazida de litio de sal de litio de hexametildisilazano | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| ChemSpider | |
| Tarjeta de información ECHA | 100.021.569 |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 6 H 18 LiNSi 2 | |
| Masa molar | 167,326 g / mol |
| Apariencia | Blanco sólido |
| Densidad | 0,86 g / cm 3 a 25 ° C |
| Punto de fusion | 71 a 72 ° C (160 a 162 ° F; 344 a 345 K) |
| Punto de ebullición | 80 a 84 ° C (176 a 183 ° F; 353 a 357 K) (0,001 mm Hg) |
| se descompone | |
| Solubilidad | La mayoría de los disolventes apróticos THF , hexano , tolueno |
| Acidez (p K a ) | 26 |
| Peligros | |
| Principales peligros | inflamable, corrosivo |
| Compuestos relacionados | |
Compuestos relacionados | Bis (trimetilsilil) amida de sodio Bis (trimetilsilil) amida de potasio |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
La bis (trimetilsilil) amida de litio es un compuesto de organosilicio litiado con la fórmula LiN (SiMe 3 ) 2 . Se abrevia comúnmente como LiHMDS ( li thium h exa m acetato de d i s ilazide - una referencia a sus ácidos conjugados HMDS ) y se utiliza principalmente como una fuerte base no nucleófila y como ligando . Como muchos reactivos de litio, tiene tendencia a agregarse y formará un trímero cíclico en ausencia de especies coordinadas.
Preparación [ editar ]
LiHMDS está disponible comercialmente, pero también se puede preparar mediante la desprotonación de bis (trimetilsilil) amina con n-butillitio . [1] Esta reacción se puede realizar in situ . [2]
- HN (SiMe 3 ) 2 + C 4 H 9 Li → LiN (SiMe 3 ) 2 + C 4 H 10
Una vez formado, el compuesto se puede purificar por sublimación o destilación .
Reacciones y aplicaciones [ editar ]
Como base [ editar ]
LiHMDS se utiliza a menudo en química orgánica como una base fuerte no nucleofílica . [3] Su ácido conjugado tiene un pKa de ~ 26, [4] por lo que es menos básico que otras bases de litio, como LDA (pKa del ácido conjugado ~ 36), pero tiene más impedimentos estéricos y, por lo tanto, es menos nucleófilo . Puede usarse para formar varios compuestos de organolitio , incluidos acetiluros [3] o enolatos de litio . [2]
Como tal, encuentra uso en una variedad de reacciones de acoplamiento, particularmente reacciones de formación de enlaces carbono-carbono como la alquilación de Fráter-Seebach y las condensaciones de Claisen mixtas .
Una síntesis alternativa de tetranitruro de tetrasulfuro implica el uso de [(Me 3 Si) 2 N] 2 S como precursor con enlaces S – N preformados. [(Me 3 Si) 2 N] 2 S se prepara mediante la reacción de bis (trimetilsilil) amida de litio y dicloruro de azufre (SCl 2 ).
- 2 [(CH 3 ) 3 Si] 2 NLi + SCl 2 → [((CH 3 ) 3 Si) 2 N] 2 S + 2 LiCl
El [((CH 3 ) 3 Si) 2 N] 2 S reacciona con la combinación de SCl 2 y cloruro de sulfurilo (SO 2 Cl 2 ) para formar S 4 N 4 , cloruro de trimetilsililo y dióxido de azufre: [5]
- 2 [((CH 3 ) 3 Si) 2 N] 2 S + 2SCl 2 + 2SO 2 Cl 2 → S 4 N 4 + 8 (CH 3 ) 3 SiCl + 2SO 2
Como ligando [ editar ]
LiHMDS puede reaccionar con una amplia gama de haluros metálicos , mediante una reacción de metátesis de sal , para dar bis (trimetilsilil) amidas metálicas .
- MX x + x Li (hmds) → M (hmds) x + x LiX
- (X = Cl, Br, I y a veces F)
Los complejos de bis (trimetilsilil) amida de metal son lipofílicos debido al ligando y, por lo tanto, son solubles en una variedad de disolventes orgánicos apolares , lo que a menudo los hace más reactivos que los haluros metálicos correspondientes, que pueden ser difíciles de solubilizar. El volumen estérico de los ligandos hace que sus complejos sean discretos y monoméricos; aumentando aún más su reactividad. Al tener una base incorporada, estos compuestos reaccionan convenientemente con precursores de ligandos próticos para dar otros complejos metálicos y, por lo tanto, son precursores importantes de compuestos de coordinación más complejos . [6]
Usos de nicho [ editar ]
LiHMDS es volátil y se ha discutido para su uso para la deposición de la capa atómica de compuestos de litio. [7]
Estructura [ editar ]
Como muchos reactivos de organolitio , la bis (trimetilsilil) amida de litio puede formar agregados en solución. El grado de agregación depende del solvente. En la coordinación de disolventes, como éteres [8] y aminas , [9] prevalecen el monómero y el dímero . En el estado monomérico y dimérico, una o dos moléculas de disolvente se unen a los centros de litio. Con amoniaco como base donante, la bis (trimetilsilil) amida de litio forma un monómero trisolvatado que se estabiliza mediante enlaces de hidrógeno intermoleculares. [10] [11] En disolventes no coordinantes, como aromáticos o pentano , los oligómeros complejospredominan, incluido el trímero. [9] En estado sólido, la estructura es trimérica. [12]
| Aducto LiHMDS con TMEDA | Dímero solvatado de THF : (LiHMDS) 2 • THF 2 | Trimer, libre de solventes: (LiHMDS) 3 | ||
Ver también [ editar ]
- Amida de litio
- Diisopropilamida de litio
- Tetrametilpiperidida de litio
Referencias [ editar ]
- ^ Amonoo-Neizer, EH; Shaw, RA; Skovlin, DO; Smith, BC (1966). "Bis (trimetilsilil) amida de litio y tris (trimetilsilil) amina ". Inorg. Synth. Síntesis inorgánica. 8 : 19-22. doi : 10.1002 / 9780470132395.ch6 . ISBN 978-0-470-13239-5.
- ^ a b Danheiser, RL; Miller, RF; Brisbois, RG (1990). "Transferencia de grupo diazo detrifluoroacetilativo: ( E ) -1-Diazo-4-fenil-3-buten-2-ona" . Síntesis orgánicas . 73 : 134.; Volumen colectivo , 9 , p. 197
- ^ a b Wu, George; Huang, Mingsheng (julio de 2006). "Reactivos de organolitio en procesos asimétricos farmacéuticos". Revisiones químicas . 106 (7): 2596–2616. doi : 10.1021 / cr040694k . PMID 16836294 .
- ^ Fraser, Robert R .; Mansour, Tarek S .; Savard, Sylvain (agosto de 1985). "Medidas de acidez en piridinas en tetrahidrofurano utilizando sililaminas litiadas". La Revista de Química Orgánica . 50 (17): 3232–3234. doi : 10.1021 / jo00217a050 .
- ^ Maaninen, A .; Shvari, J .; Laitinen, RS; Chivers, T (2002). Coucouvanis, Dimitri (ed.). "Compuestos de interés general". Síntesis inorgánica . Nueva York: John Wiley & Sons, Inc. 33 : 196–199. doi : 10.1002 / 0471224502.ch4 .
- ^ Michael Lappert , Andrey Protchenko, Philip Power , Alexandra Seeber (2009). Química de amidas metálicas . Weinheim: Wiley-VCH. doi : 10.1002 / 9780470740385 . ISBN 0-470-72184-7.CS1 maint: multiple names: authors list (link)
- ^ Hämäläinen, Jani; Holopainen, Jani; Munnik, Frans; Hatanpää, Timo; Heikkilä, Mikko; Ritala, Mikko; Leskelä, Markku (2012). "Películas delgadas de fosfato de litio cultivadas por deposición de capa atómica". Revista de la Sociedad Electroquímica . 159 (3): A259 – A263. doi : 10.1149 / 2.052203jes .
- ^ Lucht, Brett L .; Collum, David B. (1995). "Solvatación etérea de hexametildisilazida de litio: relaciones inesperadas de número de solvatación, energía de solvatación y estado de agregación". Revista de la Sociedad Química Estadounidense . 117 (39): 9863–9874. doi : 10.1021 / ja00144a012 .
- ↑ a b Lucht, Brett L .; Collum, David B. (1996). "Solvatación de iones de litio: aminas e hidrocarburos insaturados solvatos de hexametildisilazida de litio (LiHMDS)". Revista de la Sociedad Química Estadounidense . 118 (9): 2217–2225. doi : 10.1021 / ja953029p .
- ^ Neufeld, R .; Michel, R .; Herbst-Irmer, R .; Schöne, R .; Stalke, D. (2016). "Introducción de un donante de enlace de hidrógeno en una base Brønsted débilmente nucleófila: hexametildisilazidas de metales alcalinos (MHMDS, M = Li, Na, K, Rb y Cs) con amoníaco". Chem. EUR. J. 22 : 12340–12346. doi : 10.1002 / quím.201600833 . PMID 27457218 .
- ^ Neufeld, R .: Determinación del peso molecular de la curva de calibración externa DOSY como una metodología valiosa para caracterizar intermedios reactivos en solución. En: eDiss, Georg-August-Universität Göttingen. 2016.
- ^ Rogers, Robin D .; Atwood, Jerry L .; Grüning, Rainer (1978). "La estructura cristalina de N -litiohexametildisilazano, [LiN (SiMe 3 ) 2 ] 3 ". J. Organomet. Chem. 157 (2): 229–237. doi : 10.1016 / S0022-328X (00) 92291-5 .