Mad2
| Componente de punto de control de husillo mitótico Mad2 | ||||||
|---|---|---|---|---|---|---|
| Identificadores | ||||||
| Organismo | ||||||
| Símbolo | Mad2 | |||||
| Alt. simbolos | YJL030W | |||||
| Entrez | 853422 | |||||
| RefSeq (ARNm) | NM_001181464 | |||||
| RefSeq (Prot) | NP_012504 | |||||
| UniProt | P40958 | |||||
| Otros datos | ||||||
| Cromosoma | X: 0,39 - 0,39 Mb | |||||
| ||||||
Mad2 (paro mitótico deficiente 2) es una proteína esencial del punto de control del huso . El sistema de eje de control es un sistema de regulación que restringe la progresión a través de la metafase -a-- anafase transición. El gen Mad2 se identificó por primera vez en la levadura S. cerevisiae en un cribado de genes que, al mutar, conferirían sensibilidad a los venenos de los microtúbulos . [1] Los ortólogos humanos de Mad2 ( MAD2L1 y MAD2L2 ) se clonaron por primera vez en una búsqueda de ADNc humanos que rescataran la sensibilidad al veneno de los microtúbulos de una cepa de levadura en la que faltaba una proteína de unión al cinetocoro .[2] Se demostró que la proteína está presente en cinetocoros no unidos y los estudios de inhibición de anticuerpos demostraron que era esencial ejecutar un bloqueo en la transición de metafase a anafase en respuesta al veneno de microtúbulos nocodazol . [2] La posterior clonación delortólogo de Xenopus laevis , facilitada por el intercambio de la secuencia humana, permitió la caracterización del punto de control mitótico en extractos de óvulos. [3]
Transición de metafase a anafase
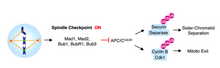
La progresión de la metafase a la anafase está marcada por la separación de las cromátidas hermanas . El mecanismo de vigilancia del ciclo celular que evita la separación de cromátidas hermanas y la transición a la anafase se denomina punto de control del huso. Como protección contra los errores de segregación cromosómica, el punto de control del ensamblaje del huso (SAC) retrasa la anafase hasta que todos los pares de cromátidas hermanas se han unido bipolarmente.
Una vez que los microtúbulos se unen a los cinetocoros, los cromosomas se alinean en la placa de metafase y se logra la biorientación adecuada, se eliminan los mecanismos de detención de la SAC. La entrada en anafase está mediada por la activación de APCCdc20. APCCdc20 es una ligasa de ubiquitina-proteína que marca la proteína, securina, para su destrucción. La destrucción de Securin libera y activa su compañera de proteasa unida, la separasa. La separasa unida a la securina permanece inhibida; sin embargo, cuando se alivia la inhibición, la separasa activada escinde el complejo de cohesina que une a las cromátidas hermanas. [5]
Sin Cdc20, el complejo promotor de anafase (APC) no puede activarse y no se activa la anafase. Se demostró que Mad2 inhibe la actividad de las APC por interacción física directa [6] en un complejo ternario con Cdc20. [7] Los cinetocoros que permanecen separados de los microtúbulos catalizan el secuestro de Cdc20 por Mad2. De hecho, cuando las células de mamífero en metafase se tratan con el agente despolimerizante del huso nocodazol, las proteínas Mad2 se localizan en los cinetocoros de todos los pares de cromátidas hermanas. [5]
Conformers mad2
Mad2 es capaz de formar multímeros y adopta al menos dos conformaciones estructurales . El Mad2 abierto se diferencia del Mad2 cerrado en el posicionamiento del segmento C-terminal de 50 residuos . Este "cinturón de seguridad" se sujeta firmemente contra el lado derecho de la proteína en la conformación abierta. Al aflojarlo, el cinturón de seguridad se puede volver a colocar alrededor de un compañero de sujeción. En la conformación cerrada, el cinturón de seguridad envuelve el ligando unido e interactúa con una región diferente de Mad2. Los socios vinculantes de Mad2 incluyen Cdc20 o Mad1. Mad1 y Cdc20 se unen a Mad2 de forma idéntica. Mad2 usa el mismo sitio para unir Mad1 o Cdc20 y, por lo tanto, solo puede unir una de las dos proteínas a la vez. [5]
Activación Mad2 en el punto de control del montaje del husillo
Dado que los cinetocoros independientes establecen y mantienen el SAC, Mad2 se recluta para evitar que estas cromátidas hermanas desalineadas se separen. Cuando se activa el punto de control / proceso de frenado, Mad2 une Mad1 para formar complejos Closed-Mad2-Mad1. Dado que Mad1: Mad2 es un complejo estable y Cdc20 y Mad1 unen Mad 2 en el mismo sitio de enlace, es muy poco probable que Closed Mad2 libere Mad1 para unir Cdc20.
Un modelo, que explica que Mad2 adopte una conformación capaz de unir Cdc20, se basa primero en la formación del complejo central Mad1-Mad2. En este modelo, Open Mad2 externo se recluta para la plantilla Mad1: Mad2. Se cree que esta interacción Mad1: Mad2 permite un cambio conformacional que permite que el Open Mad2 unido periféricamente interactúe con Cdc20. Cdc20: Mad2 luego se disocia y Mad1: Mad2 se habilita para unirse de nuevo a un Mad2 citosólico libre. [8]
Se especula que una vez formados, los complejos Cdc20: Mad2 pueden amplificar la señal de espera de anafase estimulando una conversión adicional de Mad2 abierta citosólica y Cdc20 libre en más complejos Cdc20: Mad2 cerrada. Esta propagación de señal difusible lejos de los complejos de cinetocoro podría explicar cómo la vacancia de un solo sitio diminuto de cinetocoro puede cerrar por completo la transición de metafase a anafase. [9]
Trabajo futuro
Queda mucho por explicar sobre la señalización del punto de control del huso y la contribución de otras proteínas de ensamblaje del punto de control del huso como Bub1 , BubR1 y Bub3 . BubR1 y Bub3 también pueden formar complejos con Cdc20, pero queda por ver si estas proteínas facilitan la unión de Cdc20 a Open Mad2. [9]
Tampoco está claro cómo p31comet antagoniza el punto de control y promueve la disociación de Mad2-Cdc20. De Antoni y col. junto con la "Plantilla Mad2" sugieren que p31comet compite con Open Mad2 por vincularse a Closed Mad2: Mad1. Se están realizando pruebas para aclarar cómo p31comet puede silenciar el punto de control del husillo. [10]
Referencias
- ↑ Li R, Murray AW (1991). "Control de retroalimentación de la mitosis en levadura en ciernes". Celular . 66 (3): 519–31. doi : 10.1016 / 0092-8674 (81) 90015-5 . PMID 1651172 . S2CID 11306198 .
- ↑ a b Li Y, Benezra R (1996). "Identificación de un gen de punto de control mitótico humano: hsMAD2". Ciencia . 274 (5285): 246–8. Código bibliográfico : 1996Sci ... 274..246L . doi : 10.1126 / science.274.5285.246 . PMID 8824189 . S2CID 41334564 .
- ^ Chen RH, Waters JC, Salmon ED, Murray AW (octubre de 1996). "Asociación del componente de punto de control de ensamblaje del husillo XMAD2 con cinetocoros sueltos". Ciencia . 274 (5285): 242–6. Código Bibliográfico : 1996Sci ... 274..242C . doi : 10.1126 / science.274.5285.242 . PMID 8824188 . S2CID 20142555 .
- ^ a b Yu H (abril de 2006). "Activación estructural de Mad2 en el punto de control del huso mitótico: el modelo Mad2 de dos estados frente al modelo de plantilla Mad2" . J. Cell Biol . 173 (2): 153–7. doi : 10.1083 / jcb.200601172 . PMC 2063805 . PMID 16636141 .
- ↑ a b c Morgan DL (2007). El ciclo celular: principios de control . Londres: Publicado por New Science Press en asociación con Oxford University Press. ISBN 978-0-87893-508-6.
- ^ Li Y, Gorbea C, Mahaffey D, Rechsteiner M, Benezra R (noviembre de 1997). "MAD2 se asocia con el complejo promotor de ciclosoma / anafase e inhibe su actividad" . Proc. Natl. Acad. Sci. USA . 94 (23): 12431–6. Código bibliográfico : 1997PNAS ... 9412431L . doi : 10.1073 / pnas.94.23.12431 . PMC 24983 . PMID 9356466 .
- ^ Wassmann K, Benezra R (septiembre de 1998). "Mad2 se asocia transitoriamente con un complejo APC / p55Cdc durante la mitosis" . Proc. Natl. Acad. Sci. USA . 95 (19): 11193–8. Código Bibliográfico : 1998PNAS ... 9511193W . doi : 10.1073 / pnas.95.19.11193 . PMC 21618 . PMID 9736712 .
- ^ Hardwick KG (febrero de 2005). "Señalización de puestos de control: conformadores Mad2 y propagación de señales" . Curr. Biol . 15 (4): R122–4. doi : 10.1016 / j.cub.2005.02.008 . PMID 15723780 .
- ↑ a b Nasmyth K (marzo de 2005). "¿Cómo son tan pocos los que controlan a tantos?" . Celular . 120 (6): 739–46. doi : 10.1016 / j.cell.2005.03.006 . PMID 15797376 .
- ^ De Antoni A, Pearson CG, Cimini D, Canman JC, Sala V, Nezi L, Mapelli M, Sironi L, Faretta M, Salmon ED, Musacchio A (febrero de 2005). "El complejo Mad1 / Mad2 como plantilla para la activación de Mad2 en el punto de control de montaje del husillo". Curr. Biol . 15 (3): 214-25. doi : 10.1016 / j.cub.2005.01.038 . PMID 15694304 . S2CID 3224122 .
- Genes de Saccharomyces cerevisiae
![[4]](http://upload.wikimedia.org/wikipedia/commons/0/0b/Mad2conformers.png)