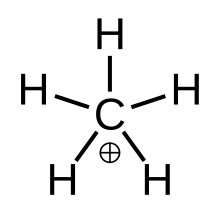
 Metanio "verdadero", el estado de transición metaestable CH+ 5 | |
 Metanio, CH 3(H 2)+ | |
| Nombres | |
|---|---|
| Otros nombres carbonio (desaconsejado debido a múltiples definiciones) [1] | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| |
| |
| Propiedades | |
| CH 5 + | |
| Masa molar | 17.050 g · mol −1 |
| Base conjugada | Metano |
| Estructura | |
| triangular bipiramidal | |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
En química , el metanio es un ion positivo complejo con fórmula [ CH
3(H
2) ] + , es decir, una molécula con un átomo de carbono unido a tres átomos de hidrógeno y una molécula de hidrógeno, que tiene una carga eléctrica +1 . Es un superácido y uno de los iones de cebolla , de hecho, el ión de carbonio más simple .
El metanio se puede producir en el laboratorio como un gas enrarecido o como una especie diluida en superácidos. Fue preparado por primera vez en 1950 y publicado en 1952 por Victor Talrose y su asistente Anna Konstantinovna Lyubimova. [2] [3] Ocurre como una especie intermedia en reacciones químicas.
El ion metanio lleva el nombre de metano ( CH
4), por analogía con la derivación del ion amonio ( NH+
4) de amoniaco ( NH
3).
Estructura [ editar ]
El metanio se puede visualizar como un CH+
3 ion carbenio con una molécula de hidrógeno que interactúa con el orbital vacío en un enlace de 3 centros y 2 electrones . El par de electrones de unión en el H 2 molécula es compartido entre los átomos de dos de hidrógeno y uno de carbono que forman el enlace 3-center-2-electrón. [4]
Los dos átomos de hidrógeno en la molécula de H 2 pueden intercambiar posiciones continuamente con los tres átomos de hidrógeno en el CH.+
3ion (un cambio de conformación llamado pseudorrotación , específicamente el mecanismo de Berry ). Por tanto, el ion metanio se considera una molécula fluxional . La barrera de energía para el intercambio es bastante baja y se produce incluso a temperaturas muy bajas. [5] [6]
Se ha utilizado la espectroscopia infrarroja para obtener información sobre las diferentes conformaciones del ión metanio. [7] [8] [9] El espectro IR del metano simple tiene dos bandas de CH de estiramiento simétrico y asimétrico alrededor de 3000 cm -1 y dos bandas alrededor de 1400 cm -1 de vibraciones de flexión simétricas y asimétricas. En el espectro de CH+
5tres vibraciones de estiramiento asimétricas están presentes alrededor de 2800-3000 cm -1 , una vibración de balanceo a 1300 cm -1 y una vibración de flexión a 1100 1300 cm -1 .
Preparación [ editar ]
El metanio se puede preparar a partir del metano mediante la acción de ácidos muy fuertes, como el ácido fluoroantimónico ( pentafluoruro de antimonio SbF
5en fluoruro de hidrógeno HF). [10]
Aproximadamente a 270 Pa de presión y temperatura ambiente, el ion metano CH+
4reaccionará con metano neutro para producir metanio y un radical metilo : [11]
- CH+
4+ CH
4→ CH+
5+ CH•
3
Estabilidad y reacciones [ editar ]
Los cationes obtenidos por reacción de metano con SbF
5 + HF se estabilizan mediante interacciones con las moléculas de HF.
A bajas presiones (alrededor de 1 mmHg) y temperatura ambiente, el metanio no reacciona con el metano neutro. [11]
Referencias [ editar ]
- ^ Química, Unión Internacional de lo Puro y Aplicado (2009). "ion carbonio" . Compendio de terminología química de la IUPAC . Compendio de terminología química de la IUPAC . IUPAC. doi : 10.1351 / goldbook.C00839 . ISBN 978-0-9678550-9-7. Consultado el 27 de noviembre de 2018 .
- ^ VL Talrose y AK Lyubimova, Dokl. Akad. Nauk SSSR 86, 909-912 (1952).
- ^ Nikolaev, Eugene (1998). "Victor Talrose: un agradecimiento". Revista de espectrometría de masas . 33 (6): 499–501. Código Bibliográfico : 1998JMSp ... 33..499N . doi : 10.1002 / (SICI) 1096-9888 (199806) 33: 6 <499 :: AID-JMS684> 3.0.CO; 2-C . ISSN 1076-5174 .
- ^ Rasul, Golam; Prakash, GK Surya; Olah, George A. (2011). "Estudio comparativo de los iones carbonio hipercoordinados y sus análogos de boro: un desafío para los espectroscopistas". Cartas de Física Química . 517 (1–3): 1–8. Código Bibliográfico : 2011CPL ... 517 .... 1R . doi : 10.1016 / j.cplett.2011.10.020 .
- ^ Schreiner, Peter R .; Kim, Seung-Joon; Schaefer, Henry F .; von Ragué Schleyer, Paul (1993). " CH +
5: ¿La historia interminable o la última palabra? ". Journal of Chemical Physics . 99 (5): 3716-3720. Doi : 10.1063 / 1.466147 . - ^ Müller, Hendrik; Kutzelnigg, Werner; Noga, Jozef; Klopper, Wim (1997). "CH5 +: La historia continúa. Un estudio de clúster acoplado explícitamente correlacionado". Revista de Física Química . 106 (5): 1863. Código Bibliográfico : 1997JChPh.106.1863M . doi : 10.1063 / 1.473340 .
- ^ Blanco, Edmund T .; Tang, Jian; Oka, Takeshi (1999). " CH +
5: El espectro infrarrojo observado ". Science . 284 (5411): 135–7. Bibcode : 1999Sci ... 284..135W . Doi : 10.1126 / science.284.5411.135 . PMID 10102811 . - ^ Oskar Asvany, Padma Kumar P; Redlich, Britta; Hegemann, Ilka; Schlemmer, Stephan; Marx, Dominik (2005). "Comprender el espectro infrarrojo del CH desnudo +
5". Ciencia . 309 (5738):. 1219-1222 bibcode : 2005Sci ... 309.1219A . Doi : 10.1126 / science.1113729 . PMID 15994376 . S2CID 28745636 . - ^ Huang, Xinchuan; McCoy, Anne B .; Bowman, Joel M .; Johnson, Lindsay M .; Salvaje, Chandra; Dong, Feng; Nesbitt, David J. (2006). "Deconstrucción cuántica del espectro infrarrojo de CH + 5" . Ciencia . 311 (5757):. 60-63 bibcode : 2006Sci ... 311 ... 60H . Doi : 10.1126 / science.1121166 . PMID 16400143 . S2CID 26158108 .
- ^ Sommer, J .; Jost, R. (2000). "Iones carbenio y carbonio en la activación de pequeños alcanos catalizada por superácidos líquidos y sólidos" (PDF) . Química pura y aplicada . 72 (12): 2309–2318. doi : 10.1351 / pac200072122309 . S2CID 46627813 .
- ^ a b Campo, FH; Munson, MSB (1965). "Reacciones de iones gaseosos. XIV. Estudios de espectrometría de masas de metano a presiones de 2 Torr". Revista de la Sociedad Química Estadounidense . 87 (15): 3289–3294. doi : 10.1021 / ja01093a001 .