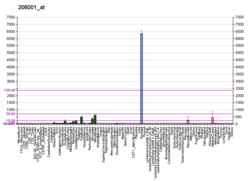
| NPY | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||
| Alias | NPY , PYY4, gen del neuropéptido Y, neuropéptido Y | ||||||||||||||||||||||||
| Identificaciones externas | OMIM : 162640 MGI : 97374 HomoloGene : 697 GeneCards : NPY | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ortólogos | |||||||||||||||||||||||||
| Especies | Humano | Ratón | |||||||||||||||||||||||
| Entrez |
|
| |||||||||||||||||||||||
| Ensembl |
|
| |||||||||||||||||||||||
| UniProt |
|
| |||||||||||||||||||||||
| RefSeq (ARNm) |
|
| |||||||||||||||||||||||
| RefSeq (proteína) |
|
| |||||||||||||||||||||||
| Ubicación (UCSC) | Crónicas 7: 24,28 - 24,29 Mb | Crónicas 6: 49,82 - 49,83 Mb | |||||||||||||||||||||||
| Búsqueda en PubMed | [3] | [4] | |||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Identificadores | |
|---|---|
| Número CAS |
|
| ChemSpider |
|
| UNII |
|
| CHEMBL |
|
| Tablero CompTox ( EPA ) |
|
| Datos químicos y físicos | |
| Fórmula | C 190 H 287 N 55 O 57 |
| Masa molar | 4 253 0,714 g · mol -1 |
| | |
El neuropéptido Y ( NPY ) es un neuropéptido de 36 aminoácidos que participa en varios procesos fisiológicos y homeostáticos tanto en el sistema nervioso central como en el periférico. El NPY ha sido identificado como el péptido más abundante presente en el sistema nervioso central de los mamíferos, que consiste en el cerebro y la médula espinal. Se secreta junto con otros neurotransmisores como GABA y glutamato . [5] [6] [7] [8]
En el sistema autónomo es producido principalmente por neuronas del sistema nervioso simpático y actúa como un vasoconstrictor fuerte y también provoca el crecimiento de tejido graso. [9] En el cerebro, se produce en varios lugares, incluido el hipotálamo , y se cree que tiene varias funciones, que incluyen: aumentar la ingesta de alimentos y el almacenamiento de energía en forma de grasa, reducir la ansiedad y el estrés, reducir la percepción del dolor y afectar el ritmo circadiano. , reduciendo la ingesta voluntaria de alcohol, bajando la presión arterial y controlando los ataques epilépticos. [8] [10]
Función [ editar ]
Se ha identificado que el neuropéptido Y se sintetiza en neuronas GABAérgicas y actúa como neurotransmisor durante la comunicación celular . El neuropéptido Y se expresa principalmente en interneuronas . [11] NPY ejerce la mayoría de sus efectos a través de proteínas receptoras acopladas a proteína G , principalmente Y1, Y2, Y4 e Y6. [7] [8] Se ha indicado que todos los receptores participan en la actividad de transmisión postsináptica , pero también se ha descubierto que el receptor Y2 participa en el procesamiento presináptico . [6]
La proteína receptora sobre la que opera NPY es un receptor acoplado a proteína G en la familia de GPCR 7-transmembrana similar a la rodopsina . Se han identificado cinco subtipos del receptor NPY en mamíferos, cuatro de los cuales son funcionales en humanos. [12] Los subtipos Y1 e Y5 tienen funciones conocidas en la estimulación de la alimentación, mientras que Y2 e Y4 parecen tener funciones en la inhibición del apetito ( saciedad ). Algunos de estos receptores se encuentran entre los receptores de neuropéptidos más conservados [ cita requerida ] .
Se han encontrado altas concentraciones de síntesis y acción del neuropéptido Y en el hipotálamo y el hipocampo , específicamente en el núcleo arqueado (ARC) y la circunvolución dentada . Se ha descubierto que el núcleo arqueado tiene una de las concentraciones más altas de NPY. Esto permite que NPY regule la liberación neuroendocrina de varias hormonas hipotalámicas como la hormona luteinizante . [13] Los receptores del neuropéptido Y1 se han encontrado en la densidad más alta en la circunvolución dentada junto con una variedad de otras áreas del cerebro. [14]
Crecimiento celular [ editar ]
Se ha indicado que el neuropéptido Y desempeña un papel importante en la neurogénesis en varias partes del cerebro. Dos áreas particulares del cerebro en las que el NPY afecta la neurogénesis son la zona subventricular y la circunvolución dentada del hipocampo . Estas áreas son donde se produce el crecimiento y la proliferación celular hasta la edad adulta . [15]
Circunvolución dentada [ editar ]
La circunvolución dentada participa significativamente en la proliferación celular , un proceso modulado por varios factores internos, incluido el neuropéptido Y. La reducción o eliminación del NPY liberado por las interneuronas disminuyó el crecimiento celular en esta área del cerebro. NPY afecta la neurogénesis al interactuar con las vías de señalización de la quinasa ERK . [16] Además, NPY actúa y estimula los receptores Y1 presentes en las membranas de las células progenitoras para aumentar la proliferación celular. [15]
Zona subventricular [ editar ]
De manera similar a la circunvolución dentada, se ha descubierto que el NPY aumenta la proliferación y diferenciación celular en la zona subventricular activando específicamente los receptores Y1 en la vía ERK1 / 2. Además, se encontró NPY en fibras neuronales que atraviesan la zona subventricular y se extienden a otras áreas del cerebro. Se han descubierto una variedad de otros efectos y procesos fisiológicos que involucran al NPY en la zona subventricular, muchos de los cuales involucran patrones de migración de neuronas . [17]
Bulbo olfativo [ editar ]
Se encontró que después de bloquear la expresión de NPY en el epitelio olfatorio de ratón , la cantidad de células precursoras olfativas disminuyó a la mitad. Esto, a su vez, hizo que los ratones desarrollaran una menor cantidad de células olfativas en general. Este estudio ejemplificó la influencia de NPY en las células precursoras . [18]
Descubrimiento [ editar ]
Tras el aislamiento de neuropéptido-y (NPY) del hipotálamo porcino en 1982, los investigadores comenzaron a especular sobre la participación de NPY en funciones mediadas por el hipotálamo. En un estudio de 1983, los terminales axónicos NPY-ergicos se ubicaron en el núcleo paraventricular (PVN) del hipotálamo , y los niveles más altos de inmunorreactividad NPY se encontraron dentro del PVN del hipotálamo. [19]
Seis años después, en 1989, Morris et al. centrado en la ubicación de los núcleos NPYérgicos en el cerebro. Además, los resultados de la hibridación in situ del estudio mostraron los niveles celulares más altos de ARNm de NPY en el núcleo arqueado (ARC) del hipotálamo. [20]
En 1989, Haas & George informaron que la inyección local de NPY en el PVN resultó en una liberación aguda de hormona liberadora de corticotropina (CRH) en el cerebro de rata, lo que demuestra que la actividad NPYérgica estimula directamente la liberación y síntesis de CRH. [21]
Este último se convirtió en un artículo distintivo en los estudios NPY. Ya se había realizado una cantidad significativa de trabajo en la década de 1970 sobre la CRH y su implicación en el estrés y los trastornos alimentarios como la obesidad . [22] Estos estudios, en conjunto, marcaron el comienzo para comprender el papel del NPY en la orexigénesis o la ingesta de alimentos.
Conexión con la ingesta de alimentos [ editar ]
Los ensayos de comportamiento en estudios orexigénicos, en los que las ratas son el organismo modelo, se han realizado colectivamente con inmunoensayos y estudios de hibridación in situ para confirmar que la elevación de la actividad NPY-ergica sí aumenta la ingesta de alimentos. En estos estudios, NPY exógeno, [23] un agonista de NPY como dexametasona [24] o N-acetil [Leu 28, Leu31] NPY (24-36) [25] se inyectan en el tercer ventrículo [23] o en el nivel del hipotálamo con una cánula . [24] [26]
Además, estos estudios demuestran unánimemente que la estimulación de la actividad NPYérgica a través de la administración de ciertos agonistas NPY aumenta la ingesta de alimentos en comparación con los datos de referencia en ratas. Los efectos de la actividad NPYergic sobre la ingesta de alimentos también se demuestran por el bloqueo de ciertos receptores NPY (receptores Y1 e Y5), que, como era de esperar, inhiben la actividad NPYergic; por lo tanto, disminuye la ingesta de alimentos. Sin embargo, un estudio de 1999 de King et al. demostraron los efectos de la activación del autorreceptor NPY Y2, que se ha demostrado que inhibe la liberación de NPY y, por lo tanto, actúa para regular la ingesta de alimentos tras su activación. [27]En este estudio, se administró localmente en el ARC un antagonista de Y2 altamente selectivo, BIIE0246. Los datos del radioinmunoensayo, después de la inyección de BIIE0246, muestran un aumento significativo en la liberación de NPY en comparación con el grupo de control. Aunque la semivida farmacológica del NPY exógeno, otros agonistas y antagonistas todavía es oscura, los efectos no son duraderos y el cuerpo de la rata tiene una excelente capacidad para regular y normalizar los niveles anormales de NPY y, por tanto, el consumo de alimentos. [23]
Conexión con la obesidad [ editar ]
Un estudio en ratas genéticamente obesas para demostrar el papel del NPY en los trastornos alimentarios como la obesidad . Cuatro factores subyacentes que contribuyen a la obesidad en ratas son:
- un aumento de las concentraciones de glucocorticosteroides en plasma ;
- insensibilidad o resistencia a la insulina ;
- mutación del receptor de leptina ; y
- un aumento en la liberación de NPY mRNA y NPY. [28]
En la obesidad se pueden observar niveles crónicamente elevados de NPY, esto se ha visto en ratas alimentadas con una dieta alta en grasas durante 22 semanas y resultó en un trastorno hormonal que aumentó la liberación de NPY, debido a una señal de leptina defectuosa en comparación con las ratas de control. En humanos, se encontraron niveles aumentados de NPY libre en mujeres obesas y no en sus contrapartes más delgadas, sin embargo, analizar el hipotálamo humano para la concentración de NYP es más difícil que en ratas. [29] Durante el destete en ratas hay una expresión temprana de mutaciones genéticas que aumentan la liberación hipotalámica de NPY en ratas, sin embargo, en humanos, múltiples genes se asocian comúnmente con los resultados de obesidad y síndrome metabólico. [29]En la mayoría de los casos de obesidad, el aumento de la secreción de NPY es una resistencia central / hipotalámica a las señales hormonales por exceso de energía, como la leptina, que puede ser el resultado de una variedad de razones en el SNC. En roedores resistentes a la obesidad cuando se alimentaron con una dieta obesogénica, tenían una cantidad significativamente menor de receptor NPY en el hipotálamo, lo que sugiere una mayor actividad de las neuronas NPY en ratas obesas, lo que significa que la reducción en la liberación de NPY puede ser beneficiosa para la reducción de la obesidad. incidencia junto con el consumo de una dieta saludable y ejercicio. Esto debería verse en la investigación en humanos antes de considerar esta vía de pérdida de peso, aunque actualmente hay alguna evidencia que sugiere que el NPY es un predictor significativo en la recuperación de peso después de la pérdida de peso para mantener los niveles anteriores de almacenamiento de energía. [29]
Además, estos factores se correlacionan entre sí. Los altos niveles sostenidos de glucocorticosteroides estimulan la gluconeogénesis , que posteriormente provoca un aumento de la glucosa en sangre que activa la liberación de insulina para regular los niveles de glucosa al provocar su recaptación y almacenamiento como glucógeno en los tejidos del cuerpo. En el caso de la obesidad, que los investigadores especulan que tiene una fuerte base genética y dietética, la resistencia a la insulina previene la regulación alta de la glucosa en sangre, lo que resulta en niveles mórbidos de glucosa y diabetes mellitus . [30]Además, los niveles altos de glucocorticosteroides provocan un aumento de NPY al activar directamente los receptores de glucocorticosteroides tipo II (que se activan solo por niveles relativamente altos de glucocorticosteroides) e, indirectamente, al abolir la retroalimentación negativa del factor de liberación de corticotropina (CRF) en NPY síntesis y liberación. Mientras tanto, la resistencia a la insulina inducida por la obesidad y la mutación del receptor de leptina (ObRb) dan como resultado la abolición de la inhibición de la actividad NPYérgica y, en última instancia, la ingesta de alimentos a través de otros mecanismos de retroalimentación negativa para regularlos. La obesidad en ratas se redujo significativamente mediante adrenalectomía [31] o hipofisectomía . [32]
Importancia clínica [ editar ]
Alcoholismo [ editar ]
El papel del neuropéptido Y ha ganado una atención sustancial por su implicación con el alcoholismo debido a su diversa gama de efectos fisiológicos. Se ha demostrado que las neuronas NPY interactúan con las vías de recompensa y emoción dopaminérgicas en el núcleo accumbens y la amígdala , respectivamente. Se ha demostrado que los niveles de expresión de NPY y la preferencia por el alcohol exhiben una relación inversa . Los niveles de expresión dependen del área de interés del cerebro. Esto indica que los niveles iniciales de NPY posiblemente podrían influir en las preferencias innatas de alcohol. [7]
Estudios anteriores han identificado los efectos ansiolíticos del NPY en un posible objetivo farmacológico terapéutico para el alcoholismo. [33] Como se indicó anteriormente, los niveles de NPY y la ingesta de etanol muestran una relación inversa, por lo tanto, el aumento de la disponibilidad de NPY podría disminuir la ingesta de alcohol. Al crear un antagonista químico para un receptor Y2 que actuaría indirectamente como agonista y estimularía los receptores Y1, el consumo de alcohol se redujo con éxito en ratas. [34] Además, otro estudio similar identificó que la expresión de NPY puede estar relacionada con la regulación del comportamiento en relación con la dependencia del alcohol . Se encontró que la administración de neuropéptido Y reduceComportamiento de borrachera . [35] Aunque, se ha demostrado que la expresión del gen NPY , los niveles de ARNm o neuropéptidos no se ven influenciados por el consumo de alcohol a largo plazo, pero los cambios ocurren durante la abstinencia del alcohol. Estos hallazgos muestran que el neuropéptido Y tiene efectos variables sobre el consumo de alcohol. [34]
Dos resultados sugieren que NPY podría proteger contra el alcoholismo :
- los ratones knock-out en los que se ha eliminado un tipo de receptor NPY muestran una mayor ingesta voluntaria de alcohol y una mayor resistencia a los efectos sedantes del alcohol, en comparación con los ratones normales; [36]
- la mosca de la fruta tiene un neuropéptido que es similar a NPY, conocida como neuropéptido F . Los niveles de neuropéptido F se reducen en las moscas macho sexualmente frustradas, y esto hace que las moscas aumenten su ingesta voluntaria de alcohol. [37]
Estrés y ansiedad [ editar ]
El neuropéptido Y se considera un péptido endógeno ansiolítico y sus niveles pueden ser modulados por el estrés. NPY tiene conexiones con el eje HPA y se cree que es necesario para la modulación de la tensión . [38] Se ha demostrado que niveles más altos de los receptores Y1 e Y5 en la amígdala dan como resultado un nivel reducido de ansiedad . [39] Además, el receptor Y1 se ha relacionado con efectos ansiolíticos en el prosencéfalo, mientras que Y2 se ha asociado con la protuberancia . [11]
Por el contrario, los niveles más altos de NPY pueden estar asociados con la resiliencia y la recuperación del trastorno de estrés postraumático [40] y con la disminución de la respuesta al miedo, lo que permite que los individuos se desempeñen mejor en situaciones de estrés extremo. [41]
Los estudios en ratones y monos muestran que el estrés repetido —y una dieta rica en grasas y azúcares— estimulan la liberación del neuropéptido Y, lo que hace que la grasa se acumule en el abdomen . Los investigadores creen que al manipular los niveles de NPY, podrían eliminar la grasa de las áreas donde no se deseaba y acumularse en los sitios donde se necesitaba. [9] [42]
Ver también [ editar ]
- Anorexia nerviosa
- Antianalgesia
- Neuropéptido
- Obesidad
Referencias [ editar ]
- ^ a b c GRCh38: Lanzamiento de Ensembl 89: ENSG00000122585 - Ensembl , mayo de 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000029819 - Ensembl , mayo de 2017
- ^ "Referencia humana de PubMed:" . Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed del ratón:" . Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ Heilig M, Widerlöv E (1995). "Neurobiología y aspectos clínicos del neuropéptido Y". Revisiones críticas en neurobiología . 9 (2–3): 115–36. PMID 8581979 .
- ↑ a b Decressac M, Barker RA (diciembre de 2012). "Neuropéptido Y y su papel en la reparación y enfermedad del SNC". Neurología experimental . 238 (2): 265–72. doi : 10.1016 / j.expneurol.2012.09.004 . PMID 23022456 . S2CID 15088613 .
- ↑ a b c Robinson SL, Thiele TE (2017). "El papel del neuropéptido Y (NPY) en los trastornos por abuso de alcohol y drogas". El papel de los neuropéptidos en la adicción y los trastornos por consumo excesivo . Revista Internacional de Neurobiología . 136 . págs. 177–197. doi : 10.1016 / bs.irn.2017.06.005 . ISBN 9780128124734. PMID 29056151 .
- ↑ a b c Tatemoto K (2004). "Neuropéptido Y: historia y descripción" . En Michel MC (ed.). Manual de farmacología experimental . 162 . Saltador. págs. 2-15. ISBN 9783540405818.
- ^ a b Kuo LE, Kitlinska JB, Tilan JU, Li L, Baker SB, Johnson MD, Lee EW, Burnett MS, Fricke ST, Kvetnansky R, Herzog H, Zukowska Z (julio de 2007). "El neuropéptido Y actúa directamente en la periferia del tejido graso y media la obesidad inducida por estrés y el síndrome metabólico". Medicina de la naturaleza . 13 (7): 803-11. doi : 10.1038 / nm1611 . PMID 17603492 . S2CID 25675166 .
- ^ Colmers WF, El Bahh B (marzo de 2003). "Neuropéptido Y y epilepsia" . Corrientes de epilepsia . 3 (2): 53–58. doi : 10.1046 / j.1535-7597.2003.03208.x . PMC 321170 . PMID 15309085 .
- ↑ a b Kask A, Harro J, von Hörsten S, Redrobe JP, Dumont Y, Quirion R (mayo de 2002). "Los subtipos de neurocircuitos y receptores que median los efectos ansiolíticos del neuropéptido Y". Revisiones de neurociencia y bioconducta . 26 (3): 259–83. doi : 10.1016 / s0149-7634 (01) 00066-5 . PMID 12034130 . S2CID 34688422 .
- ^ Michel MC, Beck-Sickinger A, Cox H, Doods HN, Herzog H, Larhammar D, Quirion R, Schwartz T, Westfall T (marzo de 1998). "XVI. Recomendaciones de la Unión Internacional de Farmacología para la nomenclatura del neuropéptido Y, el péptido YY y los receptores del polipéptido pancreático". Revisiones farmacológicas . 50 (1): 143–50. PMID 9549761 .
- ^ Acuña-Goycolea C, Tamamaki N, Yanagawa Y, Obata K, van den Pol AN (agosto de 2005). "Mecanismos de neuropéptido Y, péptido YY y polipéptido pancreático inhibición de neuronas GABA que expresan proteína fluorescente verde identificadas en el núcleo arqueado neuroendocrino hipotalámico" . La Revista de Neurociencia . 25 (32): 7406-19. doi : 10.1523 / jneurosci.1008-05.2005 . PMC 6725307 . PMID 16093392 .
- ^ Kautz M, Charney DS, Murrough JW (mayo de 2017). "Neuropéptido Y, resiliencia y terapéutica de TEPT". Cartas de neurociencia . 649 : 164-169. doi : 10.1016 / j.neulet.2016.11.061 . PMID 27913193 . S2CID 3821043 .
- ^ a b Decressac M, Wright B, David B, Tyers P, Jaber M, Barker RA, Gaillard A (marzo de 2011). "El neuropéptido Y exógeno promueve la neurogénesis del hipocampo in vivo". Hipocampo . 21 (3): 233–8. doi : 10.1002 / hipo.20765 . PMID 20095007 . S2CID 4014094 .
- ^ Howell OW, Doyle K, Goodman JH, Scharfman HE, Herzog H, Pringle A, Beck-Sickinger AG, Gray WP (mayo de 2005). "El neuropéptido Y estimula la proliferación de precursores neuronales en la circunvolución dentada postnatal y adulta" . Revista de neuroquímica . 93 (3): 560–70. doi : 10.1111 / j.1471-4159.2005.03057.x . PMID 15836615 . S2CID 1531546 .
- ^ Malva JO, Xapelli S, Baptista S, Valero J, Agasse F, Ferreira R, Silva AP (diciembre de 2012). "Multifaces del neuropéptido Y en el cerebro - neuroprotección, neurogénesis y neuroinflamación". Neuropéptidos . 46 (6): 299-308. doi : 10.1016 / j.npep.2012.09.001 . PMID 23116540 . S2CID 9366746 .
- ^ Hansel DE, Eipper BA, Ronnett GV (abril de 2001). "El neuropéptido Y funciona como factor neuroproliferativo". Naturaleza . 410 (6831): 940–4. doi : 10.1038 / 35073601 . PMID 11309620 . S2CID 4421740 .
- ^ Allen YS, Adrian TE, Allen JM, Tatemoto K, Crow TJ, Bloom SR, Polak JM (agosto de 1983). "Distribución del neuropéptido Y en el cerebro de rata". Ciencia . 221 (4613): 877–9. doi : 10.1126 / science.6136091 . PMID 6136091 .
- ^ Morris BJ (diciembre de 1989). "Localización neuronal de la expresión del gen del neuropéptido Y en cerebro de rata". La Revista de Neurología Comparada . 290 (3): 358–68. doi : 10.1002 / cne.902900305 . PMID 2592617 . S2CID 36876107 .
- ^ Haas DA, George SR (octubre de 1989). "Los efectos inducidos por el neuropéptido Y sobre el contenido y la liberación del factor liberador de corticotropina hipotalámico dependen de la neurotransmisión noradrenérgica / adrenérgica". Investigación del cerebro . 498 (2): 333–8. doi : 10.1016 / 0006-8993 (89) 91112-8 . PMID 2551461 . S2CID 36802464 .
- ^ Edwardson JA, Hough CA (abril de 1975). "El sistema pituitario-adrenal del ratón genéticamente obeso (ob / ob)". La revista de endocrinología . 65 (1): 99–107. doi : 10.1677 / joe.0.0650099 . PMID 167093 .
- ↑ a b c Hanson ES, Dallman MF (abril de 1995). "El neuropéptido Y (NPY) puede integrar las respuestas de los sistemas de alimentación hipotalámicos y el eje hipotálamo-pituitario-adrenal". Revista de neuroendocrinología . 7 (4): 273–9. doi : 10.1111 / j.1365-2826.1995.tb00757.x . PMID 7647769 . S2CID 25471741 .
- ↑ a b White BD, Dean RG, Edwards GL, Martin RJ (mayo de 1994). "La estimulación del receptor de corticosteroides tipo II aumenta la expresión del gen NPY en el hipotálamo basomedial de ratas". La Revista Estadounidense de Fisiología . 266 (5 Pt 2): R1523–9. doi : 10.1152 / ajpregu.1994.266.5.R1523 . PMID 8203629 .
- ^ King PJ, Widdowson PS, Doods HN, Williams G (agosto de 1999). "Regulación de la liberación de neuropéptido Y por ligandos del receptor de neuropéptido Y y antagonistas de los canales de calcio en cortes hipotalámicos" . Revista de neuroquímica . 73 (2): 641–6. doi : 10.1046 / j.1471-4159.1999.0730641.x . PMID 10428060 . S2CID 8022493 .
- ^ Pomonis JD, Levine AS, Billington CJ (julio de 1997). "Interacción del núcleo paraventricular hipotalámico y el núcleo central de la amígdala en el bloqueo de naloxona de la alimentación inducida por el neuropéptido Y revelada por la expresión de c-fos" . La Revista de Neurociencia . 17 (13): 5175–82. doi : 10.1523 / JNEUROSCI.17-13-05175.1997 . PMC 6573318 . PMID 9185555 .
- ^ King PJ, Williams G, Doods H, Widdowson PS (mayo de 2000). "Efecto de un antagonista selectivo del receptor del neuropéptido YY (2), BIIE0246 sobre la liberación del neuropéptido Y". Revista europea de farmacología . 396 (1): R1–3. doi : 10.1016 / S0014-2999 (00) 00230-2 . PMID 10822055 .
- ^ Dryden S, Pickavance L, Frankish HM, Williams G (septiembre de 1995). "Aumento de la secreción de neuropéptido Y en el núcleo paraventricular hipotalámico de ratas Zucker obesas (fa / fa)". Investigación del cerebro . 690 (2): 185–8. doi : 10.1016 / 0006-8993 (95) 00628-4 . PMID 8535835 . S2CID 1857168 .
- ↑ a b c Minor RK, Chang JW, de Cabo R (febrero de 2009). "Hambriento de vida: cómo el núcleo arqueado y el neuropéptido Y pueden desempeñar un papel fundamental en la mediación de los beneficios de la restricción calórica" . Endocrinología molecular y celular . 299 (1): 79–88. doi : 10.1016 / j.mce.2008.10.044 . PMC 2668104 . PMID 19041366 .
- ^ Wilcox G (mayo de 2005). "Insulina y resistencia a la insulina" . El bioquímico clínico. Reseñas . 26 (2): 19–39. PMC 1204764 . PMID 16278749 .
- ^ Yukimura Y, Bray GA (1978). "Efectos de la adrenalectomía sobre el peso corporal y el tamaño y número de células grasas en la rata Zucker (grasa)". Comunicaciones de investigación endocrina . 5 (3): 189–98. doi : 10.1080 / 07435807809083752 . PMID 747998 .
- ^ Powley TL, Morton SA (abril de 1976). "Hipofisectomía y regulación del peso corporal en la rata Zucker genéticamente obesa". La Revista Estadounidense de Fisiología . 230 (4): 982–7. doi : 10.1152 / ajplegacy.1976.230.4.982 . PMID 1267030 .
- ^ Thorsell A, Mathé AA (2017). "Neuropéptido Y en la adicción al alcohol y los trastornos afectivos" . Fronteras en endocrinología . 8 : 178. doi : 10.3389 / fendo.2017.00178 . PMC 5534438 . PMID 28824541 .
- ^ a b Ciccocioppo R, Gehlert DR, Ryabinin A, Kaur S, Cippitelli A, Thorsell A, et al. (Noviembre de 2009). "Neuropéptidos relacionados con el estrés y alcoholismo: CRH, NPY y más allá" . Alcohol . 43 (7): 491–8. doi : 10.1016 / j.alcohol.2009.08.003 . PMC 2804869 . PMID 19913192 .
- ^ Sparrow AM, Lowery-Gionta EG, Pleil KE, Li C, Sprow GM, Cox BR, Rinker JA, Jijon AM, Peňa J, Navarro M, Kash TL, Thiele TE (mayo de 2012). "El neuropéptido central Y modula el consumo excesivo de etanol en ratones C57BL / 6J a través de los receptores Y1 e Y2" . Neuropsicofarmacología . 37 (6): 1409-21. doi : 10.1038 / npp.2011.327 . PMC 3327846 . PMID 22218088 .
- ^ Thiele TE, Koh MT, Pedrazzini T (febrero de 2002). "El consumo voluntario de alcohol se controla a través del receptor del neuropéptido Y Y1" . La Revista de Neurociencia . 22 (3): RC208. doi : 10.1523 / JNEUROSCI.22-03-j0006.2002 . PMC 6758511 . PMID 11826154 .
- ^ "Privados de sexo, las moscas plantadas beben más alcohol" . Centro de noticias de UCSF . 15 de marzo de 2012.
- ^ Reichmann F, Holzer P (febrero de 2016). "Neuropéptido Y: una revisión estresante" . Neuropéptidos . 55 : 99–109. doi : 10.1016 / j.npep.2015.09.008 . PMC 4830398 . PMID 26441327 .
- ^ Dumont Y, Quirion R (diciembre de 2014). "Vías del neuropéptido Y en los trastornos relacionados con la ansiedad". Psiquiatría biológica . 76 (11): 834–5. doi : 10.1016 / j.biopsych.2014.09.015 . PMID 25439997 . S2CID 38147315 .
- ^ Yehuda R, Brand S, Yang RK (abril de 2006). "Concentraciones de neuropéptido Y en plasma en veteranos expuestos al combate: relación con la exposición al trauma, recuperación del trastorno de estrés postraumático y afrontamiento". Psiquiatría biológica . 59 (7): 660–3. doi : 10.1016 / j.biopsych.2005.08.027 . PMID 16325152 . S2CID 33677746 .
- ^ Julie Steenhuysen (16 de febrero de 2009). "La investigación muestra por qué algunos soldados son geniales bajo fuego" .
- ^ Maugh TH (2 de julio de 2007). "La investigación apunta a la forma de eliminar la grasa del vientre" . Chicago Tribune .
Enlaces externos [ editar ]
- Entrada de la base de datos del receptor EMBL
- Neuropéptido Y en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .