Ferricianuro de potasio
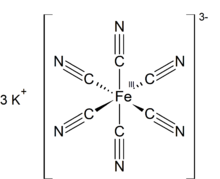 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Hexacianoferrato de potasio (III) | |
| Otros nombres Prusiato rojo de potasa, rojo de Prusia, ferricianuro de potasio | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.033.916 |
| Número CE |
|
| 21683 | |
PubChem CID | |
| Número RTECS |
|
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| K 3 [Fe (CN) 6 ] | |
| Masa molar | 329,24 g / mol |
| Apariencia | cristales de color rojo oscuro, a veces pequeños gránulos, polvo de naranja a rojo oscuro |
| Densidad | 1,89 g / cm 3 , sólido |
| Punto de fusion | 300 ° C (572 ° F; 573 K) |
| Punto de ebullición | se descompone |
| 330 g / L ("agua fría") 464 g / L (20 ° C) 775 g / L ("agua caliente") [1] | |
| Solubilidad | ligeramente soluble en alcohol soluble en ácido soluble en agua |
| + 2290.0 · 10 −6 cm 3 / mol | |
| Estructura | |
| monoclínico | |
| octaédrico en Fe | |
| Riesgos | |
| Ficha de datos de seguridad | MSDS |
| Pictogramas GHS |  |
| Palabra de señal GHS | Advertencia |
Declaraciones de peligro GHS | H302 , H315 , H319 , H332 , H335 |
Consejos de prudencia del SGA | P261 , P264 , P270 , P271 , P280 , P301 + 312 , P302 + 352 , P304 + 312 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 |
| NFPA 704 (diamante de fuego) |  1 0 0 |
| punto de inflamabilidad | No es inflamable |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 2970 mg / kg (ratón, oral) |
| Compuestos relacionados | |
Otros aniones | Ferrocianuro de potasio |
Otros cationes | azul de Prusia |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El ferricianuro de potasio es el compuesto químico de fórmula K 3 [Fe (CN) 6 ]. Esta sal de color rojo brillante contiene el ion [Fe (CN) 6 ] 3− coordinado octaédricamente . [2] Es soluble en agua y su solución muestra algo de fluorescencia verde-amarilla . Fue descubierto en 1822 por Leopold Gmelin , [3] [4]
Preparación
El ferricianuro de potasio se fabrica pasando cloro a través de una solución de ferrocianuro de potasio . El ferricianuro de potasio se separa de la solución:
- 2 K 4 [Fe (CN) 6 ] + Cl 2 → 2 K 3 [Fe (CN) 6 ] + 2 KCl
Estructura
Como otros cianuros metálicos, el ferricianuro de potasio sólido tiene una estructura polimérica complicada. El polímero consta de centros octaédricos [Fe (CN) 6 ] 3− reticulados con iones K + que están unidos a los ligandos CN . [5] Los enlaces K + --- NCFe se rompen cuando el sólido se disuelve en agua.
Aplicaciones
El compuesto también se utiliza para endurecer el hierro y el acero , en galvanoplastia , teñido de lana , como reactivo de laboratorio y como agente oxidante suave en química orgánica .
Planificación y fotografía
El compuesto tiene un uso generalizado en el dibujo de planos y en la fotografía ( proceso de cianotipo ). Varios procesos de tonificación de impresiones fotográficas implican el uso de ferricianuro de potasio.
El ferricianuro de potasio se utilizó como agente oxidante para eliminar la plata de los colores negativos y positivos durante el procesamiento, un proceso llamado blanqueamiento. Debido a que los blanqueadores de ferricianuro de potasio son perjudiciales para el medio ambiente, de corta duración y capaces de liberar gas de cianuro de hidrógeno si se mezclan con altas concentraciones y volúmenes de ácido, los blanqueadores que utilizan EDTA férrico se han utilizado en el procesamiento del color desde la introducción en 1972 del proceso Kodak C-41. . En la litografía en color , el ferricianuro de potasio se usa para reducir el tamaño de los puntos de color sin reducir su número, como una especie de corrección de color manual llamada grabado de puntos. También se utiliza en fotografía en blanco y negro con tiosulfato de sodio.(hipo) para reducir la densidad de un negativo o impresión de gelatina de plata donde la mezcla se conoce como reductor de granjero; esto puede ayudar a compensar los problemas causados por la sobreexposición del negativo o iluminar los aspectos más destacados de la impresión. [6]
Reactivo en síntesis orgánica
El ferricianuro de potasio se utiliza como oxidante en química orgánica. [7] [8] Es un oxidante para la regeneración de catalizadores en dihidroxilaciones Sharpless . [9] [10]
Sensores e indicadores
El ferricianuro de potasio también es uno de los dos compuestos presentes en la solución indicadora de ferroxilo (junto con la fenolftaleína ) que se vuelve azul (azul de Prusia ) en presencia de iones Fe 2+ y que, por lo tanto, puede usarse para detectar la oxidación de metales que conducirá a la oxidación. Es posible calcular el número de moles de iones Fe 2+ usando un colorímetro , debido al color muy intenso del azul de Prusia .
En experimentos de fisiología, el ferricianuro de potasio proporciona un medio para aumentar el potencial redox de una solución (E ° '~ 436 mV a pH 7). Como tal, puede oxidar el citocromo c reducido (E ° '~ 247 mV a pH 7) en mitocondrias aisladas. El ditionito de sodio se usa generalmente como sustancia química reductora en tales experimentos (E ° '~ -420 mV a pH 7).
El ferricianuro de potasio se utiliza para determinar el potencial de poder reductor férrico de una muestra (extracto, compuesto químico, etc.). [11] Esta medida se utiliza para determinar la propiedad antioxidante de una muestra.
El ferricianuro de potasio es un componente de los biosensores amperométricos como agente de transferencia de electrones que reemplaza al agente de transferencia de electrones natural de una enzima, como el oxígeno , como ocurre con la enzima glucosa oxidasa . Es un ingrediente en medidores de glucosa en sangre disponibles comercialmente para uso por diabéticos .
Otro
El ferricianuro de potasio se combina con hidróxido de potasio (o hidróxido de sodio como sustituto) y agua para formular el grabador de Murakami. Este grabador es utilizado por los metalógrafos para proporcionar contraste entre las fases de aglutinante y carburo en carburos cementados.
azul de Prusia
El azul de Prusia , el pigmento azul profundo en la impresión azul, se genera por la reacción de K 3 [Fe (CN) 6 ] con iones ferrosos (Fe 2+ ) así como K 4 [Fe (CN) 6 ] con sales férricas. [12]
En histología , el ferricianuro de potasio se usa para detectar hierro ferroso en tejido biológico. El ferricianuro de potasio reacciona con el hierro ferroso en una solución ácida para producir el pigmento azul insoluble, comúnmente conocido como azul de Turnbull o azul de Prusia . Para detectar hierro férrico (Fe 3+ ), se usa ferrocianuro de potasio en su lugar en el método de tinción con azul de Prusia de Perls . [13] El material formado en la reacción azul de Turnbull y el compuesto formado en la reacción azul de Prusia son los mismos. [14] [15]
La seguridad
El ferricianuro de potasio tiene baja toxicidad, su principal peligro es que es un irritante leve para los ojos y la piel. Sin embargo, en condiciones muy ácidas, se desprende gas de cianuro de hidrógeno altamente tóxico , de acuerdo con la ecuación:
- 6 H + + [Fe (CN) 6 ] 3− → 6 HCN + Fe 3+ [16]
Ver también
- Ferricianuro
- Ferrocianuro
- Ferrocianuro de potasio
Referencias
- ^ Kwong, H.-L. (2004). "Ferricianuro de potasio". En Paquette, L. (ed.). Enciclopedia de reactivos para síntesis orgánica . Nueva York: J. Wiley & Sons. doi : 10.1002 / 047084289X . hdl : 10261/236866 .
- ^ Sharpe, AG (1976). La química de los complejos ciano de los metales de transición . Londres: Academic Press.
- ↑ Gmelin, Leopold (1822). "Ueber ein besonderes Cyaneisenkalium, y über eine neue Reihe von blausauren Eisensalzen" [Sobre un cianato de potasio y hierro en particular y sobre una nueva serie de sales de hierro de ácido ciánico]. Journal für Chemie und Physik (en alemán). 34 : 325–346.
- ^ Ihde, AJ (1984). El desarrollo de la química moderna (2ª ed.). Nueva York: Publicaciones de Dover. pag. 153.
- ^ Figgis, BN; Gerloch, M .; Mason, R. "La cristalografía y la anisotropía paramagnética del ferricianuro de potasio" Actas de la Royal Society de Londres, Serie A: Ciencias Físicas y Matemáticas 1969, vol. 309, págs. 91-118. doi : 10.1098 / rspa.1969.0031
- ^ Stroebel, L .; Zakia, RD (1993). "Reductor del granjero" . La enciclopedia focal de la fotografía . Prensa Focal. pag. 297. ISBN 978-0-240-51417-8.
- ^ Prill, EA; McElvain, SM (1935). "1-Metil-2-Piridona". Síntesis orgánicas . 15 : 41. doi : 10.15227 / orgsyn.015.0041 .
- ^ Würfel, Hendryk; Jakobi, Dörthe (2018). "Síntesis de 2-ciano-benzotiazoles sustituidos" . Síntesis orgánicas . 95 : 177-191. doi : 10.15227 / orgsyn.095.0177 .
- ^ González, Javier; Aurigemma, Christine; Truesdale, Larry (2002). "Síntesis de (+) - (1S, 2R) - y (-) - (1R, 2S) - trans -2-fenilciclohexanol vía dihidroxilación asimétrica Sharpless (AD)". Síntesis orgánicas . 79 : 93. doi : 10.15227 / orgsyn.079.0093 .
- ^ Oi, Ryu; Sharpless, K. Barry (1996). "3 - [(1S) -1,2-Dihidroxietil] -1,5-Dihidro-3H-2,4-Benzodioxepina". Síntesis orgánicas . 73 : 1. doi : 10.15227 / orgsyn.073.0001 .
- ^ Nakajima, Y., Sato, Y. y Konishi, T. (2007). Pequeños ingredientes fenólicos antioxidantes en Inonotus obliquus (persoon) Pilat (Chaga). Boletín químico y farmacéutico, 55 (8), 1222–1276.
- ^ Dunbar, KR; Heintz, RA (1997). "Química de los compuestos de cianuro de metal de transición: perspectivas modernas". Progreso en Química Inorgánica . Progreso en Química Inorgánica. 45 . págs. 283–391. doi : 10.1002 / 9780470166468.ch4 . ISBN 9780470166468.
- ^ Carson, FL (1997). Histotecnología: un texto autodidacta (2ª ed.). Chicago: Sociedad Estadounidense de Patólogos Clínicos. págs. 209–211. ISBN 978-0-89189-411-7.
- ^ Tafesse, F. (2003). "Estudios comparativos sobre el azul de Prusia o diaquatetraamine-cobalt (III) promovieron la hidrólisis de 4-nitrofenilfosfato en microemulsiones" (PDF) . Revista Internacional de Ciencias Moleculares . 4 (6): 362–370. doi : 10.3390 / i4060362 .
- ↑ Verdaguer, M .; Gálvez, N .; Garde, R .; Desplanches, C. (2002). "Electrones en el trabajo en análogos del azul de Prusia" (PDF) . Interfaz Sociedad Electroquímica . 11 (3): 28–32. doi : 10.1002 / chin.200304218 .
- ^ "MSDS para ferricianuro de potasio" (PDF) .
enlaces externos
- Tarjeta internacional de seguridad química 1132
- Inventario Nacional de Contaminantes - Hoja de datos de compuestos de cianuro
- Compuestos de potasio
- Compuestos de hierro (III)
- Complejos de ciano
- Complejos de hierro
- Productos químicos fotográficos
- Agentes oxidantes