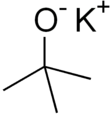El potasio tert -butóxido
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido El potasio tert -butóxido | |||
| Identificadores | |||
| |||
Modelo 3D ( JSmol ) | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.011.583 | ||
PubChem CID | |||
| UNII | |||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| C 4 H 9 KO | |||
| Masa molar | 112,21 g mol −1 | ||
| Apariencia | sólido | ||
| Punto de fusion | 256 ° C (493 ° F; 529 K) | ||
| Solubilidad en éter dietílico | 4,34 g / 100 g (25-26 ° C) [1] | ||
| Solubilidad en hexano | 0,27 g / 100 g (25-26 ° C) [1] | ||
| Solubilidad en tolueno | 2,27 g / 100 g (25-26 ° C) [1] | ||
| Solubilidad en THF | 25,00 g / 100 g (25-26 ° C) [1] | ||
| Riesgos | |||
| Ficha de datos de seguridad | Ficha de datos de seguridad (MSDS) de Oxford | ||
| Nocivo (Xn), Corrosivo (C) | |||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
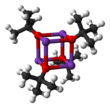
El terc- butóxido de potasio es el compuesto químico con la fórmula K + (CH 3 ) 3 CO - . Este sólido incoloro es una base fuerte (pKa del ácido conjugado alrededor de 17), que es útil en síntesis orgánica . Existe como un grupo tetramérico de tipo cubano . A menudo se lo ve escrito en la literatura química como t -butóxido de potasio . El compuesto a menudo se describe como una sal y, a menudo, se comporta como tal, pero no está ionizado en solución.
Preparación
El t -butóxido de potasio está disponible comercialmente como solución y como sólido, pero a menudo se genera in situ para uso en laboratorio porque las muestras son muy sensibles y las muestras más antiguas suelen ser de mala calidad. Se prepara mediante la reacción de alcohol terc- butílico seco con potasio metálico. [2] El sólido se obtiene evaporando estas soluciones y luego calentando el sólido. El sólido se puede purificar por sublimación a 220 ° C y 1 mmHg. La sublimación también puede tener lugar a 140 ° C y 0,01 hPa. Es aconsejable cubrir la materia prima con lana de vidrio, ya que el terc-butanolato de potasio tiende a "rebotar", por lo que las piezas pueden salir despedidas durante la sublimación. Es especialmente ventajosa la eliminación de sustancias anhidras mediante un aparato de sublimación inerte.
Estructura
El terc- butóxido de potasio cristaliza a partir de tetrahidrofurano / pentano a -20 ° C como [tBuOK · tBuOH] ∞ , que consta de infinitas cadenas unidimensionales unidas por enlaces de hidrógeno . La sublimación de [tBuOK · tBuOH] ∞ produce el tetrámero [tBuOK] 4 , que adopta una estructura similar a una cubana. Los disolventes básicos de Lewis suaves como el THF y el éter dietílico no rompen la estructura tetramérica, que persiste en el sólido, en solución e incluso en la fase gaseosa. [3]
Aplicaciones
La especie de terc- butóxido es útil en sí misma como una base fuerte no nucleófila en química orgánica. [4] No es tan fuerte como las bases amídicas, por ejemplo , diisopropilamida de litio , pero más fuerte que el hidróxido de potasio. Su volumen estérico inhibe que el grupo participe en la adición nucleofílica, como en una síntesis de éter de Williamson o una reacción S N 2 . Los sustratos que son desprotonados por t -butóxido de potasio incluyen acetilenos terminales y compuestos de metileno activos . Es útil en reacciones de deshidrohalogenación .
El potasio tert -butóxido cataliza la reacción de hidrosilanos y compuestos heterocíclicos para dar los derivados de sililo, con la liberación de H 2 . [5]
Modificaciones
Se han informado muchas modificaciones que influyen en la reactividad de este reactivo. El compuesto adopta una estructura de grupo compleja (la imagen adyacente es una caricatura simplificada) y los aditivos que modifican el grupo afectan la reactividad del reactivo. Por ejemplo, DMF , DMSO , hexametilfosforamida (HMPA) y 18-corona-6 interactúan con el centro de potasio, mejorando la basicidad del butóxido. La base de Schlosser , una mezcla del alcóxido y un compuesto de alquil litio, es una base relacionada pero más fuerte. [4]
Reacciones
El terc- butóxido de potasio reacciona con el cloroformo produciendo diclorocarbeno , [6] la reacción puede provocar la ignición. [7] Nunca se debe agregar terc- butóxido de potasio al diclorometano. [8]
Como base, el terc-butóxido de potasio puede extraer un protón beta y formar el producto de Hofmann mediante una reacción de eliminación . Esta reacción tiene un alto valor sintético ya que puede provocar más reacciones del alqueno resultante , especialmente reacciones regioquímicas.
Compuestos relacionados
- Terc-butóxido de sodio
- Terc-butóxido de litio
Referencias
- ↑ a b c d Caine D. (2006). "Terc-butóxido de potasio". Terc-butóxido de potasio . Enciclopedia e-EROS de reactivos para síntesis orgánica . doi : 10.1002 / 047084289X.rp198.pub2 . ISBN 0471936235.
- ^ William S. Johnson y William P. Schneider (1963). "Ácido β-carbetoxi-γ, γ-difenilvinilacético" . Síntesis orgánicas .; Volumen colectivo , 4 , p. 132
- ^ Chisholm, Malcolm H .; Drake, Simon R .; Naiini, Ahmad A .; Streib, William E. (1991). "Estructuras cristalinas de síntesis y rayos X de las cadenas de cintas unidimensionales [MOBu t · Bu t OH] ∞ y las especies de cubane [MOBu t ] 4 (M = K y Rb)". Poliedro . 10 (3): 337–345. doi : 10.1016 / S0277-5387 (00) 80154-0 .
- ^ a b Drury Caine "t-butóxido de potasio" en Enciclopedia de reactivos para síntesis orgánica John Wiley & Sons, Nueva York, 2006. doi : 10.1002 / 047084289X.rp198.pub2 . Fecha de publicación en línea del artículo: 15 de septiembre de 2006
- ^ Anton A. Toutov, Wen-Bo Liu, Kerry N. Betz, Alexey Fedorov, Brian Stoltz , Robert H. Grubbs (2015). "Sililación de enlaces C – H en heterociclos aromáticos por un catalizador de metal abundante en la Tierra" (PDF) . Naturaleza . 518 (7537): 80–84. doi : 10.1038 / nature14126 . PMID 25652999 . S2CID 3117834 . CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Brown, William; Foote, Christopher; Iverson, Brent; Anslyn, Eric (10 de enero de 2008). Química Orgánica . Aprendizaje Cengage. ISBN 978-0495388579.
- ↑ Margaret-Ann Armor (19 de abril de 2016). Guía de eliminación de sustancias químicas de laboratorio peligrosas, tercera edición . Prensa CRC. ISBN 9781420032383.
- ↑ Foden, Charles R .; Weddell, Jack L. (29 de diciembre de 1991). Materiales peligrosos: datos de acción de emergencia . Prensa CRC. ISBN 9780873715980.
- Alcóxidos
- Reactivos para química orgánica
- Bases no nucleofílicas
- Compuestos de terc-butilo
- Compuestos de potasio