Gradiente electroquímico
Un gradiente electroquímico es un gradiente de potencial electroquímico , generalmente para un ión que puede moverse a través de una membrana . El gradiente consta de dos partes, el gradiente químico o diferencia en la concentración de soluto a través de una membrana y el gradiente eléctrico o diferencia de carga a través de una membrana. Cuando hay concentraciones desiguales de un ión a través de una membrana permeable, el ión se moverá a través de la membrana desde el área de mayor concentración al área de menor concentración mediante difusión simple . Los iones también llevan una carga eléctrica que forma un potencial eléctrico.a través de una membrana. Si hay una distribución desigual de cargas a través de la membrana, entonces la diferencia en el potencial eléctrico genera una fuerza que impulsa la difusión de iones hasta que las cargas se equilibran en ambos lados de la membrana. [1]
El potencial electroquímico es importante en la química electroanalítica y en aplicaciones industriales como baterías y pilas de combustible. Representa una de las muchas formas intercambiables de energía potencial a través de las cuales se puede conservar la energía .
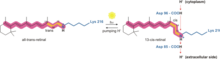
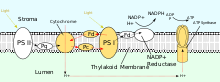
En los procesos biológicos, la dirección en que se mueve un ion por difusión o transporte activo a través de una membrana está determinada por el gradiente electroquímico. En las mitocondrias y los cloroplastos , los gradientes de protones se utilizan para generar un potencial quimiosmótico que también se conoce como fuerza motriz de protones . Esta energía potencial se utiliza para la síntesis de ATP mediante fosforilación oxidativa o fotofosforilación , respectivamente. [2]
Un gradiente electroquímico tiene dos componentes. Primero, el componente eléctrico es causado por una diferencia de carga a través de la membrana lipídica. En segundo lugar, un componente químico es causado por una concentración diferencial de iones a través de la membrana. La combinación de estos dos factores determina la dirección termodinámicamente favorable para el movimiento de un ión a través de una membrana. [1] [3]
Un gradiente electroquímico es análogo a la presión del agua a través de una presa hidroeléctrica . Las proteínas de transporte de membrana , como la bomba de sodio-potasio dentro de la membrana, son equivalentes a turbinas que convierten la energía potencial del agua en otras formas de energía física o química, y los iones que atraviesan la membrana son equivalentes al agua que termina en el fondo. de la presa. Además, la energía se puede utilizar para bombear agua hacia el lago por encima de la presa. De manera similar, la energía química en las células se puede usar para crear gradientes electroquímicos. [4] [5]
El término se aplica típicamente en contextos en los que tiene lugar una reacción química , como una que implica la transferencia de un electrón a un electrodo de batería . En una batería, un potencial electroquímico que surge del movimiento de iones equilibra la energía de reacción de los electrodos. El voltaje máximo que puede producir una reacción de batería a veces se denomina potencial electroquímico estándar de esa reacción (consulte también Potencial de electrodo y Tabla de potenciales de electrodo estándar ). En casos relacionados específicamente con el movimiento de solutos cargados eléctricamente, el potencial se expresa a menudo en unidades de voltios . Ver: celda de concentración .