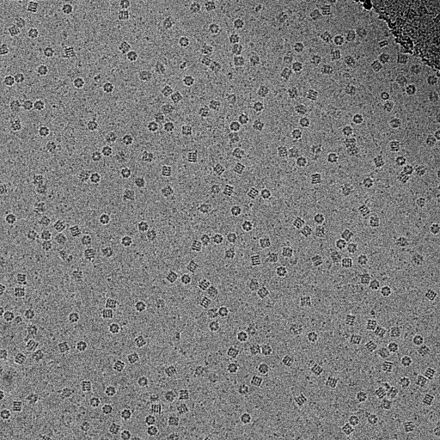
La criomicroscopía electrónica de transmisión ( CryoTEM ), comúnmente conocida como crio-EM , es una forma de microscopía electrónica criogénica , más específicamente un tipo de microscopía electrónica de transmisión (TEM) donde la muestra se estudia a temperaturas criogénicas (generalmente temperaturas de nitrógeno líquido ). [1] Cryo-EM está ganando popularidad en biología estructural . [2]
La utilidad de la criomicroscopía electrónica de transmisión radica en el hecho de que permite la observación de muestras que no han sido teñidas ni fijadas de ninguna forma, mostrándolas en su entorno nativo. Esto contrasta con la cristalografía de rayos X , que requiere cristalizar la muestra, que puede ser difícil, y colocarla en ambientes no fisiológicos, que ocasionalmente pueden conducir a cambios conformacionales funcionalmente irrelevantes.
Los avances en la tecnología de detectores de electrones , en particular los DDE (Detectores directos de electrones), así como los algoritmos de software de imágenes más potentes, han permitido la determinación de estructuras macromoleculares con una resolución casi atómica. [3] Las macromoléculas fotografiadas incluyen virus , ribosomas , mitocondrias , canales iónicos y complejos enzimáticos . A partir de 2018, cryo-EM podría aplicarse a estructuras tan pequeñas como la hemoglobina (64 kDa ) [4] y con resoluciones de hasta 1.8 Å . [5]En 2019, las estructuras crio-EM representaron el 2,5% de las estructuras depositadas en el banco de datos de proteínas , [6] y este número sigue creciendo. [7] Una aplicación de cryo-EM es la tomografía crioelectrónica (cryo-ET), donde se crea una reconstrucción 3D de la muestra a partir de imágenes 2D inclinadas.
Desarrollo [ editar ]
El fundamento original de CryoTEM fue como un medio para combatir el daño por radiación de las muestras biológicas. La cantidad de radiación requerida para recolectar una imagen de una muestra en el microscopio electrónico es lo suficientemente alta como para ser una fuente potencial de daño de la muestra para estructuras delicadas. Además, el alto vacío requerido en la columna de un microscopio electrónico hace que el entorno de la muestra sea bastante hostil.
El problema del vacío se resolvió parcialmente mediante la introducción de tinciones negativas, pero incluso con tinciones negativas, las muestras biológicas son propensas al colapso estructural tras la deshidratación de la muestra. Incrustar las muestras en hielo por debajo de la temperatura de sublimación era una posibilidad que se contempló desde el principio, pero el agua tiende a organizarse en una red cristalina de menor densidad al congelarse y esto puede destruir la estructura de cualquier cosa que esté incrustada en ella.
A principios de la década de 1980, varios grupos que estudiaban la física del estado sólido intentaban producir hielo vítreo por diferentes medios, como la congelación a alta presión o la congelación instantánea. En un artículo fundamental en 1984, el grupo dirigido por Jacques Dubochet en el Laboratorio Europeo de Biología Molecular mostró imágenes de adenovirus incrustados en una capa vitrificada de agua. [8] En general, se considera que este artículo marca el origen de Cryo-EM, y la técnica se ha desarrollado hasta el punto de convertirse en una rutina en numerosos laboratorios de todo el mundo.
La energía de los electrones utilizados para la formación de imágenes (80-300 kV) es lo suficientemente alta como para romper los enlaces covalentes . Cuando las muestras de imágenes son vulnerables al daño por radiación, es necesario limitar la exposición a los electrones utilizados para adquirir la imagen. Estas bajas exposiciones requieren que las imágenes de miles o incluso millones de moléculas congeladas idénticas se seleccionen, alineen y promedien para obtener mapas de alta resolución, utilizando software especializado. En 2012 se logró una mejora significativa en las características estructurales mediante la introducción de detectores de electrones directos y mejores algoritmos computacionales. [1] [2]
En 2015, Bridget Carragher y sus colegas del Scripps National Resource for Automated Molecular Microscopy utilizaron técnicas que ella y Clint Potter desarrollaron para determinar la primera estructura crio-EM con una resolución más fina que 3 Å, elevando así a CryoTEM como una herramienta comparable y potencialmente superior. a las técnicas tradicionales de cristalografía de rayos X. [9] [10] Desde entonces, se han logrado resoluciones más altas, incluida una estructura de 2,2 Å de la enzima bacteriana β-galactosidasa en 2015 [11] y una estructura de 1,8 Å de glutamato deshidrogenasa en 2016. [12] Cryo-EM también ha Se ha utilizado para determinar la estructura de varios virus, incluido elEl virus del Zika , [13] y se ha aplicado a complejos grandes como el espliceosoma . [14] En 2017, el Premio Nobel de Química fue otorgado conjuntamente a Jacques Dubochet , Joachim Frank y Richard Henderson , "por desarrollar microscopía crioelectrónica para la determinación de estructuras de alta resolución de biomoléculas en solución". [15]
Especímenes biológicos [ editar ]
Película fina [ editar ]
El material biológico se esparce en una rejilla de microscopía electrónica y se conserva en un estado hidratado congelado por congelación rápida, generalmente en etano líquido cerca de la temperatura del nitrógeno líquido . Manteniendo las muestras a la temperatura del nitrógeno líquido o más frías, se pueden introducir en el alto vacío de la columna del microscopio electrónico . La mayoría de las muestras biológicas son extremadamente radiosensibles , por lo que deben obtenerse imágenes con técnicas de dosis baja (de manera útil, la criomicroscopía electrónica de transmisión a baja temperatura proporciona un factor de protección adicional contra el daño por radiación).
En consecuencia, las imágenes son extremadamente ruidosas . Para algunos sistemas biológicos, es posible promediar imágenes para aumentar la relación señal-ruido y recuperar información de alta resolución sobre la muestra utilizando la técnica conocida como análisis de partículas individuales . Este enfoque en general requiere que las cosas que se promedien sean idénticas, aunque ahora se puede estudiar alguna heterogeneidad conformacional limitada (por ejemplo, ribosoma ). Las reconstrucciones tridimensionales a partir de imágenes CryoTEM de complejos de proteínas y virus se han resuelto a una resolución subnanométrica o casi atómica, lo que permite nuevos conocimientos sobre la estructura y la biología de estos grandes conjuntos.
El análisis de matrices ordenadas de proteínas, como cristales 2-D de proteínas transmembrana o matrices helicoidales de proteínas, también permite una especie de promediado que puede proporcionar información de alta resolución sobre la muestra. Esta técnica se llama cristalografía electrónica .
Secciones vítreas [ editar ]
El método de película fina se limita a muestras delgadas (normalmente <500 nm) porque los electrones no pueden atravesar muestras más gruesas sin múltiples eventos de dispersión. Las muestras más gruesas se pueden vitrificar mediante congelación por inmersión ( criofijación ) en etano (hasta decenas de μm de espesor) o, más comúnmente, mediante congelación a alta presión (hasta cientos de μm). Luego se pueden cortar en secciones delgadas (de 40 a 200 nm de grosor) con un cuchillo de diamante en un crioultramicrotomo.a temperaturas inferiores a −135 ° C (temperatura de desvitrificación). Las secciones se recogen en una rejilla de microscopio electrónico y se obtienen imágenes de la misma manera que la muestra vitrificada en película delgada. Esta técnica se denomina criomicroscopía electrónica de transmisión de secciones vítreas (CEMOVIS) o criomicroscopía electrónica de transmisión de secciones hidratadas congeladas.
Muestras de material [ editar ]
Además de permitir la obtención de imágenes de muestras biológicas vitrificadas, CryoTEM también se puede utilizar para obtener imágenes de muestras de material que son demasiado volátiles en el vacío para obtener imágenes mediante microscopía electrónica estándar a temperatura ambiente. Por ejemplo, las secciones vitrificadas de interfaces líquido-sólido pueden extraerse para su análisis mediante CryoTEM, [16] y el azufre, que es propenso a la sublimación en el vacío de los microscopios electrónicos, se puede estabilizar y obtener imágenes en CryoTEM. [17]
Técnicas [ editar ]
Se pueden utilizar una variedad de técnicas en CryoTEM. [18] Las técnicas populares incluyen:
- Cristalografía electrónica
- Análisis de cristales bidimensionales
- Análisis de tubos o filamentos helicoidales
- Difracción de electrones de microcristales (MicroED) [19] [20] [21] [22]
- Análisis de partículas individuales (SPA)
- CryoTEM de resolución temporal [23] [24] [25]
- Criotomografía electrónica (cryoET)
Ver también [ editar ]
| Wikilibros tiene un libro sobre el tema: Herramientas de software para microscopía molecular |
- Microscopía electrónica de barrido criogénico
- Banco de datos de EM
- Resolución (densidad de electrones)
- Análisis de partículas individuales
Referencias [ editar ]
- ↑ a b Kühlbrandt W (agosto de 2014). "Cryo-EM entra en una nueva era" . eLife . 3 : e03678. doi : 10.7554 / elife.03678 . PMC 4131193 . PMID 25122623 .
- ^ a b Callaway E (septiembre de 2015). "La revolución no se cristalizará: un nuevo método atraviesa la biología estructural" . Naturaleza . 525 (7568): 172–4. Código Bibliográfico : 2015Natur.525..172C . doi : 10.1038 / 525172a . PMID 26354465 .
- ^ Murata K, Wolf M (febrero de 2018). "Microscopía crioelectrónica para análisis estructural de macromoléculas biológicas dinámicas" . Biochimica et Biophysica Acta (BBA) - Temas generales . 1862 (2): 324–334. doi : 10.1016 / j.bbagen.2017.07.020 . PMID 28756276 .
- ^ Khoshouei M, Radjainia M, Baumeister W, Danev R (junio de 2017). "Estructura crio-EM de la hemoglobina a 3,2 Å determinada con la placa de fase Volta" . Comunicaciones de la naturaleza . 8 : 16099. Código Bibliográfico : 2017NatCo ... 816099K . doi : 10.1038 / ncomms16099 . PMC 5497076 . PMID 28665412 .
- ^ Merk A, Bartesaghi A, Banerjee S, Falconieri V, Rao P, Davis MI, Pragani R, Boxer MB, Earl LA, Milne JL, Subramaniam S (junio de 2016). "Rompiendo barreras de resolución Cryo-EM para facilitar el descubrimiento de fármacos" . Celular . 165 (7): 1698-1707. doi : 10.1016 / j.cell.2016.05.040 . PMC 4931924 . PMID 27238019 .
- ^ "Distribución de datos de PDB por método experimental y tipo molecular" . www.rcsb.org . Consultado el 3 de diciembre de 2019 .
- ^ "Estadísticas de PDB: crecimiento de estructuras de experimentos 3DEM lanzados por año" . www.rcsb.org . Consultado el 22 de diciembre de 2018 .
- ^ Adrian M, Dubochet J, Lepault J, McDowall AW (1984). "Microscopía crioelectrónica de virus" . Naturaleza . 308 (5954): 32–6. Código bibliográfico : 1984Natur.308 ... 32A . doi : 10.1038 / 308032a0 . PMID 6322001 . S2CID 4319199 .
- ^ Dellisanti, Cosma (2015). "Una resolución que rompe barreras". Naturaleza Biología Molecular y Estructural . 22 (5): 361. doi : 10.1038 / nsmb.3025 . S2CID 12198387 .
- ^ Campbell MG, Veesler D, Cheng A, Potter CS, Carragher B (marzo de 2015). "Reconstrucción de resolución 2.8 Å del proteasoma Thermoplasma acidophilum 20S usando microscopía crioelectrónica" . eLife . 4 . doi : 10.7554 / eLife.06380 . PMC 4391500 . PMID 25760083 .
- ^ Bartesaghi A, Merk A, Banerjee S, Matthies D, Wu X, Milne JL, Subramaniam S (junio de 2015). "Estructura crio-EM de resolución 2,2 Å de β-galactosidasa en complejo con un inhibidor de penetración celular" . Ciencia . 348 (6239): 1147–51. Código Bibliográfico : 2015Sci ... 348.1147B . doi : 10.1126 / science.aab1576 . PMC 6512338 . PMID 25953817 .
- ^ Vonck J, Mills DJ (octubre de 2017). "Avances en crio-EM de alta resolución de enzimas oligoméricas" . Opinión actual en biología estructural . 46 : 48–54. doi : 10.1016 / j.sbi.2017.05.016 . PMID 28624735 .
- ^ Sirohi D, Chen Z, Sun L, Klose T, Pierson TC, Rossmann MG, Kuhn RJ (abril de 2016). "La estructura crio-EM de 3,8 Å de resolución del virus Zika" . Ciencia . 352 (6284): 467–70. Código bibliográfico : 2016Sci ... 352..467S . doi : 10.1126 / science.aaf5316 . PMC 4845755 . PMID 27033547 .
- ^ Cheng Y (agosto de 2018). "Cryo-EM de una sola partícula-¿Cómo llegó aquí y adónde irá?" . Ciencia . 361 (6405): 876–880. Código bibliográfico : 2018Sci ... 361..876C . doi : 10.1126 / science.aat4346 . PMC 6460916 . PMID 30166484 .
- ^ "El Premio Nobel de Química 2017 - Comunicado de prensa" . www.nobelprize.org . 4 de octubre de 2017 . Consultado el 4 de octubre de 2017 .
- ^ Zachman MJ, Asenath-Smith E, Estroff LA, Kourkoutis LF (diciembre de 2016). "Preparación específica del sitio de interfaces sólido-líquido intactas mediante localización in situ sin etiquetas y elevación del haz de iones centrado en crio" . Microscopía y Microanálisis . 22 (6): 1338-1349. Código bibliográfico : 2016MiMic..22.1338Z . doi : 10.1017 / S1431927616011892 . PMID 27869059 .
- ^ Levin BD, Zachman MJ, Werner JG, Sahore R, Nguyen KX, Han Y, Xie B, Ma L, Archer LA, Giannelis EP, Wiesner U, Kourkoutis LF, Muller DA (febrero de 2017). "Caracterización de cátodos de baterías de azufre y azufre nanoestructurado en microscopía electrónica sin artefactos de sublimación" . Microscopía y Microanálisis . 23 (1): 155-162. Código Bib : 2017MiMic..23..155L . doi : 10.1017 / S1431927617000058 . PMID 28228169 .
- ^ Presentación sobre microscopía crioelectrónica | PharmaXChange.info
- ^ Shi D, Nannenga BL, Iadanza MG, Gonen T (noviembre de 2013). "Cristalografía electrónica tridimensional de microcristales de proteínas" . eLife . 2 : e01345. doi : 10.7554 / eLife.01345 . PMC 3831942 . PMID 24252878 .
- ^ Nannenga BL, Shi D, Leslie AG, Gonen T (septiembre de 2014). "Determinación de estructuras de alta resolución mediante recogida de datos de rotación continua en MicroED" . Métodos de la naturaleza . 11 (9): 927–930. doi : 10.1038 / nmeth.3043 . PMC 4149488 . PMID 25086503 .
- ^ Shi D, Nannenga BL, de la Cruz MJ, Liu J, Sawtelle S, Calero G, Reyes FE, Hattne J, Gonen T (mayo de 2016). "La recopilación de datos MicroED para cristalografía macromolecular" . Protocolos de la naturaleza . 11 (5): 895–904. doi : 10.1038 / nprot.2016.046 . PMC 5357465 . PMID 27077331 .
- ^ de la Cruz MJ, Hattne J, Shi D, Seidler P, Rodriguez J, Reyes FE, Sawaya MR, Cascio D, Weiss SC, Kim SK, Hinck CS, Hinck AP, Calero G, Eisenberg D, Gonen T (febrero de 2017 ). "Estructuras de resolución atómica a partir de cristales de proteína fragmentados con el método cryoEM MicroED" . Métodos de la naturaleza . 14 (4): 399–402. doi : 10.1038 / nmeth.4178 . PMC 5376236 . PMID 28192420 .
- ^ Fu Z, Kaledhonkar S, Borg A, Sun M, Chen B, Grassucci RA, Ehrenberg M, Frank J (diciembre de 2016). "Intermedios clave en el reciclaje de ribosomas visualizados por microscopía crioelectrónica de resolución temporal" . Estructura . 24 (12): 2092–2101. doi : 10.1016 / j.str.2016.09.014 . PMC 5143168 . PMID 27818103 .
- ^ Feng X, Fu Z, Kaledhonkar S, Jia Y, Shah B, Jin A, Liu Z, Sun M, Chen B, Grassucci RA, Ren Y, Jiang H, Frank J, Lin Q (abril de 2017). "Un método de pulverización-inmersión de microfluidos rápido y eficaz para Cryo-EM de una sola partícula de alta resolución" . Estructura . 25 (4): 663–670.e3. doi : 10.1016 / j.str.2017.02.005 . PMC 5382802 . PMID 28286002 .
- ^ Chen B, Kaledhonkar S, Sun M, Shen B, Lu Z, Barnard D, Lu TM, Gonzalez RL, Frank J (junio de 2015). "Dinámica estructural de la asociación de subunidades de ribosoma estudiada mediante microscopía electrónica criogénica de resolución en tiempo de mezcla-pulverización" . Estructura . 23 (6): 1097-105. doi : 10.1016 / j.str.2015.04.007 . PMC 4456197 . PMID 26004440 .
Lectura adicional [ editar ]
- Frank J (2006). Microscopía electrónica tridimensional de conjuntos macromoleculares . Nueva York: Oxford University Press . ISBN 0-19-518218-9.
- van Heel M, Gowen B, Matadeen R, Orlova EV, Finn R, Pape T, Cohen D, Stark H, Schmidt R, Schatz M, Patwardhan A (noviembre de 2000). "Crio-microscopía electrónica de partícula única: hacia la resolución atómica" . Reseñas trimestrales de biofísica . 33 (4): 307–69. doi : 10.1017 / s0033583500003644 . PMID 11233408 .
Enlaces externos [ editar ]
| Recursos de la biblioteca sobre criomicroscopía |
|
- "EM para tontos" . Consultado el 9 de junio de 2006 .
- La estructura fina de un virus congelado : la criomicroscopía electrónica de una sola partícula sofisticada revela detalles sin precedentes en la capa de proteína de un virus, Technology Review , 19 de marzo de 2008
- Introducción a Cryo-EM : curso en línea de Caltech, profesor Grant Jensen
- Banco de datos de EM
- EMstats Tendencias y distribuciones de mapas en EMDB, por ejemplo, tendencias de resolución