Zingibain
La zingibaína , zingipaína o jengibre proteasa ( EC 3.4.22.67 ) es una enzima cisteína proteasa que se encuentra en los rizomas de jengibre ( Zingiber officinale ) . [1] [2] [3] Se cataliza la preferencial de escisión de péptidos con una prolina residuo en la posición P2. Tiene dos formas distintas , jengibre proteasa I (GP-I) y jengibre proteasa II (GP-II). [4]
Como miembro de la familia de las cisteína proteasas de la papaína, la zingibaína comparte varias similitudes estructurales y funcionales con enzimas más estudiadas como la papaína , la bromelina y la actinidina . Estas peptidasas contienen un residuo de cisteína activo en sus centros que cataliza la escisión hidrolítica de los enlaces peptídicos. La zingibaína se destaca por su actividad como proteinasa y colagenasa . [1]
Fue aislado, purificado e informado por primera vez en 1973 por Ichikawa et al. en la Universidad de Mujeres de Japón . [5] Recientemente, se descubrió que la zingibaína existe como dos isoenzimas , GP-I y GP-II, que fueron aisladas por cromatografía, con pesos moleculares de aproximadamente 22.500 Da. [5]
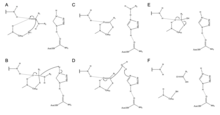
Zingibain utiliza una tríada catalítica de residuos Cys, His y Asn en su sitio activo para escindir los enlaces peptídicos hidrolíticamente. La presencia de Asn175 estabiliza el anillo de imidazol de His, asegurando que esté posicionado de manera óptima para catalizar la hidrólisis.
El mecanismo comienza con una transferencia de protones de Cys25 a His159. [6] El anión sulfuro luego ataca el carbono alfa del aminoácido , desplazando el grupo amina , que se une a His159. [6] El carbono alfa del aminoácido estabilizado es luego atacado por una molécula de agua, que desplaza el sulfuro de Cys25 para convertir el aminoácido en un ácido carboxílico , que se libera del sitio activo de la enzima. [6]
La introducción experimental de ditiotreitol , un protector conocido del grupo tiol , mejora la actividad proteolítica, proporcionando una verificación adicional de la importancia del residuo de cisteína central para la actividad enzimática. [7]