Metionina sintasa
La metionina sintasa también conocida como MS , MeSe , MTR es responsable de la regeneración de metionina a partir de homocisteína . En los seres humanos, está codificado por el gen MTR (5-metiltetrahidrofolato-homocisteína metiltransferasa). [5] [6] La metionina sintasa forma parte del ciclo de biosíntesis y regeneración de S-adenosilmetionina (SAMe) . [7] En los animales, esta enzima requiere vitamina B12 (cobalamina) como cofactor , mientras que la forma que se encuentra en las plantas es independiente de la cobalamina.[8] Los microorganismos expresan formas tanto dependientes de cobalamina como independientes de cobalamina. [8]
La metionina sintasa cataliza el paso final en la regeneración de metionina (Met) a partir de homocisteína (Hcy). La reacción general transforma el 5-metiltetrahidrofolato (N 5 -MeTHF) en tetrahidrofolato (THF) mientras se transfiere un grupo metilo a la homocisteína para formar metionina. La metionina sintasa es la única enzima de mamífero que metaboliza el N 5 -MeTHF para regenerar el cofactor activo THF. En las formas de la enzima que dependen de la cobalamina, la reacción se desarrolla mediante dos pasos en una reacción de ping-pong. La enzima se ceba inicialmente a un estado reactivo mediante la transferencia de un grupo metilo de N 5 -MeTHF a Co (I) en cobalamina unida a enzima.(Cob), formando metil-cobalamina (Me-Cob) que ahora contiene Me-Co (III) y activando la enzima. Luego, un Hcy que se ha coordinado con un zinc unido a una enzima para formar un tiolato reactivo reacciona con el Me-Cob. El grupo metilo activado se transfiere de Me-Cob al tiolato de Hcy, que regenera Co (I) en la mazorca, y la enzima libera Met. El mecanismo independiente de la mazorca sigue la misma ruta general pero con una reacción directa entre el tiolato de zinc y N 5 -MeTHF. [9] [10]
El mecanismo de la enzima depende de la constante regeneración de Co (I) en la mazorca, pero esto no siempre está garantizado. En cambio, cada 1–2000 renovaciones catalíticas, el Co (I) puede oxidarse en Co (II), lo que detendría permanentemente la actividad catalítica. Una proteína separada, la metionina sintasa reductasa , cataliza la regeneración de Co (I) y la restauración de la actividad enzimática. Debido a que la oxidación de cob-Co (I) inevitablemente cierra la actividad de la metionina sintasa dependiente de la mazorca, los defectos o deficiencias en la metionina sintasa reductasa han sido implicados en algunas de las asociaciones de enfermedades para la deficiencia de metionina sintasa que se describen a continuación. Las dos enzimas forman una red depuradora que se ve en la parte inferior izquierda. [11]
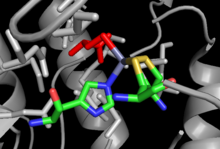
Se han resuelto las estructuras cristalinas para MetH tanto independiente de la mazorca como para la dependiente de la mazorca, con poca similitud en la estructura general a pesar de que cada una de ellas realiza una reacción neta idéntica y similitudes dentro de los sitios de unión, como el sitio de unión de Hcy. [12] La MetH dependiente de Cob se divide en 4 dominios separados: activación, unión a cobalamina (dominio Cob) , unión a homocisteína (dominio Hcy) y unión a N5 - metilTHF (dominio MeTHF). El dominio de activación es el sitio de interacción con la metionina sintasa reductasa y se une a SAMque se utiliza como parte del ciclo de reactivación de la enzima. El dominio Cob contiene Cob intercalado entre varias hélices alfa grandes y unido a la enzima para que el átomo de cobalto del grupo quede expuesto al contacto con otros dominios. El dominio Hcy contiene el sitio crítico de unión al zinc, formado por residuos de cisteína o histidina coordinados con un ion zinc que puede unirse a Hcy, con un ejemplo de MetH no dependiente de Cob que se muestra a la derecha. El dominio de unión de N 5 -MeTHF contiene un barril conservado en el que el N 5 -MeTHF puede formar puentes de hidrógeno con asparagina , arginina y ácido aspártico.residuos. Toda la estructura sufre un movimiento oscilante dramático durante la catálisis a medida que el dominio Cob se mueve hacia adelante y hacia atrás desde el dominio Hcy al dominio Fol, transfiriendo el grupo metilo activo del dominio Fol al dominio Hcy. [13]