| |||
| Nombres | |||
|---|---|---|---|
| Nombres IUPAC Pentacloruro de antimonio Cloruro de antimonio (V) | |||
| Otros nombres Cloruro antimónico Percloruro de antimonio | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.028.729 | ||
| Número CE |
| ||
PubChem CID | |||
| Número RTECS |
| ||
| UNII | |||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| Cl 5 Sb | |||
| Masa molar | 299,01 g · mol −1 | ||
| Apariencia | líquido incoloro o amarillo rojizo (humeante), aceitoso | ||
| Olor | picante, ofensivo | ||
| Densidad | 2,336 g / cm 3 (20 ° C) [1] 2,36 g / cm 3 (25 ° C) [2] | ||
| Punto de fusion | 2,8 ° C (37,0 ° F; 275,9 K) | ||
| Punto de ebullición | 140 ° C (284 ° F; 413 K) se descompone de 106 ° C [3] 79 ° C (174 ° F; 352 K) a 22 mmHg [1] 92 ° C (198 ° F; 365 K) a 30 mmHg [2] | ||
| reacciona | |||
| Solubilidad | soluble en alcohol , HCl , ácido tartárico , CHCl 3 , CS 2 , CCl 4 | ||
| Solubilidad en oxicloruro de selenio (IV) | 62,97 g / 100 g (25 ° C) | ||
| Presión de vapor | 0,16 kPa (25 ° C) 4 kPa (40 ° C) 7,7 kPa (100 ° C) [4] | ||
Susceptibilidad magnética (χ) | -120,0 · 10 −6 cm 3 / mol | ||
Índice de refracción ( n D ) | 1.59255 | ||
| Viscosidad | 2,034 cP (29,4 ° C) [1] 1,91 cP (35 ° C) | ||
| Estructura | |||
Forma molecular | Triangular bipiramidal | ||
Momento bipolar | 0 D | ||
| Termoquímica | |||
Capacidad calorífica ( C ) | 120,9 J / mol · K (gas) [3] | ||
Entropía molar estándar ( S | 295 J / mol · K [3] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | -437,2 kJ / mol [3] | ||
Energía libre de Gibbs (Δ f G ˚) | -345,35 kJ / mol [3] | ||
| Peligros | |||
| Pictogramas GHS | [2] | ||
| Palabra de señal GHS | Peligro | ||
Declaraciones de peligro GHS | H314 , H411 [2] | ||
Consejos de prudencia del SGA | P273 , P280 , P305 + 351 + 338 , P310 [2] | ||
| Peligro de inhalación | Tóxico | ||
| NFPA 704 (diamante de fuego) |  3 0 1 W | ||
| punto de inflamabilidad | 77 ° C (171 ° F; 350 K) | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis mediana ) | 1115 mg / kg, (rata, oral) [3] | ||
| NIOSH (límites de exposición a la salud de EE. UU.): | |||
PEL (permitido) | TWA 0,5 mg / m 3 (como Sb) [5] | ||
REL (recomendado) | TWA 0,5 mg / m 3 (como Sb) [5] | ||
| Compuestos relacionados | |||
Otros aniones | Pentafluoruro de antimonio | ||
Otros cationes | Pentacloruro de fósforo | ||
Compuestos relacionados | Tricloruro de antimonio | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
El pentacloruro de antimonio es un compuesto químico con la fórmula SbCl 5 . Es un aceite incoloro, pero las muestras típicas son amarillentas debido a las impurezas. Debido a su tendencia a hidrolizarse a ácido clorhídrico , el SbCl 5 es una sustancia altamente corrosiva y debe almacenarse en recipientes de vidrio o PTFE .
Preparación y estructura [ editar ]
El pentacloruro de antimonio se prepara pasando cloro gaseoso en tricloruro de antimonio fundido :
- SbCl 3 + Cl 2 → SbCl 5
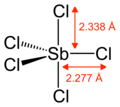
El SbCl 5 gaseoso tiene una estructura bipiramidal trigonal. [6]
Reacciones [ editar ]
El pentacloruro de antimonio se hidroliza para dar ácido clorhídrico y oxicloruros de antimonio . Esta reacción se suprime en presencia de un gran exceso de cloruro, debido a la formación del ion complejo hexacloroantimoniato :
- SbCl 5 + Cl - → [SbCl 6 ] -
Se conocen los mono y tetrahidratos, SbCl 5 · H 2 O y SbCl 5 · 4H 2 O.
Este compuesto forma aductos con muchas bases de Lewis. El SbCl 5 es un ácido de Lewis blando y sus parámetros del modelo ECW son E A = 3.64 y C A = 10.42. Se utiliza como ácido de Lewis estándar en la escala Gutmann de basicidad de Lewis . [7] Sin embargo, los gráficos de Cramer-Bopp muestran que una escala de basicidad de un parámetro está incompleta y que no existe un orden de rango único de fuerza base. Estos gráficos muestran que para definir el orden de fuerza de la base de Lewis (o fuerza del ácido de Lewis) se deben considerar al menos dos propiedades. [8] [9]
También es un agente oxidante fuerte . [10]
Aplicaciones [ editar ]
El pentacloruro de antimonio se utiliza como catalizador de polimerización y para la cloración de compuestos orgánicos.
Precauciones [ editar ]
El pentacloruro de antimonio es una sustancia altamente corrosiva que debe almacenarse lejos del calor y la humedad. Es un agente clorante y, en presencia de humedad, libera gas cloruro de hidrógeno. Debido a esto, puede grabar incluso herramientas de acero inoxidable (como agujas), si se manipula en una atmósfera húmeda. No debe manipularse con plásticos no fluorados (como jeringas de plástico, tabiques de plástico o agujas con accesorios de plástico), ya que derrite y carboniza los materiales plásticos. [11]
Referencias [ editar ]
- ^ a b c "Pentacloruro de antimonio (PID del Reino Unido)" .
- ^ a b c d e Sigma-Aldrich Co. , Cloruro de antimonio (V) . Consultado el 29 de mayo de 2014.
- ^ a b c d e f "Cloruro de antimonio (V)" .
- ^ Pentacloruro de antimonio en Linstrom, Peter J .; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (consultado el 29 de mayo de 2014)
- ^ a b Guía de bolsillo de NIOSH sobre peligros químicos. "# 0036" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Greenwood, Norman N .; Earnshaw, Alan (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ↑ V. Gutmann (1976). "Efectos de los disolventes sobre las reactividades de compuestos organometálicos". Coord. Chem. Rev. 18 (2): 225–255. doi : 10.1016 / S0010-8545 (00) 82045-7 .
- ^ Laurence, C. y Gal, J.-F. Escalas de Basicidad y Afinidad de Lewis, Datos y Medición, (Wiley 2010) pp 50-51 IBSN 978-0-470-74957-9
- ^ Cramer, RE; Bopp, TT (1977). "Visualización gráfica de las entalpías de formación de aductos para ácidos y bases de Lewis". Revista de educación química . 54 : 612–613. doi : 10.1021 / ed054p612 .Las gráficas que se muestran en este documento utilizaron parámetros más antiguos. Los parámetros mejorados de E&C se enumeran en el modelo ECW .
- ^ Connelly, NG; Geiger, WE (1996). "Agentes químicos redox para la química organometálica". Chem. Rev. 96 (2): 877–922. doi : 10.1021 / cr940053x . PMID 11848774 .
- ^ Shekarchi, M .; Behbahani, F. K. Catal. Letón. 2017 147 2950. doi: 10.1007 / s10562-017-2194-2
Enlaces externos [ editar ]
| Wikimedia Commons tiene medios relacionados con el pentacloruro de antimonio . |