La conjugación bacteriana es la transferencia de material genético entre células bacterianas por contacto directo de célula a célula o por una conexión en forma de puente entre dos células. [1] Esto se realiza a través de un pilus . [2] Es un modo de reproducción parasexual en bacterias.
Es un mecanismo de transferencia horizontal de genes, al igual que la transformación y la transducción, aunque estos otros dos mecanismos no implican el contacto de célula a célula. [3]
La conjugación bacteriana clásica de E. coli se considera a menudo como el equivalente bacteriano de la reproducción o apareamiento sexual, ya que implica el intercambio de material genético. Sin embargo, no se trata de reproducción sexual, ya que no se produce ningún intercambio de gametos y, de hecho, no hay generación de un nuevo organismo : en cambio, se transforma un organismo existente. Durante la conjugación clásica de E. coli, la célula donante proporciona un elemento genético conjugativo o movilizable que suele ser un plásmido o transposón . [4] La mayoría de los plásmidos conjugativos tienen sistemas que garantizan que el receptor la celda aún no contiene un elemento similar.
La información genética transferida suele ser beneficiosa para el receptor. Los beneficios pueden incluir resistencia a los antibióticos , tolerancia a los xenobióticos o la capacidad de utilizar nuevos metabolitos . [5] Otros elementos pueden ser perjudiciales y pueden considerarse parásitos bacterianos .
La conjugación en Escherichia coli por zigogénesis espontánea [6] y en Mycobacterium smegmatis por transferencia conyugal distributiva [7] [8] difieren de la conjugación clásica de E. coli más bien estudiada en que estos casos implican una mezcla sustancial de los genomas parentales .
Historia [ editar ]
El proceso fue descubierto por Joshua Lederberg y Edward Tatum [9] en 1946.
Mecanismo [ editar ]
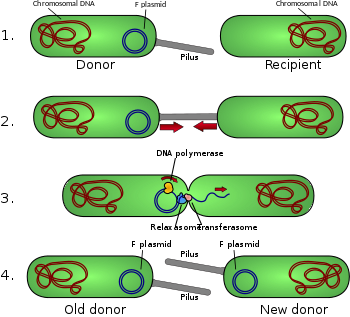
Diagrama de conjugación
- La célula donante produce pilus .
- Pilus se adhiere a la célula receptora y une las dos células.
- El plásmido móvil se corta y luego se transfiere una sola hebra de ADN a la célula receptora.
- Ambas células sintetizan una hebra complementaria para producir un plásmido circular de doble hebra y también reproducir pili; ambas células son ahora donantes viables para el factor F. [1]
El plásmido F es un episoma (un plásmido que puede integrarse en el cromosoma bacteriano mediante recombinación homóloga ) con una longitud de aproximadamente 100 kb . Lleva su propio origen de replicación , el oriV , y un origen de transferencia, u oriT . [4] Solo puede haber una copia del plásmido F en una bacteria dada, ya sea libre o integrada, y las bacterias que poseen una copia se denominan F-positivas o F-plus (denotadas F + ). Las células que carecen de plásmidos F se denominan F-negativas o F-menos (F- ) y como tales pueden funcionar como células receptoras.
Entre otra información genética, el plásmido F lleva un locus tra y trb , que juntos tienen aproximadamente 33 kb de largo y constan de aproximadamente 40 genes . El tralocus incluye el gen de la pilina y los genes reguladores, que juntos forman pili en la superficie celular. El locus también incluye los genes para las proteínas que se adhieren a la superficie de F - bacterias e inician la conjugación. Aunque existe cierto debate sobre el mecanismo exacto de conjugación, parece que los pili no son las estructuras a través de las cuales se produce el intercambio de ADN. Esto se ha demostrado en experimentos en los que se permite que los pilus hagan contacto, pero luego sedesnaturalizado con SDS y, sin embargo, la transformación del ADN aún continúa. Varias proteínas codificadas en el locus tra o trb parecen abrir un canal entre las bacterias y se cree que la enzima traD, ubicada en la base del pilus, inicia la fusión de la membrana.
Cuando la conjugación es iniciada por una señal, la enzima relaxasa crea una muesca en una de las hebras del plásmido conjugativo en el oriT . La relaxasa puede funcionar sola o en un complejo de más de una docena de proteínas conocidas colectivamente como relaxosoma . En el sistema del plásmido F, la enzima relaxasa se llama TraI y el relaxosoma consta de TraI, TraY, TraM y el factor huésped integrado IHF. La hebra mellada, o hebra T , se desenrolla entonces de la hebra no rota y se transfiere a la célula receptora en una dirección del extremo 5 'al extremo 3'. La hebra restante se replica independientemente de la acción conjugativa (la replicación vegetativa comienza en el oriV) o en concierto con la conjugación (replicación conjugativa similar a la replicación en círculo rodante del fago lambda ). La replicación conjugativa puede requerir una segunda mella antes de que pueda ocurrir una transferencia exitosa. Un informe reciente afirma haber inhibido la conjugación con sustancias químicas que imitan un paso intermedio de este segundo evento de mella. [10]
Si el plásmido F que se transfiere se ha integrado previamente en el genoma del donante (produciendo una cepa de Hfr ["alta frecuencia de recombinación"]), parte del ADN cromosómico del donante también puede transferirse con el ADN del plásmido. [3] La cantidad de ADN cromosómico que se transfiere depende de cuánto tiempo permanezcan en contacto las dos bacterias conjugadas. En las cepas de laboratorio comunes de E. coli, la transferencia de todo el cromosoma bacteriano tarda unos 100 minutos. El ADN transferido puede luego integrarse en el genoma del receptor mediante recombinación homóloga .
Un cultivo celular que contiene en su población células con plásmidos F no integrados generalmente también contiene algunas células que han integrado accidentalmente sus plásmidos. Son estas células las responsables de las transferencias de genes cromosómicas de baja frecuencia que se producen en dichos cultivos. Algunas cepas de bacterias con un plásmido F integrado se pueden aislar y cultivar en cultivo puro. Debido a que tales cepas transferir genes cromosómicos de manera muy eficiente que se llaman Hfr ( h igh f recuencia de r ecombination). El genoma de E. coli fue mapeado originalmente mediante experimentos de apareamiento interrumpido en los que varias células Hfr en el proceso de conjugación se separaron de los receptores después de menos de 100 minutos (inicialmente usando un mezclador Waring). Luego se investigaron los genes que fueron transferidos.
Dado que la integración del plásmido F en el cromosoma de E. coli es una ocurrencia espontánea rara, y dado que los numerosos genes que promueven la transferencia de ADN están en el genoma del plásmido en lugar del genoma bacteriano, se ha argumentado que la transferencia de genes bacterianos conjugativos, como ocurre en el sistema E. coli Hfr, no es una adaptación evolutiva del huésped bacteriano, ni es probablemente ancestral del sexo eucariota. [13]
Cigogénesis espontánea en E. coli
Además de la conjugación bacteriana clásica descrita anteriormente para E. coli , se observa una forma de conjugación denominada zigogénesis espontánea (apareamiento Z para abreviar) en ciertas cepas de E. coli . [6] En el apareamiento Z hay una mezcla genética completa y se forman diploides inestables que arrojan células fenotípicamente haploides, de las cuales algunas muestran un fenotipo parental y otras son verdaderas recombinantes .
Transferencia conyugal en micobacterias [ editar ]
La conjugación en Mycobacteria smegmatis , como la conjugación en E. coli , requiere un contacto estable y prolongado entre un donante y una cepa receptora, es resistente a la ADNasa y el ADN transferido se incorpora al cromosoma receptor mediante recombinación homóloga. Sin embargo, a diferencia de la conjugación de E. coli Hfr, la conjugación de micobacterias se basa en cromosomas más que en plásmidos. [7] [8] Además, en contraste con la conjugación de E. coli Hfr, en M. smegmatistodas las regiones del cromosoma se transfieren con eficiencias comparables. Las longitudes de los segmentos donantes varían ampliamente, pero tienen una longitud promedio de 44,2 kb. Dado que se transfieren una media de 13 tractos, el total medio de ADN transferido por genoma es de 575 kb. [8] Este proceso se conoce como "Transferencia conyugal distributiva". [7] [8] Gray y col. [7] encontró una combinación sustancial de los genomas parentales como resultado de la conjugación y consideró que esta combinación recuerda a la observada en los productos meióticos de la reproducción sexual.
Transferencia entre reinos [ editar ]
Las bacterias relacionadas con la Rhizobia fijadora de nitrógeno son un caso interesante de conjugación entre reinos . [14] Por ejemplo, el plásmido inductor de tumores (Ti) de Agrobacterium y el plásmido inductor de tumores de raíz (Ri) de A. rhizogenes contienen genes que son capaces de transferirse a las células vegetales. La expresión de estos genes transforma eficazmente las células vegetales en fábricas productoras de opina . Las bacterias utilizan las opiniones como fuentes de nitrógeno y energía. Las células infectadas forman la agalla de la corona o los tumores de la raíz . Los plásmidos Ti y Ri son, por tanto, endosimbiontes. de las bacterias, que a su vez son endosimbiontes (o parásitos) de la planta infectada.
Los plásmidos Ti y Ri también se pueden transferir entre bacterias usando un sistema (el operón tra o transferencia ) que es diferente e independiente del sistema usado para la transferencia entre reinos (el operón vir o virulencia ). Tales transferencias crean cepas virulentas a partir de cepas previamente avirulentas.
Aplicaciones de la ingeniería genética [ editar ]
La conjugación es un medio conveniente para transferir material genético a una variedad de objetivos. En los laboratorios, se han reportado transferencias exitosas de bacterias a levaduras, [15] plantas, células de mamíferos, [16] [17] diatomeas [18] y mitocondrias aisladas de mamíferos . [19] La conjugación tiene ventajas sobre otras formas de transferencia genética, incluida la alteración mínima de la envoltura celular del objetivo y la capacidad de transferir cantidades relativamente grandes de material genético (ver la discusión anterior sobre la transferencia de cromosomas de E. coli ). En ingeniería de plantas, Agrobacterium-like conjugation complements other standard vehicles such as tobacco mosaic virus (TMV). While TMV is capable of infecting many plant families these are primarily herbaceous dicots. Agrobacterium-like conjugation is also primarily used for dicots, but monocot recipients are not uncommon.
See also[edit]
- Sexual conjugation in algae and ciliates
- Transfection
- Triparental mating
- Zygotic induction
References[edit]
- ^ a b Holmes RK, Jobling MG (1996). "Genetics". In Baron S, et al. (eds.). Genetics: Conjugation. in: Baron's Medical Microbiology (4th ed.). Univ of Texas Medical Branch. ISBN 0-9631172-1-1.
- ^ Dr.T.S.Ramarao M.sc, Ph.D. (1991). B.sc Botany-Volume-1.
- ^ a b Griffiths AJF; et al. (1999). An Introduction to genetic analysis (7th ed.). San Francisco: W.H. Freeman. ISBN 978-0-7167-3520-5.
- ^ a b Ryan KJ, Ray CG, eds. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. pp. 60–4. ISBN 978-0-8385-8529-0.
- ^ Holmes RK, Jobling MG (1996). "Genetics". In Baron S, et al. (eds.). Genetics: Exchange of Genetic Information. in: Baron's Medical Microbiology (4th ed.). Univ of Texas Medical Branch. ISBN 978-0-9631172-1-2.
- ^ a b Gratia JP, Thiry M (September 2003). "Spontaneous zygogenesis in Escherichia coli, a form of true sexuality in prokaryotes". Microbiology (Reading, Engl.). 149 (Pt 9): 2571–84. doi:10.1099/mic.0.26348-0. PMID 12949181.
- ^ a b c d Gray TA, Krywy JA, Harold J, Palumbo MJ, Derbyshire KM (July 2013). "Distributive conjugal transfer in mycobacteria generates progeny with meiotic-like genome-wide mosaicism, allowing mapping of a mating identity locus". PLOS Biol. 11 (7): e1001602. doi:10.1371/journal.pbio.1001602. PMC 3706393. PMID 23874149.
- ^ a b c d Derbyshire KM, Gray TA (2014). "Distributive Conjugal Transfer: New Insights into Horizontal Gene Transfer and Genetic Exchange in Mycobacteria". Microbiol Spectr. 2 (1): 61–79. doi:10.1128/microbiolspec.MGM2-0022-2013. PMC 4259119. PMID 25505644.
- ^ Lederberg J, Tatum EL (1946). "Gene recombination in E. coli". Nature. 158 (4016): 558. Bibcode:1946Natur.158..558L. doi:10.1038/158558a0. PMID 21001945. S2CID 1826960.
- ^ Lujan SA, Guogas LM, Ragonese H, Matson SW, Redinbo MR (2007). "Disrupting antibiotic resistance propagation by inhibiting the conjugative DNA relaxase". PNAS. 104 (30): 12282–7. Bibcode:2007PNAS..10412282L. doi:10.1073/pnas.0702760104. JSTOR 25436291. PMC 1916486. PMID 17630285.
- ^ "Genetic Exchange". www.microbiologybook.org. Retrieved 2017-12-04.
- ^ Griffiths, Anthony J.F.; Miller, Jeffrey H.; Suzuki, David T.; Lewontin, Richard C.; Gelbart, William M. (2000). "Bacterial conjugation". Cite journal requires
|journal=(help) - ^ Michod RE, Bernstein H, Nedelcu AM (2008). "Adaptive value of sex in microbial pathogens" (PDF). Infect Genet Evol. 8 (3): 267–285. doi:10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ Pan SQ, Jin S, Boulton MI, Hawes M, Gordon MP, Nester EW (July 1995). "An Agrobacterium virulence factor encoded by a Ti plasmid gene or a chromosomal gene is required for T-DNA transfer into plants". Mol. Microbiol. 17 (2): 259–69. doi:10.1111/j.1365-2958.1995.mmi_17020259.x. PMID 7494475. S2CID 38483513.
- ^ Heinemann JA, Sprague GF (July 1989). "Bacterial conjugative plasmids mobilize DNA transfer between bacteria and yeast". Nature. 340 (6230): 205–9. Bibcode:1989Natur.340..205H. doi:10.1038/340205a0. PMID 2666856. S2CID 4351266.
- ^ Kunik T, Tzfira T, Kapulnik Y, Gafni Y, Dingwall C, Citovsky V (February 2001). "Genetic transformation of HeLa cells by Agrobacterium". Proc. Natl. Acad. Sci. U.S.A. 98 (4): 1871–6. Bibcode:2001PNAS...98.1871K. doi:10.1073/pnas.041327598. PMC 29349. PMID 11172043.
- ^ Waters VL (December 2001). "Conjugation between bacterial and mammalian cells". Nat. Genet. 29 (4): 375–6. doi:10.1038/ng779. PMID 11726922. S2CID 27160.
- ^ Karas, Bogumil J.; Diner, Rachel E.; Lefebvre, Stephane C.; McQuaid, Jeff; Phillips, Alex P.R.; Noddings, Chari M.; Brunson, John K.; Valas, Ruben E.; Deerinck, Thomas J. (2015-04-21). "Designer diatom episomes delivered by bacterial conjugation". Nature Communications. 6: 6925. Bibcode:2015NatCo...6.6925K. doi:10.1038/ncomms7925. ISSN 2041-1723. PMC 4411287. PMID 25897682.
- ^ Yoon YG, Koob MD (2005). "Transformation of isolated mammalian mitochondria by bacterial conjugation". Nucleic Acids Res. 33 (16): e139. doi:10.1093/nar/gni140. PMC 1201378. PMID 16157861.
External links[edit]
- Bacterial conjugation (a Flash animation)