DuPhos
DuPhos es una clase de compuestos organofosforados que se utilizan como ligandos para la síntesis asimétrica . El nombre DuPhos se deriva de (1) la compañía química que patrocinó la investigación que condujo a la invención de este ligando, DuPont y (2) el compuesto es un tipo de ligando de difosfina . Específicamente se clasifica como un C 2 ligando -symmetric , que consta de dos fosfolanos anillos fijados a un anillo de benceno.
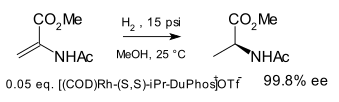
El ligando fue introducido en 1991 por MJ Burk [1] [2] y se demostró por primera vez en la hidrogenación asimétrica de ciertos ésteres de enamida a precursores de aminoácidos :
En el momento de la invención se conocían otros ligandos de difosfina quirales , por ejemplo , DIOP , DIPAMP , CHIRAPHOS , pero se encontró que DuPhos era más eficaz.
Descripción
El ligando consta de dos anillos fosfolano 2,5-alquil-sustituidos conectados por un puente 1,2-fenilo. El grupo alquilo puede ser metilo , etilo , propilo o isopropilo . En el bis (dimetilfosfolano) etano estrechamente relacionado o ligando BPE [3] [4], el puente o- fenileno se reemplaza por un puente 1,2-etileno. Ambos compuestos pueden obtenerse del diol quiral correspondiente mediante conversión en el sulfato cíclico.y reacción con fenilbisfosfina litiada. En DuPhos, los átomos de fósforo son ricos en electrones, lo que hace que los complejos metálicos resultantes sean reactivos. Los átomos de fósforo también introducen una especie de pseudoquiralidad que hace que la enantioselección sea independiente de la conformación química general [5].
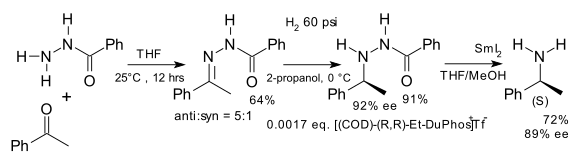
Otra aplicación temprana es la síntesis de aminoácidos quirales no naturales en una aminación reductora formal [6], por ejemplo a partir de benzofenona y la hidrazona del cloruro de benzoílo : [7]
En el alcance original, el catalizador metálico era el rodio, pero la catálisis por rutenio se introdujo en 1995 [8] con la hidrogenación del grupo cetona en β-cetoésteres:
Aplicaciones
Una aplicación de una síntesis asimétrica con un ligando DuPhos es la hidrogenación de la deshidroarfarina a warfarina : [9]
Duphos también se aplica en la síntesis de derivados de triptófano. [10]
En catálisis de polimerización
Los ligandos DuPhos se utilizan en la copolimerización de alfa-olefina / monóxido de carbono catalizada por metales para formar policetonas isotácticas quirales . La primera publicación en este campo se remonta a 1994 con el sistema catalizador [Pd (Me-DuPhos (MeCN) 2 )] (BF4) 2 [11]
Ligando BozPhos
La monooxidación de (R, R) -Me-Duphos usando dimetilsulfuro de borano como grupo protector y peróxido de hidrógeno como agente oxidante da bozPhos [12] [13] Este ligando es útil en la adición asimétrica catalizada por cobre de reactivos de di organozinc a N-difenilfosfinoiliminas .
Referencias
- ^ Mark J. Burk (1991). " Bis (fosfolanos) asimétricos C 2 y su uso en reacciones de hidrogenación altamente enantioselectivas". Mermelada. Chem. Soc. 113 : 8518–8519. doi : 10.1021 / ja00022a047 .
- ^ Mark J. Burk, John E. Feaster, William A. Nugent, Richard L. Harlow J. Am. Chem. Soc. (1993). "Preparación y uso de bis (fosfolanos) asimétricos C 2 : producción de derivados de α-aminoácidos mediante reacciones de hidrogenación altamente enantioselectivas". 115 : 10125–10138. doi : 10.1021 / ja00075a031 . Cite journal requiere
|journal=( ayuda ) CS1 maint: usa el parámetro de los autores ( enlace ) - ^ Nuevas fosfinas quirales ricas en electrones para catálisis asimétrica Mark J. Burk, John E. Feaster, Richard L. Harlow Organometallics , 1990 , 9 (10), págs. 2653–2655 doi : 10.1021 / om00160a010
- ^ Nuevos fosfolanos quirales; Síntesis, caracterización y uso en reacciones de hidrogenación asimétrica Tetraedro: Asimetría, Volumen 2, Número 7, 1991 , Páginas 569-592 Mark J. Burk, John E. Feaster, Richard L.Harlow doi : 10.1016 / S0957-4166 (00) 86109-1
- ^ Desarrollos recientes en hidrogenación asimétrica catalítica que emplea ligandos de difosfina P-quirogénica Karen VL Crépy, Tsuneo Imamoto Advanced Synthesis & Catalysis Volume 345 Issue 1-2, Pages 79-101 2003 doi : 10.1002 / adsc.200390031
- ^ Hidrogenación enantioselectiva del grupo C: N: un procedimiento de aminación reductora asimétrica catalítica Mark J. Burk, John E. Feaster J. Am. Chem. Soc. , 1992 , 114 (15), págs. 6266–6267 doi : 10.1021 / ja00041a067
- ^ Aminación reductora asimétrica catalítica de cetonas mediante hidrogenación altamente enantioselectiva del doble enlace C = N Mark J. Burk, Jose P. Martinez, John E. Feaster y Nick Cosford Tetrahedron Volumen 50, Número 15, 11 de abril de 1994 , Páginas 4399-4428 doi : 10.1016 / S0040-4020 (01) 89375-3
- ^ Hidrogenación asimétrica práctica de β-cetoésteres a presión atmosférica utilizando catalizadores quirales de Ru (II) JP Genêt, V.Ratovelomanana-Vidal, MC Caño de Andrade, X. Pfister, P. Guerreiro y JY Lenoir Tetrahedron Letters Volumen 36, Edición 27 , 3 de julio de 1995 , páginas 4801-4804 doi : 10.1016 / 0040-4039 (95) 00873-B
- ^ La primera síntesis asimétrica práctica de R y S-warfarina Andrea Robinson y Hui-Yin Li John Feaster Tetrahedron Letters Volumen 37, Número 46, 11 de noviembre de 1996 , Páginas 8321-8324 doi : 10.1016 / 0040-4039 (96) 01796-0
- ^ Una ruta de hidrogenación asimétrica altamente enantioselectiva a β- (2R, 3S) -metiltriptófano R. Scott Hoerrner, David Askin, RP Volante y Paul J. Reider Tetrahedron Letters Volumen 39, Número 21, 21 de mayo de 1998 , páginas 3455-3458 doi : 10.1016 / S0040-4039 (98) 00604-2
- ^ Copolimerización alternante isoespecífica catalizada con paladio (II) de α-olefinas alifáticas con monóxido de carbono e isomerización alternante isoespecífica Cooligomerización de una olefina disustituida en 1,2 con monóxido de carbono. Síntesis de 1,4- y 1,5-policetonas nuevas, ópticamente activas, isotácticas Zhaozhong Jiang, Ayusman Sen J. Am. Chem. Soc. , 1995 , 117 (16), págs. 4455–4467 doi : 10.1021 / ja00121a003
- ^ Alexandre Côté, Jean-Nicolas Desrosiers, Alessandro A. Boezio y André B. Charette (2006). "Preparación de ( R , R ) -BozPhos enantioméricamente puro " . Síntesis orgánicas . 83 : 1.CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Jean-Nicolas Desrosiers, Alexandre Côté, Alessandro A. Boezio y André B. Charette (2006). "Preparación de clorhidrato de ( 1S ) -1-fenilpropan-1-amina enriquecido enantioméricamente mediante la adición catalítica de reactivos de diorganozinc a iminas" . Síntesis orgánicas . 83 : 5.CS1 maint: varios nombres: lista de autores ( enlace )
- Difosfinas
- Productos DuPont