En la química de polímeros , la fotooxidación (a veces: fotodegradación oxidativa ) es la degradación de la superficie de un polímero debido a la acción combinada de luz y oxígeno. [1] Es el factor más importante en la erosión de los plásticos. [2] La fotooxidación hace que las cadenas del polímero se rompan ( escisión de la cadena ), lo que hace que el material se vuelva cada vez más quebradizo. Esto conduce a fallas mecánicas y, en una etapa avanzada, a la formación de microplásticos . En los textiles, el proceso se llama fototendering .
Se han desarrollado tecnologías para acelerar e inhibir este proceso. Por ejemplo, se espera que los componentes plásticos de construcción como puertas, marcos de ventanas y canaletas duren décadas, lo que requiere el uso de estabilizadores avanzados de polímeros UV . Por el contrario, los plásticos de un solo uso pueden tratarse con aditivos biodegradables para acelerar su fragmentación. Muchos pigmentos y tintes pueden tener efectos similares debido a su capacidad para absorber energía UV.
Polímeros susceptibles

PP: polipropileno , PE: polietileno , PVC: cloruro de polivinilo , PS: poliestireno , PET: tereftalato de polietileno
La susceptibilidad a la fotooxidación varía según la estructura química del polímero. Algunos materiales tienen una excelente estabilidad, como los fluoropolímeros , poliimidas , siliconas y ciertos polímeros de acrilato . Sin embargo, la producción mundial de polímeros está dominada por una variedad de plásticos básicos que representan la mayoría de los desechos plásticos . De estos, el tereftalato de polietileno (PET) tiene solo una resistencia moderada a los rayos UV y los demás, que incluyen poliestireno , cloruro de polivinilo (PVC) y poliolefinas como polipropileno (PP) y polietileno. (PE) son todos muy susceptibles.
La fotooxidación es una forma de fotodegradación y comienza con la formación de radicales libres en la cadena del polímero, que continúan reaccionando con el oxígeno en reacciones en cadena . Para muchos polímeros, el mecanismo de autooxidación general es una aproximación razonable de la química subyacente. El proceso es autocatalítico y genera un número creciente de radicales y especies reactivas de oxígeno. Estas reacciones dan como resultado cambios en el peso molecular (y distribución del peso molecular ) del polímero y, como consecuencia de esto, el material se vuelve más frágil. El proceso general se puede dividir en cuatro etapas:
- Inicio del proceso de generación del radical libre inicial.
- Propagación la conversión de una especie activa a otra.
- Pasos de ramificación de cadena que terminan con la producción de más de una especie activa. La fotólisis de hidroperóxidos es el principal ejemplo.
- Pasos de terminación en los que se eliminan las especies activas, por ejemplo, por desproporción radical
La fotooxidación puede ocurrir simultáneamente con otros procesos como la degradación térmica , y cada uno de estos puede acelerar al otro.
Poliolefinas
Las poliolefinas como el polietileno y el polipropileno son susceptibles a la fotooxidación y alrededor del 70% de los estabilizadores de luz producidos en todo el mundo se utilizan para su protección, a pesar de que representan solo alrededor del 50% de la producción mundial de plástico. [1] Los hidrocarburos alifáticos solo pueden adsorber rayos ultravioleta de alta energía con una longitud de onda por debajo de ~ 250 nm, sin embargo, la atmósfera de la Tierra y la capa de ozono eliminan dichos rayos, siendo la longitud de onda mínima normal de 280-290 nm. [3] Por lo tanto, la mayor parte del polímero es fotoinerte y, en cambio, la degradación se atribuye a la presencia de diversas impurezas, que se introducen durante las etapas de fabricación o procesamiento. Estos incluyen hidroperóxidoy grupos carbonilo , así como sales metálicas tales como residuos de catalizador.
Todas estas especies actúan como fotoiniciadores . [4] Los grupos orgánicos son capaces de absorber luz ultravioleta por encima de 290 nm, después de lo cual se someten a fotólisis para generar radicales. [5] Las impurezas metálicas actúan como fotocatalistas , [6] aunque tales reacciones pueden ser complejas. [7] [8] También se ha sugerido que están involucrados complejos de transferencia de carga de polímero-O 2 . [9] [10] La iniciación genera radicales carbonos en la cadena del polímero, a veces llamados macrorradicales (P •).

Iniciación en cadena
Propagación en cadena
Ramificación de cadena
Terminación
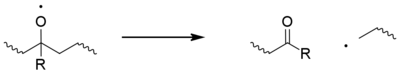
Clásicamente, los macrorradicales centrados en carbono (P •) reaccionan rápidamente con el oxígeno para formar radicales hidroperoxilo (POO •), que a su vez extraen un átomo de H de la cadena del polímero para dar un hidroperóxido (POOH) y un macrorradical fresco. Los hidroperóxidos se someten fácilmente a fotólisis para dar un radical macrorradical alcoxilo (PO •) y un radical hidroxilo (HO •), los cuales pueden pasar a formar nuevos radicales poliméricos mediante la abstracción de hidrógeno. Se han propuesto alternativas no clásicas a estos pasos. [11] El radical alcoxilo también puede someterse a escisión beta , [12] generar una acil- cetona y macrorradical. Se considera que esta es la principal causa de rotura de cadenas en polipropileno. [13]
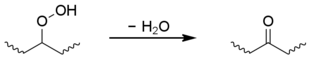
Los hidroperóxidos secundarios también pueden sufrir una reacción intramolecular para dar un grupo cetona, aunque esto se limita al polietileno. [1] [14] [15] [16]
Las cetonas generadas por estos procesos son en sí mismas fotoactivas, aunque mucho más débiles. A temperatura ambiente, se someten a reacciones Norrish de Tipo II con escisión en cadena. [17] También pueden absorber energía UV, que luego pueden transferir a O 2 , lo que hace que entre en su estado triplete altamente reactivo . [18] El triplete de oxígeno es un potente agente oxidante que puede pasar a formarse y causar una mayor degradación.
Poliestireno
En el caso del poliestireno, el mecanismo completo de fotooxidación es todavía un tema de debate, ya que diferentes vías pueden operar simultáneamente [19] y variar según la longitud de onda de la luz incidente. [20] Independientemente, hay acuerdo sobre los pasos principales. [21]
El poliestireno puro no debería ser capaz de absorber luz con una longitud de onda inferior a ~ 280 nm y la iniciación se explica a través de impurezas fotolábiles (hidroperóxidos) y complejos de transferencia de carga, [22] todos los cuales pueden absorber la luz solar normal. [23] Los complejos de transferencia de carga de oxígeno y grupos fenilo de poliestireno absorben la luz para formar oxígeno singlete , que actúa como un iniciador de radicales. [22] Las impurezas de carbonilo en el polímero (cf acetofenona ) también absorben luz en el rango casi ultravioleta (300 a 400 nm), formando cetonas excitadas capaces de abstraer átomos de hidrógeno directamente del polímero. [23] El hidroperóxido se somete a fotólisis para formar radicales hidroxilo y alcoxilo.
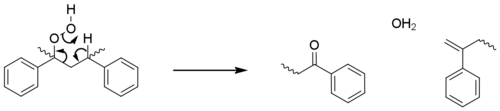
Estos pasos de iniciación generan macrorradicales en sitios terciarios, ya que estos están más estabilizados. Los pasos de propagación son esencialmente idénticos a los observados para las poliolefinas; con oxidación, abstracción de hidrógeno y fotólisis que conducen a reacciones de escisión beta y un número creciente de radicales. Estos pasos explican la mayor parte de la ruptura de la cadena, sin embargo, en una ruta menor, el hidroperóxido reacciona directamente con el polímero para formar un grupo cetona ( acetofenona ) y un alqueno terminal sin la formación de radicales adicionales. [24]
Se observa que el poliestireno amarillea durante la fotooxidación, lo que se atribuye a la formación de polienos a partir de estos alquenos terminales. [25]
Cloruro de polivinilo - (PVC)
Los organoclorados como el cloruro de polivinilo (PVC) no absorben luz por encima de 220 nm. En cambio, la iniciación de la fotooxidación es causada por varios grupos, que incluyen irregularidades o defectos en la cadena del polímero [26] [27] , así como hidroperóxidos, grupos carbonilo y dobles enlaces. [28] Los hidroperóxidos formados durante el procesamiento son el iniciador más importante para empezar, [29] sin embargo, su concentración disminuye durante la fotooxidación mientras que la concentración de carbonilo aumenta, [30] ya que dichos carbonilos pueden convertirse en el iniciador principal con el tiempo. [29] [31] [32]
Los pasos de propagación involucran el radical hidroperoxilo, que puede extraer hidrógeno de los sitios de hidrocarburos (-CH 2 -) y organoclorados (-CH 2 Cl-) en el polímero a velocidades comparables. [29] [31] Los radicales formados en los sitios de hidrocarburos se convierten rápidamente en alquenos con pérdida de cloro radical. Esto forma hidrógenos alílicos (mostrados en rojo) que son más susceptibles a la abstracción de hidrógeno que conduce a la formación de polienos en reacciones similares a cremalleras.
Cuando los polienos contienen al menos ocho dobles enlaces conjugados, se colorean, lo que lleva al amarilleamiento y, finalmente, al pardeamiento del material. Esto se compensa ligeramente por el fotoblanqueo de polienos más largos con oxígeno atmosférico, [33] sin embargo, el PVC eventualmente se decolora a menos que estén presentes estabilizadores poliméricos . Las reacciones en los sitios de los organoclorados proceden mediante el hidroperoxilo y el hidroperóxido habituales antes de que la fotólisis produzca el radical α-cloro-alcoxilo. Esta especie puede sufrir varias reacciones para dar carbonilos, enlaces cruzados de peróxido y productos de escisión beta. [34]

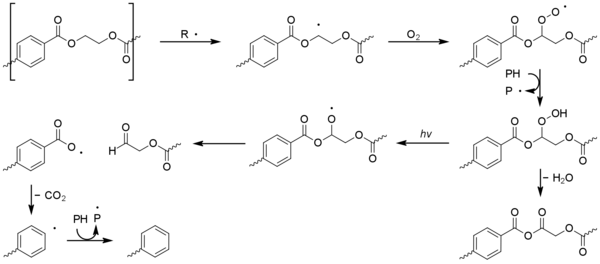
Poli (tereftalato de etileno) - (PET)
A diferencia de la mayoría de los demás plásticos básicos, el tereftalato de polietileno (PET) es capaz de absorber los rayos ultravioleta cercanos a la luz solar. La absorción comienza a 360 nm, se vuelve más fuerte por debajo de 320 nm y es muy significativa por debajo de 300 nm. [1] [35] [36] A pesar de que este PET tiene una mejor resistencia a la fotooxidación que otros plásticos básicos , esto se debe a un bajo rendimiento cuántico . [37] La química de degradación es complicada debido a la fotodisociación simultánea.(es decir, que no involucran oxígeno) y reacciones de fotooxidación de las partes aromáticas y alifáticas de la molécula. La escisión de la cadena es el proceso dominante, siendo menos común la ramificación de la cadena y la formación de impurezas coloreadas. El monóxido de carbono, el dióxido de carbono y los ácidos carboxílicos son los productos principales. [35] [36] La fotooxidación de otros poliésteres lineales como el tereftalato de polibutileno y el naftalato de polietileno procede de manera similar.
La fotodisociación implica la formación de una unidad de ácido tereftálico excitada que sufre reacciones de Norrish . Domina la reacción de tipo I, que provoca la escisión de la cadena en la unidad de carbonilo para dar una gama de productos. [1] [38]

Las reacciones de Norrish de tipo II son menos frecuentes pero dan lugar a acetaldehído a través de ésteres de alcohol vinílico. [36] Esto tiene un umbral de olor y sabor extremadamente bajo y puede causar un sabor desagradable en el agua embotellada. [39]
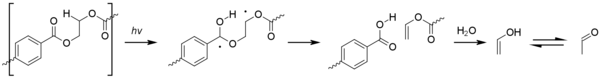
Los radicales formados por fotólisis pueden iniciar la fotooxidación en PET. La fotooxidación del núcleo de ácido tereftálico aromático da como resultado su oxidación escalonada a ácido 2,5-dihidroxitereftálico. El proceso de fotooxidación en los sitios alifáticos es similar al observado para las poliolefinas, con la formación de especies de hidroperóxido que eventualmente conducen a la escisión beta de la cadena del polímero. [1]
Factores secundarios
Medio ambiente
Quizás sorprendentemente, el efecto de la temperatura es a menudo mayor que el efecto de la exposición a los rayos UV. [5] Esto se puede ver en términos de la ecuación de Arrhenius , que muestra que las velocidades de reacción tienen una dependencia exponencial de la temperatura. En comparación, la dependencia de la tasa de degradación de la exposición a los rayos UV y la disponibilidad de oxígeno es, en líneas generales, lineal. Como los océanos son más fríos que la tierra, la contaminación plástica en el medio marino se degrada más lentamente. [40] [41] Los materiales enterrados en el relleno sanitario no se degradan por fotooxidación en absoluto, aunque pueden degradarse gradualmente por otros procesos.
El estrés mecánico puede afectar la tasa de fotooxidación [42] y también puede acelerar la ruptura física de los objetos plásticos. La tensión puede ser causada por carga mecánica (tensiones de tracción y cortante) o incluso por ciclos de temperatura , particularmente en sistemas compuestos que consisten en materiales con diferentes coeficientes de expansión de temperatura . Del mismo modo, las lluvias repentinas pueden provocar estrés térmico .
Efectos de los tintes / pigmentos
Los tintes y pigmentos se utilizan en materiales poliméricos para proporcionar color, sin embargo, también pueden afectar la tasa de fotooxidación. Muchos absorben los rayos UV y, al hacerlo, protegen el polímero; sin embargo, la absorción puede hacer que los tintes entren en un estado excitado en el que pueden atacar al polímero o transferir energía al O 2 para formar oxígeno singlete dañino . Cu-ftalocianina es un ejemplo, absorbe fuertemente la luz ultravioleta, sin embargo, la Cu-ftalocianina excitada puede actuar como un fotoiniciador al extraer átomos de hidrógeno del polímero. [43] Sus interacciones pueden volverse aún más complicadas cuando están presentes otros aditivos. [44] Del mismo modo, el negro de humo filtra la luz ultravioleta, pero aumenta en gran medida la cantidad de energía térmica absorbida por el plástico.
Aditivos para mejorar la degradación
Se pueden agregar aditivos biodegradables a los polímeros para acelerar su degradación. En el caso de la fotooxidación se utilizan aditivos de biodegradación OXO . [45] Se trata de sales de metales de transición como hierro (Fe) , manganeso (Mn) y cobalto (Co) . Los complejos de Fe aumentan la velocidad de fotooxidación al promover la homólisis de hidroperóxidos a través de reacciones de Fenton .
El uso de tales aditivos ha sido controvertido debido a las preocupaciones de que los plásticos tratados no se biodegradan completamente y, en cambio, dan como resultado la formación acelerada de microplásticos . [46] Los oxoplásticos serían difíciles de distinguir del plástico sin tratar, pero su inclusión durante el reciclaje de plástico puede crear un producto desestabilizado con menos usos potenciales, [47] [48] potencialmente poniendo en peligro el caso comercial para reciclar cualquier plástico. Los aditivos de biodegradación OXO fueron prohibidos en la UE en 2019 [49]
Prevención

El ataque de los rayos UV por la luz solar se puede mejorar o prevenir agregando estabilizadores de polímero anti-UV , generalmente antes de dar forma al producto mediante moldeo por inyección . Los estabilizadores UV en plásticos generalmente actúan absorbiendo la radiación UV preferentemente y disipando la energía como calor de bajo nivel. Los productos químicos utilizados son similares a los de los productos de protección solar , que protegen la piel del ataque de los rayos UV. Se utilizan con frecuencia en plásticos , incluidos cosméticos y películas . Se utilizan diferentes estabilizadores de UV según el sustrato, la vida útil prevista y la sensibilidad a la degradación de los rayos UV. Estabilizadores UV, como benzofenonas, actúan absorbiendo la radiación UV y previniendo la formación de radicales libres . Dependiendo de la sustitución, el espectro de absorción de UV se cambia para adaptarse a la aplicación. Las concentraciones normalmente oscilan entre el 0,05% y el 2%, con algunas aplicaciones hasta el 5%.
Con frecuencia, el vidrio puede ser una mejor alternativa a los polímeros cuando se trata de degradación por rayos UV. La mayoría de los tipos de vidrio comúnmente utilizados son altamente resistentes a la radiación ultravioleta. Las lámparas de protección contra explosiones para plataformas petrolíferas, por ejemplo, pueden estar hechas de polímero o vidrio. Aquí, la radiación ultravioleta y las inclemencias del tiempo afectan tanto al polímero, que el material tiene que ser reemplazado con frecuencia.
El poli (etileno-naftalato) (PEN) se puede proteger aplicando una capa de óxido de zinc, que actúa como película protectora que reduce la difusión de oxígeno. [50] El óxido de zinc también se puede usar en policarbonato (PC) para disminuir la tasa de oxidación y fotoamarilleo causada por la radiación solar. [51]
Análisis
Pruebas meteorológicas de polímeros
La fotooxidación de los polímeros se puede investigar mediante pruebas climáticas naturales o aceleradas. [52] Estas pruebas son importantes para determinar la vida útil esperada de los artículos de plástico, así como el destino de los residuos plásticos .
Detección
La degradación se puede detectar antes de que se vean grietas graves en un producto mediante espectroscopía infrarroja . [53] En particular, las peroxi-especies y los grupos carbonilo formados por fotooxidación tienen distintas bandas de absorción.
En el ejemplo que se muestra a la izquierda, los grupos carbonilo se detectaron fácilmente mediante espectroscopía IR de una película fina moldeada. El producto era un cono de carretera fabricado mediante moldeo rotacional en LDPE , que se había agrietado prematuramente en servicio. Muchos conos similares también fallaron porque no se usó un aditivo anti-UV durante el procesamiento. Otros productos plásticos que fallaron incluyeron camionetas de polipropileno utilizadas en obras viales que se agrietaron después de un servicio de solo unos meses.
Ver también
- Degradación de polímeros
- Fotodegradación
- Degradación térmica de polímeros
- Ingeniería forense de polímeros
- Corrosión bajo tensión
Referencias
- ^ a b c d e f Zweifel, Hans; Maier, Ralph D .; Schiller, Michael (2009). Manual de aditivos para plásticos (6ª ed.). Múnich: Hanser. ISBN 978-3-446-40801-2.
- ^ Feldman, D. (1 de octubre de 2002). "Meteorización de polímeros: fotooxidación". Revista de Polímeros y Medio Ambiente . 10 (4): 163-173. doi : 10.1023 / A: 1021148205366 . S2CID 92300829 .
- ^ Irradiancia espectral solar (1ª ed.). Viena: Commission internationale de l'eclairage. 1989. ISBN 9783900734220.
- ^ Amin, MU; Scott, G .; Tillekeratne, LMK (enero de 1975). "Mecanismo del proceso de fotoiniciación en polietileno". Revista europea de polímeros . 11 (1): 85–89. doi : 10.1016 / 0014-3057 (75) 90179-2 .
- ^ a b Grause, Guido; Chien, Mei-Fang; Inoue, Chihiro (noviembre de 2020). "Cambios durante la meteorización de poliolefinas". Degradación y estabilidad de polímeros . 181 : 109364. doi : 10.1016 / j.polymdegradstab.2020.109364 .
- ^ Allen, Norman S .; Chirinos-Padrón, Alfonso; Henman, Terence J. (marzo de 1985). "Oxidación fotoiniciada del polipropileno: una revisión". Progreso en Recubrimientos Orgánicos . 13 (2): 97-122. doi : 10.1016 / 0033-0655 (85) 80020-0 .
- ^ Osawa, Zenjiro (enero de 1988). "Papel de los metales y desactivadores de metales en la degradación de polímeros". Degradación y estabilidad de polímeros . 20 (3–4): 203–236. doi : 10.1016 / 0141-3910 (88) 90070-5 .
- ^ Hussain, Ikram; Atiqullah, Muhammad; Fazal, Atif; Alam, Khurshid; Hossaen, Anwar (diciembre de 2010). "Efecto de catalizadores de metaloceno y Ziegler-Natta residuales seleccionados sobre la degradación inducida por UV de películas de homopolímero de etileno no estabilizado". Degradación y estabilidad de polímeros . 95 (12): 2289–2299. doi : 10.1016 / j.polymdegradstab.2010.09.004 .
- ^ Gijsman, Pieter; Sampers, Jacq (enero de 1997). "La influencia de la presión y la temperatura del oxígeno en la química de degradación UV del polietileno". Degradación y estabilidad de polímeros . 58 (1–2): 55–59. doi : 10.1016 / S0141-3910 (97) 00012-8 .
- ^ Chien, JCW (diciembre de 1965). "Sobre el posible inicio de la fotooxidación por excitación de transferencia de carga". La Revista de Química Física . 69 (12): 4317–4325. doi : 10.1021 / j100782a040 .
- ^ Smith, Leesa M .; Aitken, Heather M .; Coote, Michelle L. (18 de septiembre de 2018). "El destino del radical peroxilo en la autooxidación: ¿cómo se produce realmente la degradación del polímero?". Cuentas de Investigación Química . 51 (9): 2006-2013. doi : 10.1021 / acs.accounts.8b00250 . hdl : 1885/209140 . PMID 30016062 .
- ^ Gray, Peter; Williams, Alan (1 de abril de 1959). "La termoquímica y la reactividad de los radicales alcoxilo". Revisiones químicas . 59 (2): 239–328. doi : 10.1021 / cr50026a002 .
- ^ Carlsson, DJ; Wiles, DM (noviembre de 1969). "La fotodegradación de películas de polipropileno. III. Fotólisis de hidroperóxidos de polipropileno". Macromoléculas . 2 (6): 597–606. Código bibliográfico : 1969MaMol ... 2..597C . doi : 10.1021 / ma60012a007 .
- ^ Costa, L .; Luda, diputado; Trossarelli, L. (enero de 1997). "Polietileno de peso molecular ultra alto — II. Térmica y fotooxidación" (PDF) . Degradación y estabilidad de polímeros . 58 (1–2): 41–54. doi : 10.1016 / S0141-3910 (97) 00010-4 . [ enlace muerto ]
- ^ Gugumus, F. (enero de 1990). "Contribución a la fotólisis de hidroperóxidos en polietileno". Degradación y estabilidad de polímeros . 27 (1): 19–34. doi : 10.1016 / 0141-3910 (90) 90094-N .
- ^ Gugumus, F. (marzo de 1988). "Contribución a la fotooxidación del polietileno". Angewandte Makromolekulare Chemie . 158 (1): 151-176. doi : 10.1002 / apmc.1988.051580108 .
- ^ Hartley, GH; Guillet, JE (marzo de 1968). "Fotoquímica de polímeros cetónicos. I. Estudios de copolímeros de etileno-monóxido de carbono". Macromoléculas . 1 (2): 165-170. Código Bibliográfico : 1968MaMol ... 1..165H . doi : 10.1021 / ma60002a012 .
- ^ Rabek, JF; ?? anby, B. (enero de 1975). "Papel del oxígeno singlete en la degradación fotooxidativa y fotoestabilización de polímeros". Ingeniería y ciencia de polímeros . 15 (1): 40–43. doi : 10.1002 / pen.760150107 .
- ↑ Kuzina, Svetlana I .; Mikhailov, Alfa I. (noviembre de 2001). "Fotooxidación de polímeros 4. El doble mecanismo de fotooxidación del poliestireno: un hidroperóxido y una fotocadena". Revista europea de polímeros . 37 (11): 2319–2325. doi : 10.1016 / S0014-3057 (01) 00028-3 .
- ^ Gardette, Jean-Luc; Mailhot, Bénédicte; Lemaire, Jacques (enero de 1995). "Mecanismos de fotooxidación de polímeros estirénicos". Degradación y estabilidad de polímeros . 48 (3): 457–470. doi : 10.1016 / 0141-3910 (95) 00113-Z .
- ^ Yousif, Emad; Haddad, Raghad (diciembre de 2013). "Fotodegradación y fotoestabilización de polímeros, especialmente poliestireno: revisión" . SpringerPlus . 2 (1): 398. doi : 10.1186 / 2193-1801-2-398 . PMC 4320144 . PMID 25674392 .
- ↑ a b Rabek, Jan F .; Rånby, Bengt (febrero de 1974). "Estudios sobre el mecanismo de fotooxidación de polímeros. I. Fotólisis y fotooxidación del poliestireno". Revista de ciencia de polímeros: edición de química de polímeros . 12 (2): 273-294. Código bibliográfico : 1974JPoSA..12..273R . doi : 10.1002 / pol.1974.170120203 .
- ^ a b Ranby, B .; Lucki, Julia (1 de enero de 1980). "Nuevos aspectos de la fotodegradación y fotooxidación del poliestireno" . Química pura y aplicada . 52 (2): 295-303. doi : 10.1351 / pac198052020295 .
- ^ Geuskens, G .; Baeyens-Volant, D .; Delaunois, G .; Lu-Vinh, Q .; Piret, W .; David, C. (enero de 1978). "Fotooxidación de polímeros — I". Revista europea de polímeros . 14 (4): 291-297. doi : 10.1016 / 0014-3057 (78) 90051-4 .
- ^ Geuskens, G .; Baeyens-Volant, D .; Delaunois, G .; Lu-Vinh, Q .; Piret, W .; David, C. (1 de enero de 1978). "Fotooxidación de polímeros - I: Estudio cuantitativo de las reacciones químicas resultantes de la irradiación de poliestireno a 253,7 nm en presencia de oxígeno". Revista europea de polímeros . 14 (4): 291-297. doi : 10.1016 / 0014-3057 (78) 90051-4 .
- ^ Starnes, William H. (3 de mayo de 2005). "Defectos estructurales en poli (cloruro de vinilo)" . Journal of Polymer Science Parte A: Química de polímeros . 43 (12): 2451–2467. Código bibliográfico : 2005JPoSA..43.2451S . doi : 10.1002 / pola.20811 .
- ↑ Adeniyi, Jacob B .; Scott, Gerald (1 de enero de 1987). "Los efectos de los defectos estructurales sobre la estabilidad del poli (cloruro de vinilo): una revisión crítica". Degradación y estabilidad de polímeros . 17 (2): 117-129. doi : 10.1016 / 0141-3910 (87) 90099-1 .
- ^ Starnes, WH (8 de abril de 1981). "Fotodegradación del cloruro de polivinilo: una encuesta de estudios recientes". Fotodegradación y fotoestabilización de recubrimientos . 151 : 197–215. doi : 10.1021 / bk-1981-0151.ch014 .
- ^ a b c Boyd Cooray, B .; Scott, G. (febrero de 1981). "El efecto del procesamiento térmico en el PVC - Parte VIII: El papel de los peróxidos formados térmicamente en la fotodegradación". Degradación y estabilidad de polímeros . 3 (2): 127-135. doi : 10.1016 / 0141-3910 (81) 90005-7 .
- ^ Jian, Li; Dafei, Zhou; Deren, Zhao (enero de 1991). "La fotodegradación del PVC: Parte II — Cambios estructurales en las cadenas de PVC". Degradación y estabilidad de polímeros . 31 (1): 1–7. doi : 10.1016 / 0141-3910 (91) 90091-5 .
- ↑ a b Decker, C. (enero de 1984). "Degradación de poli (cloruro de vinilo) por radiación ultravioleta — II". Revista europea de polímeros . 20 (2): 149-155. doi : 10.1016 / 0014-3057 (84) 90201-5 .
- ^ Decker, Christian; Balandier, Michel (julio de 1981). "Fotooxidación de poli (cloruro de vinilo)". Fotoquímica de polímeros . 1 (3): 221–232. doi : 10.1016 / 0144-2880 (81) 90021-X .
- ↑ Rabek, Jan F .; Rånby, Bengt; Östensson, Bengt; Flodin, Per (15 de diciembre de 1979). "Oxidación de estructuras poliénicas en poli (cloruro de vinilo) por oxígeno molecular y oxígeno singlete" . Revista de ciencia aplicada de polímeros . 24 (12): 2407–2413. doi : 10.1002 / app.1979.070241209 .
- ^ Jian, Li; Dafei, Zhou; Deren, Zhao (enero de 1990). "La fotodegradación del PVC: Parte I — Fotodegradación en aire y nitrógeno". Degradación y estabilidad de polímeros . 30 (3): 335–343. doi : 10.1016 / 0141-3910 (90) 90087-N .
- ^ a b Día, M .; Wiles, DM (enero de 1972). "Degradación fotoquímica del poli (tereftalato de etileno). II. Efecto de la longitud de onda y el medio ambiente en el proceso de descomposición". Revista de ciencia aplicada de polímeros . 16 (1): 191–202. doi : 10.1002 / app.1972.070160117 .
- ^ a b c Día, M .; Wiles, DM (enero de 1972). "Degradación fotoquímica del poli (tereftalato de etileno). III. Determinación de productos de descomposición y mecanismo de reacción". Revista de ciencia aplicada de polímeros . 16 (1): 203–215. doi : 10.1002 / app.1972.070160118 .
- ^ Osborn, KR (agosto de 1959). "La fotólisis del tereftalato de polietileno". Revista de ciencia de polímeros . 38 (134): 357–367. Código bibliográfico : 1959JPoSc..38..357O . doi : 10.1002 / pol.1959.1203813407 .
- ^ Sang, Tian; Wallis, Christopher J .; Hill, Gavin; Britovsek, George JP (agosto de 2020). "Degradación de tereftalato de polietileno en condiciones de meteorización natural y acelerada". Revista europea de polímeros . 136 : 109873. doi : 10.1016 / j.eurpolymj.2020.109873 .
- ^ Nawrocki, J; Dąbrowska, A; Borcz, A (noviembre de 2002). "Investigación de compuestos carbonílicos en aguas embotelladas de Polonia". Investigación del agua . 36 (19): 4893–4901. doi : 10.1016 / S0043-1354 (02) 00201-4 . PMID 12448533 .
- ↑ Pegram, Jan E .; Andrady, Anthony L. (enero de 1989). "Envejecimiento al aire libre de materiales poliméricos seleccionados bajo condiciones de exposición marina". Degradación y estabilidad de polímeros . 26 (4): 333–345. doi : 10.1016 / 0141-3910 (89) 90112-2 .
- ^ Chamas, Ali; Luna, Hyunjin; Zheng, Jiajia; Qiu, Yang; Tabassum, Tarnuma; Jang, Jun Hee; Abu-Omar, Mahdi; Scott, Susannah L .; Suh, Sangwon (9 de marzo de 2020). "Tasas de degradación de plásticos en el medio ambiente" . Química e Ingeniería Sostenible ACS . 8 (9): 3494–3511. doi : 10.1021 / acssuschemeng.9b06635 .
- ^ Tyler, David R. (30 December 2004). "Mechanistic Aspects of the Effects of Stress on the Rates of Photochemical Degradation Reactions in Polymers". Journal of Macromolecular Science, Part C: Polymer Reviews. 44 (4): 351–388. doi:10.1081/MC-200033682. S2CID 97316912.
- ^ "THE PHOTO-OXIDATION OF POLYMERS - A comparison with low molecular weight compounds" (PDF). Pergamon Press Ltd. 1979 - Pure & Appi. Chem., Vol. 51, pp.233—240. Retrieved 9 February 2011.
- ^ Allen, NS; Vasiliou, C .; Marshall, GP; Chen, W. (enero de 1989). "Interacciones fotoestabilizantes, antioxidantes y pigmentos en la oxidación térmica y fotoquímica de películas de polietileno". Degradación y estabilidad de polímeros . 24 (1): 17–31. doi : 10.1016 / 0141-3910 (89) 90130-4 .
- ^ Ammala, Anne; Bateman, Stuart; Dean, Katherine; Petinakis, Eustathios; Sangwan, Parveen; Wong, Susan; Yuan, Qiang; Yu, Long; Patrick, Colin; Leong, KH (agosto de 2011). "Una descripción general de las poliolefinas degradables y biodegradables". Progreso en ciencia de polímeros . 36 (8): 1015–1049. doi : 10.1016 / j.progpolymsci.2010.12.002 .
- ^ "sobre el impacto del uso de plástico oxodegradable, incluido el plástico oxodegradable" (PDF) . EUROPEO . Consultado el 11 de noviembre de 2020 .
- ^ Babetto, Alex S .; Antunes, Marcela C .; Bettini, Sílvia HP; Bonse, Baltus C. (febrero de 2020). "Una evaluación centrada en el reciclaje de la degradación termomecánica oxidativa de HDPE fundido que contiene prooxidante". Revista de Polímeros y Medio Ambiente . 28 (2): 699–712. doi : 10.1007 / s10924-019-01641-6 . S2CID 209432804 .
- ^ Aldas, Miguel; Paladines, Andrea; Valle, Vladimir; Pazmiño, Miguel; Quiroz, Francisco (2018). "Efecto de los plásticos aditivos prodegradantes incorporados sobre el reciclaje de polietileno" . Revista internacional de ciencia de polímeros . 2018 : 1–10. doi : 10.1155 / 2018/2474176 .
- ^ la directiva de la UE 2019/904 (artículo 5) , la directiva de la UE el 5 de junio de 2019
- ^ L. Guedri-Knani, JL Gardette, M. Jacquet, A. Rivaton, Fotoprotección de poli (etileno-naftalato) por recubrimiento de óxido de zinc, Tecnología de superficies y recubrimientos, volúmenes 180-181, 1 de marzo de 2004, páginas 71-75
- ^ A. Moustaghfir, E. Tomasella, A. Rivaton, B. Mailhot, M. Jacquet, JL Gardette, J. Cellier, Recubrimientos de óxido de zinc pulverizado: estudio estructural y aplicación a la fotoprotección del policarbonato, Tecnología de superficies y recubrimientos, Volúmenes 180-181, 1 de marzo de 2004, páginas 642-645.
- ^ Jacques, LFE (noviembre de 2000). "Ensayos de exposición acelerada y exterior / natural de recubrimientos". Progreso en ciencia de polímeros . 25 (9): 1337-1362. doi : 10.1016 / S0079-6700 (00) 00030-7 .
- ↑ Celina, Mathew C .; Linde, Erik; Martinez, Estevan (marzo de 2021). "Incertidumbres de cuantificación e identificación de carbonilo para la degradación de polímeros oxidativos". Degradación y estabilidad del polímero : 109550. doi : 10.1016 / j.polymdegradstab.2021.109550 .