Criomicroscopía electrónica de transmisión
La criomicroscopía electrónica de transmisión ( CryoTEM ), comúnmente conocida como crio-EM , es una forma de microscopía electrónica criogénica , más específicamente un tipo de microscopía electrónica de transmisión (TEM) donde la muestra se estudia a temperaturas criogénicas (generalmente temperaturas de nitrógeno líquido ). [1] Cryo-EM está ganando popularidad en biología estructural . [2]
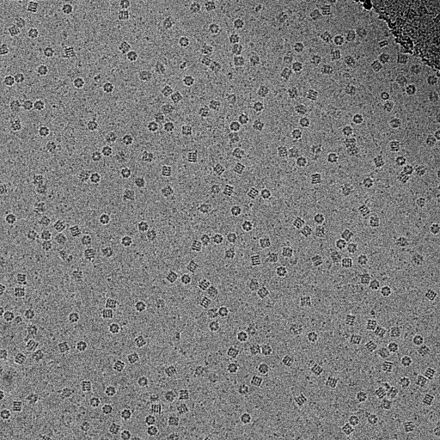
La utilidad de la criomicroscopía electrónica de transmisión radica en que permite la observación de muestras que no han sido teñidas ni fijadas de ninguna forma, mostrándolas en su entorno nativo. Esto contrasta con la cristalografía de rayos X , que requiere cristalizar la muestra, que puede ser difícil, y colocarla en ambientes no fisiológicos, que ocasionalmente pueden conducir a cambios conformacionales funcionalmente irrelevantes.
Los avances en la tecnología de detectores de electrones , en particular los DDE (Detectores directos de electrones), así como los algoritmos de imágenes de software más potentes, han permitido la determinación de estructuras macromoleculares con una resolución casi atómica. [3] Las macromoléculas fotografiadas incluyen virus , ribosomas , mitocondrias , canales iónicos y complejos enzimáticos . A partir de 2018, cryo-EM podría aplicarse a estructuras tan pequeñas como la hemoglobina (64 kDa ) [4] y con resoluciones de hasta 1.8 Å . [5]En 2019, las estructuras crio-EM representaron el 2,5% de las estructuras depositadas en el Protein Data Bank , [6] y este número sigue creciendo. [7] Una aplicación de cryo-EM es la tomografía crioelectrónica (cryo-ET), donde se crea una reconstrucción 3D de la muestra a partir de imágenes 2D inclinadas.
El fundamento original de CryoTEM era como un medio para combatir el daño por radiación de las muestras biológicas. La cantidad de radiación requerida para recolectar una imagen de una muestra en el microscopio electrónico es lo suficientemente alta como para ser una fuente potencial de daño de la muestra para estructuras delicadas. Además, el alto vacío requerido en la columna de un microscopio electrónico hace que el entorno para la muestra sea bastante hostil.
El problema del vacío se resolvió parcialmente mediante la introducción de tinciones negativas, pero incluso con tinciones negativas, las muestras biológicas son propensas al colapso estructural tras la deshidratación de la muestra. Incrustar las muestras en hielo por debajo de la temperatura de sublimación era una posibilidad que se contempló desde el principio, pero el agua tiende a organizarse en una red cristalina de menor densidad al congelarse y esto puede destruir la estructura de cualquier cosa que esté incrustada en ella.
A principios de la década de 1980, varios grupos que estudiaban la física del estado sólido intentaban producir hielo vítreo por diferentes medios, como la congelación a alta presión o la congelación instantánea. En un artículo fundamental en 1984, el grupo dirigido por Jacques Dubochet en el Laboratorio Europeo de Biología Molecular mostró imágenes de adenovirus incrustados en una capa vitrificada de agua. [8] En general, se considera que este artículo marca el origen de Cryo-EM, y la técnica se ha desarrollado hasta el punto de convertirse en una rutina en numerosos laboratorios de todo el mundo.