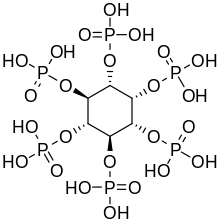
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC (1 R , 2 S , 3 r , 4 R , 5 S , 6 s ) -ciclohexano-1,2,3,4,5,6-hexayl hexakis [dihidrógeno (fosfato)] | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| CHEBI | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.001.369 | ||
| Número e | E391 (antioxidantes, ...) | ||
PubChem CID | |||
| UNII | |||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| C 6 H 18 O 24 P 6 | |||
| Masa molar | 660.029 g · mol −1 | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
El ácido fítico es un éster dihidrogenfosfato de inositol seis veces mayor (específicamente, del isómero myo ), también llamado hexakisfosfato de inositol ( IP6 ) o polifosfato de inositol . A pH fisiológico, los fosfatos se ionizan parcialmente, dando como resultado el anión fitato .
El anión ( myo ) fitato es una especie incolora que tiene un papel nutricional importante como principal forma de almacenamiento de fósforo en muchos tejidos vegetales , especialmente en salvado y semillas . También está presente en muchas legumbres , cereales y granos. El ácido fítico y el fitato tienen una fuerte afinidad de unión a los minerales de la dieta , calcio , hierro y zinc , lo que inhibe su absorción en el intestino delgado. [1]
Los polifosfatos de inositol inferiores son ésteres de inositol con menos de seis fosfatos, como inositol penta- (IP5), tetra- (IP4) y trifosfato (IP3). Estos ocurren en la naturaleza como catabolitos del ácido fítico.
Importancia en la agricultura [ editar ]
El ácido fítico se descubrió en 1903. [2]
Generalmente, el fósforo y el inositol en forma de fitato no están biodisponibles para los animales no rumiantes porque estos animales carecen de la enzima fitasa necesaria para hidrolizar los enlaces inositol-fosfato. Los rumiantes pueden digerir el fitato debido a la fitasa producida por los microorganismos del rumen . [3]
En la mayor parte de la agricultura comercial , el ganado no rumiante , como el cerdo , las aves de corral y el pescado , [4] se alimenta principalmente con cereales , como maíz , legumbres y soja . [5] Debido a que el fitato de estos granos y frijoles no está disponible para su absorción, el fitato no absorbido pasa a través del tracto gastrointestinal , elevando la cantidad de fósforo en el estiércol. [3] La excreción excesiva de fósforo puede provocar problemas ambientales, como la eutrofización . [6] El uso deLos granos germinados pueden reducir la cantidad de ácidos fíticos en el pienso, sin una reducción significativa del valor nutricional. [7]
Además, se han desarrollado líneas mutantes viables con bajo contenido de ácido fítico en varias especies de cultivos en las que las semillas han reducido drásticamente los niveles de ácido fítico y los aumentos concomitantes de fósforo inorgánico. [8] Sin embargo, los problemas de germinación han obstaculizado el uso de estos cultivares hasta ahora. Esto puede deberse al papel fundamental del ácido fítico en el almacenamiento de iones metálicos y de fósforo. [9] Las variantes de fitato también tienen el potencial de usarse en la remediación del suelo, para inmovilizar uranio , níquel y otros contaminantes inorgánicos. [10]
Funciones biológicas y fisiológicas [ editar ]
Aunque no son digeribles para muchos animales, ya que se encuentran en semillas y granos, el ácido fítico y sus metabolitos tienen varias funciones importantes para la planta de semillero.
En particular, el ácido fítico funciona como un depósito de fósforo, un depósito de energía, una fuente de cationes y una fuente de mioinositol (un precursor de la pared celular). El ácido fítico es la principal forma de almacenamiento de fósforo en las semillas de las plantas. [11]
En las células animales, los polifosfatos de mioinositol son ubicuos y el ácido fítico (hexakisfosfato de mioinositol) es el más abundante, con una concentración que varía de 10 a 100 μM en células de mamíferos, según el tipo de célula y la etapa de desarrollo. [12] [13]
Este compuesto no se obtiene de la dieta animal, sino que debe sintetizarse dentro de la célula a partir del fosfato y el inositol (que a su vez se produce a partir de la glucosa, generalmente en los riñones). La interacción del ácido fítico intracelular con proteínas intracelulares específicas se ha investigado in vitro y se ha descubierto que estas interacciones dan como resultado la inhibición o potenciación de las actividades fisiológicas de esas proteínas. [14] [15] La mejor evidencia de estos estudios sugiere un papel intracelular del ácido fítico como cofactor en la reparación del ADN por unión de extremos no homólogos. [14] Otros estudios que utilizan mutantes de levadura también han sugerido que el ácido fítico intracelular puede estar involucrado en la exportación de ARNm del núcleo al citosol. [dieciséis][17]
El hexafosfato de inositol facilita la formación del haz de seis hélices y el ensamblaje de la red inmadura del VIH-1 Gag. IP6 hace contactos iónicos con dos anillos de residuos de lisina en el centro del hexámero de Gag. La escisión proteolítica luego desenmascara un sitio de unión alternativo, donde la interacción de IP6 promueve el ensamblaje de la red de la cápside madura. Estos estudios identifican al IP6 como una pequeña molécula de origen natural que promueve tanto el ensamblaje como la maduración del VIH-1. [18]
Odontología [ editar ]
El IP6 tiene un uso potencial en endodoncia, odontología adhesiva, preventiva y regenerativa, y para mejorar las características y el rendimiento de los materiales dentales. https://www.frontiersin.org/articles/10.3389/fmats.2021.638909/full [19]
Ciencia de los alimentos [ editar ]
El ácido fítico, principalmente en forma de fitato en forma de fitina, se encuentra dentro de la cáscara y los granos de las semillas, [20] incluidas las nueces , los cereales y las legumbres. [1]
Las técnicas de preparación de alimentos en el hogar pueden descomponer el ácido fítico en todos estos alimentos. Simplemente cocinar la comida reducirá el ácido fítico hasta cierto punto. Los métodos más efectivos son remojar en un medio ácido, brotar y fermentar con ácido láctico , como en masa madre y encurtir . [21]
No se observó ningún fitato detectable (menos del 0,02% del peso húmedo) en verduras como la cebolleta y las hojas de col o en frutas como manzanas, naranjas, plátanos o peras. [22]
Como aditivo alimentario , se utiliza ácido fítico como conservante , E391 . [23] [24]
Fuentes de alimentos secos de ácido fítico [25] [22] [26] [27] [28] [29] [30] [31] Comida Proporción en peso (g / 100 g) Min. Max. Semilla de cáñamo descascarada [20] 4.5 4.5 Semilla de calabaza 4.3 4.3 Linaza 2.15 2,78 Harina de semillas de sésamo 5.36 5.36 semillas de chia 0,96 1,16 Almendras 1,35 3,22 nueces de Brasil 1,97 6.34 Coco 0,36 0,36 Avellana 0,65 0,65 Maní 0,95 1,76 Nuez 0,98 0,98 Maíz (maíz) 0.75 2.22 Oat 0.42 1.16 Oat meal 0.89 2.40 Brown rice 0.84 0.99 Polished rice 0.14 0.60 Wheat 0.39 1.35 Wheat flour 0.25 1.37 Wheat germ 0.08 1.14 Whole wheat bread 0.43 1.05 Beans, pinto 2.38 2.38 Buckwheat 1.00 1.00 Chickpeas 0.56 0.56 Lentils 0.44 0.50 Soybeans 1.00 2.22 Tofu 1.46 2.90 Soy beverage 1.24 1.24 Soy protein concentrate 1.24 2.17 New potato 0.18 0.34 Spinach 0.22 NR Avocado fruit 0.51 0.51 Chestnuts[32] 0.47
Fresh food sources of phytic acid[27] Food Proportion by weight (%) Min. Max. Taro 0.143 0.195 Cassava 0.114 0.152
Dietary mineral absorption[edit]
Phytic acid has a strong affinity to the dietary minerals, calcium, iron, and zinc, inhibiting their absorption from the small intestine.[1][33] Phytochemicals such as polyphenols and tannins also influence the binding.[34] When iron and zinc bind to phytic acid, they form insoluble precipitates and are far less absorbable in the intestines.[35][36]
Because phytic acid also can affect the absorption of iron, "dephytinization should be considered as a major strategy to improve iron nutrition during the weaning period".[37] Dephytinization by exogenous phytase to phytate-containing food is an approach being investigated to improve nutritional health in populations that are vulnerable to mineral deficiency due to their reliance on phytate-laden food staples. Crop breeding to increase mineral density (biofortification) or reducing phytate content are under preliminary research.[38]
See also[edit]
| Wikimedia Commons has media related to Phytic acid. |
- Antinutrient
- Essential nutrient
- Oxalic acid
References[edit]
- ^ a b c Schlemmer, U.; Frølich, W.; Prieto, R. M.; Grases, F. (2009). "Phytate in foods and significance for humans: Food sources, intake, processing, bioavailability, protective role and analysis" (PDF). Molecular Nutrition & Food Research. 53 Suppl 2: S330–75. doi:10.1002/mnfr.200900099. PMID 19774556.
- ^ Mullaney EJ, Ullah, Abul H.J. "Phytases: attributes, catalytic mechanisms, and applications" (PDF). United States Department of Agriculture–Agricultural Research Service. Archived from the original (PDF) on 2012-11-07. Retrieved May 18, 2012.
- ^ a b Klopfenstein TJ, Angel R, Cromwell G, Erickson GE, Fox DG, Parsons C, Satter LD, Sutton AL, Baker DH (July 2002). "Animal Diet Modification to Decrease the Potential for Nitrogen and Phosphorus Pollution". Council for Agricultural Science and Technology. 21.
- ^ Romarheim OH, Zhang C, Penn M, Liu YJ, Tian LX, Skrede A, Krogdahl Å, Storebakken T (2008). "Growth and intestinal morphology in cobia (Rachycentron canadum) fed extruded diets with two types of soybean meal partly replacing fish meal". Aquaculture Nutrition. 14 (2): 174–180. doi:10.1111/j.1365-2095.2007.00517.x.
- ^ Jezierny, D.; Mosenthin, R.; Weiss, E. (2010-05-01). "The use of grain legumes as a protein source in pig nutrition: A review". Animal Feed Science and Technology - ANIM FEED SCI TECH. 157 (3–4): 111–128. doi:10.1016/j.anifeedsci.2010.03.001.
- ^ Mallin MA (2003). "Industrialized Animal Production—A Major Source of Nutrient and Microbial Pollution to Aquatic Ecosystems". Population and Environment. 24 (5): 369–385. doi:10.1023/A:1023690824045. JSTOR 27503850. S2CID 154321894.
- ^ Malleshi, N. G.; Desikachar, H. S. R. (1986). "Nutritive value of malted millet flours". Plant Foods for Human Nutrition. 36 (3): 191–6. doi:10.1007/BF01092036.
- ^ Guttieri MJ, Peterson KM, Souza EJ (2006). "Milling and Baking Quality of Low Phytic Acid Wheat". Crop Science. 46 (6): 2403–8. doi:10.2135/cropsci2006.03.0137. S2CID 33700393.
- ^ Shitan, Nobukazu; Yazaki, Kazufumi (2013-01-01), Jeon, Kwang W. (ed.), "Chapter Nine - New Insights into the Transport Mechanisms in Plant Vacuoles", International Review of Cell and Molecular Biology, Academic Press, 305, pp. 383–433, retrieved 2020-04-24
- ^ Seaman JC, Hutchison JM, Jackson BP, Vulava VM (2003). "In situ treatment of metals in contaminated soils with phytate". Journal of Environmental Quality. 32 (1): 153–61. doi:10.2134/jeq2003.0153. PMID 12549554.
- ^ Reddy NR, Sathe SK, Salunkhe DK (1982). "Phytates in legumes and cereals". Advances in Food Research Volume 28. Advances in Food Research. 28. pp. 1–92. doi:10.1016/s0065-2628(08)60110-x. ISBN 9780120164288. PMID 6299067.
- ^ Szwergold BS, Graham RA, Brown TR (December 1987). "Observation of inositol pentakis- and hexakis-phosphates in mammalian tissues by 31P NMR". Biochemical and Biophysical Research Communications. 149 (3): 874–81. doi:10.1016/0006-291X(87)90489-X. PMID 3426614.
- ^ Sasakawa N, Sharif M, Hanley MR (July 1995). "Metabolism and biological activities of inositol pentakisphosphate and inositol hexakisphosphate". Biochemical Pharmacology. 50 (2): 137–46. doi:10.1016/0006-2952(95)00059-9. PMID 7543266.
- ^ a b Hanakahi LA, Bartlet-Jones M, Chappell C, Pappin D, West SC (September 2000). "Binding of inositol phosphate to DNA-PK and stimulation of double-strand break repair". Cell. 102 (6): 721–9. doi:10.1016/S0092-8674(00)00061-1. PMID 11030616. S2CID 112839.
- ^ Norris FA, Ungewickell E, Majerus PW (January 1995). "Inositol hexakisphosphate binds to clathrin assembly protein 3 (AP-3/AP180) and inhibits clathrin cage assembly in vitro". The Journal of Biological Chemistry. 270 (1): 214–7. doi:10.1074/jbc.270.1.214. PMID 7814377.
- ^ York JD, Odom AR, Murphy R, Ives EB, Wente SR (July 1999). "A phospholipase C-dependent inositol polyphosphate kinase pathway required for efficient messenger RNA export". Science. 285 (5424): 96–100. doi:10.1126/science.285.5424.96. PMID 10390371.
- ^ Shears SB (March 2001). "Assessing the omnipotence of inositol hexakisphosphate". Cellular Signalling (Submitted manuscript). 13 (3): 151–8. doi:10.1016/S0898-6568(01)00129-2. PMID 11282453.
- ^ Dick RA, Zadrozny KK, Xu C, Schur FK, Lyddon TD, Ricana CL, Wagner JM, Perilla JR, Ganser-Pornillos BK, Johnson MC, Pornillos O, Vogt VM (August 2018). "Inositol phosphates are assembly co-factors for HIV-1". Nature. 560 (7719): 509–512. Bibcode:2018Natur.560..509D. doi:10.1038/s41586-018-0396-4. PMC 6242333. PMID 30069050.
- ^ Nassar M, Nassar R, Maki H, Al-Yagoob A, Hachim M, Senok A, Williams D, Hiraishi N (March 2021). "Phytic Acid: Properties and Potential Applications in Dentistry". Frontiers in Materials. doi:10.3389/fmats.2021.638909.
- ^ a b Ellison, Campbell; Moreno, Teresa; Catchpole, Owen; Fenton, Tina; Lagutin, Kirill; MacKenzie, Andrew; Mitchell, Kevin; Scott, Dawn (2021-07-01). "Extraction of hemp seed using near-critical CO2, propane and dimethyl ether". The Journal of Supercritical Fluids. 173: 105218. doi:10.1016/j.supflu.2021.105218. ISSN 0896-8446.
- ^ "Phytates in cereals and legumes". fao.org.
- ^ a b Phillippy BQ, Wyatt CJ (May 2001). "Degradation of phytate in foods by phytases in fruit and vegetable extracts". Journal of Food Science. 66 (4): 535–539. doi:10.1111/j.1365-2621.2001.tb04598.x.
- ^ Functional Food - Improve Health through Adequate Food edited by María Chávarri Hueda, pg. 86
- ^ https://noshly.com/additive/391/preservative/391/
- ^ Dephytinisation with Intrinsic Wheat Phytase and Iron Fortification Significantly Increase Iron Absorption from Fonio (Digitaria exilis) Meals in West African Women (2013)
- ^ Reddy NR, Sathe SK (2001). Food Phytates. Boca Raton: CRC. ISBN 978-1-56676-867-2.[page needed]
- ^ a b Phillippy BQ, Bland JM, Evens TJ (January 2003). "Ion chromatography of phytate in roots and tubers". Journal of Agricultural and Food Chemistry. 51 (2): 350–3. doi:10.1021/jf025827m. PMID 12517094.
- ^ Macfarlane BJ, Bezwoda WR, Bothwell TH, Baynes RD, Bothwell JE, MacPhail AP, Lamparelli RD, Mayet F (February 1988). "Inhibitory effect of nuts on iron absorption". The American Journal of Clinical Nutrition. 47 (2): 270–4. doi:10.1093/ajcn/47.2.270. PMID 3341259.
- ^ Gordon DT, Chao LS (March 1984). "Relationship of components in wheat bran and spinach to iron bioavailability in the anemic rat". The Journal of Nutrition. 114 (3): 526–35. doi:10.1093/jn/114.3.526. PMID 6321704.
- ^ Arendt EK, Zannini E (2013-04-09). "Chapter 11: Buckwheat". Cereal grains for the food and beverage industries. Woodhead Publishing. p. 388. ISBN 978-0-85709-892-4.
- ^ Pereira Da Silva B. Concentration of nutrients and bioactive compounds in chia (Salvia Hispanica L.), protein quality and iron bioavailability in wistar rats (Ph.D. thesis). Federal University of Viçosa.
- ^ Scuhlz M. "Paleo Diet Guide: With Recipes in 30 Minutes or Less: Diabetes Heart Disease: Paleo Diet Friendly: Dairy Gluten Nut Soy Free Cookbook". PWPH Publications – via Google Books.
- ^ Gupta, R. K.; Gangoliya, S. S.; Singh, N. K. (2013). "Reduction of phytic acid and enhancement of bioavailable micronutrients in food grains". Journal of Food Science and Technology. 52 (2): 676–684. doi:10.1007/s13197-013-0978-y. PMC 4325021. PMID 25694676.
- ^ Prom-u-thai C, Huang L, Glahn RP, Welch RM, Fukai S, Rerkasem B (2006). "Iron (Fe) bioavailability and the distribution of anti-Fe nutrition biochemicals in the unpolished, polished grain and bran fraction of five rice genotypes". Journal of the Science of Food and Agriculture. 86 (8): 1209–15. doi:10.1002/jsfa.2471.
- ^ Hurrell RF (September 2003). "Influence of vegetable protein sources on trace element and mineral bioavailability". The Journal of Nutrition. 133 (9): 2973S–7S. doi:10.1093/jn/133.9.2973S. PMID 12949395.
- ^ Committee on Food Protection; Food and Nutrition Board; National Research Council (1973). "Phytates". Toxicants Occurring Naturally in Foods. National Academy of Sciences. pp. 363–371. ISBN 978-0-309-02117-3.
- ^ Hurrell RF, Reddy MB, Juillerat MA, Cook JD (May 2003). "Degradation of phytic acid in cereal porridges improves iron absorption by human subjects". The American Journal of Clinical Nutrition. 77 (5): 1213–9. CiteSeerX 10.1.1.333.4941. doi:10.1093/ajcn/77.5.1213. PMID 12716674.
- ^ Raboy, Victor (22 January 2020). "Low phytic acid crops: Observations based on four decades of research". Plants. 9 (2): 140. doi:10.3390/plants9020140. ISSN 2223-7747. PMC 7076677. PMID 31979164.