| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Propeno [1] | |||
| Identificadores | |||
| |||
Modelo 3D ( JSmol ) | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.003.693 | ||
| KEGG | |||
PubChem CID | |||
| Número RTECS |
| ||
| UNII | |||
| un numero | 1077 En gas licuado de petróleo : 1075 | ||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| C 3 H 6 | |||
| Masa molar | 42.081 g · mol −1 | ||
| Apariencia | Gas incoloro | ||
| Densidad | 1,81 kg / m 3 , gas (1,013 bar, 15 ° C) 1,745 kg / m 3 , gas (1,013 bar, 25 ° C) 613,9 kg / m 3 , líquido | ||
| Punto de fusion | −185,2 ° C (−301,4 ° F; 88,0 K) | ||
| Punto de ebullición | −47,6 ° C (−53,7 ° F; 225,6 K) | ||
| 0,61 g / m 3 | |||
| -31,5 · 10 −6 cm 3 / mol | |||
| Viscosidad | 8,34 µPa · sa 16,7 ° C | ||
| Estructura | |||
| 0,366 D (gas) | |||
| Peligros | |||
| Ficha de datos de seguridad | MSDS externa | ||
Clasificación de la UE (DSD) (desactualizada) | |||
| Frases R (desactualizadas) | 12 | ||
| Frases S (desactualizadas) | 16/9/33 | ||
| NFPA 704 (diamante de fuego) |  1 4 1 | ||
| punto de inflamabilidad | −108 ° C (−162 ° F; 165 K) | ||
| Compuestos relacionados | |||
Alquenos relacionados ; grupos relacionados | Etileno , isómeros de butileno ; Alilo , propenilo | ||
Compuestos relacionados | Propano , Propyne Propadiene , 1-Propanol 2-Propanol | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
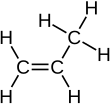
El propeno , también conocido como propileno o metiletileno , es un compuesto orgánico insaturado con la fórmula química . Tiene un doble enlace y es el segundo miembro más simple de la clase de hidrocarburos alquenos . Es un gas incoloro con un leve olor a petróleo. [2]
El biopropileno es la contraparte de base biológica del propileno. [3] [4]
Producción [ editar ]
Agrietamiento por vapor [ editar ]
La tecnología dominante para producir propileno es el craqueo al vapor. La misma tecnología se aplica al etano al etileno. Estas dos conversiones son los procesos n. ° 2 y n. ° 1 en la industria química, a juzgar por su escala. [5] En este proceso, el propano se deshidrogena . El subproducto es hidrógeno:
- CH 3 CH 2 CH 3 → CH 3 CH = CH 2 + H 2
El rendimiento de propeno es aproximadamente del 85% en m. Los subproductos se utilizan generalmente como combustible para la reacción de deshidrogenación del propano. El craqueo al vapor es uno de los procesos industriales que más energía consume.
La materia prima es nafta o propano , especialmente en el Medio Oriente , donde hay abundancia de propano de las operaciones de petróleo / gas. [6] El propeno puede separarse mediante destilación fraccionada de mezclas de hidrocarburos obtenidas del craqueo y otros procesos de refinado; El propeno de grado de refinería es aproximadamente del 50 al 70%. [7] En los Estados Unidos, el gas de esquisto es una fuente importante de propano.
Tecnología de conversión de olefinas [ editar ]
En la tecnología de conversión de triolefinas u olefinas de Phillips , el propileno se interconvierte con etileno y 2-butenos . Se utilizan catalizadores de renio y molibdeno : [8]
- CH 2 = CH 2 + CH 3 CH = CHCH 3 → 2 CH 2 = CHCH 3
La tecnología se basa en una reacción de metátesis de olefinas descubierta en Phillips Petroleum Company . [9] [10] Se alcanzan rendimientos de propeno de aproximadamente 90% en peso.
Relacionado está el proceso de metanol a olefinas / metanol a propeno . Convierte el gas de síntesis (gas de síntesis) en metanol y luego convierte el metanol en etileno y / o propeno . El proceso produce agua como subproducto. El gas de síntesis se produce a partir de la reformación de gas natural o mediante la reformación inducida por vapor de productos del petróleo como la nafta, o mediante la gasificación del carbón .
Craqueo catalítico fluido [ editar ]
El craqueo catalítico de fluidos de alta severidad (FCC) utiliza la tecnología FCC tradicional en condiciones severas (relaciones de catalizador a aceite más altas, tasas de inyección de vapor más altas, temperaturas más altas, etc.) para maximizar la cantidad de propeno y otros productos ligeros. Una unidad de FCC de alta severidad generalmente se alimenta con gasóleos (parafinas) y residuos, y produce aproximadamente 20-25 m% de propeno en la materia prima junto con mayores volúmenes de gasolina de motor y subproductos destilados.
Investigación y mercado [ editar ]
La producción de propeno se ha mantenido estática en alrededor de 35 millones de toneladas (solo Europa y América del Norte) entre 2000 y 2008, pero ha estado aumentando en Asia oriental, sobre todo Singapur y China. [11] La producción mundial total de propeno es actualmente aproximadamente la mitad de la de etileno.
Se ha explorado el uso de enzimas modificadas genéticamente, pero no tiene valor comercial. [12]
Usos [ editar ]
El propeno es el segundo producto de partida más importante en la industria petroquímica después del etileno . Es la materia prima de una amplia variedad de productos. Los fabricantes de polipropileno plástico representan casi dos tercios de toda la demanda. [13] Los usos finales del polipropileno incluyen películas, fibras, envases, embalajes y tapas y cierres. El propeno también se utiliza para la producción de sustancias químicas importantes como el óxido de propileno, acrilonitrilo, cumeno, butiraldehído y ácido acrílico. En el año 2013 se procesaron alrededor de 85 millones de toneladas de propeno en todo el mundo. [13]
El propeno y el benceno se convierten en acetona y fenol mediante el proceso de cumeno .
El propeno también se usa para producir isopropanol (propan-2-ol), acrilonitrilo , óxido de propileno y epiclorhidrina . [14] La producción industrial de ácido acrílico implica la oxidación catalítica parcial del propeno. [15] El propeno también es un intermedio en la oxidación selectiva de propano en un solo paso a ácido acrílico. [16] [17] [18] [19] En la industria y los talleres, el propeno se utiliza como combustible alternativo al acetileno en la soldadura y corte de oxicombustible , soldadura fuerte y calentamiento de metal con el fin de doblarlo. Se ha convertido en un estándar en BernzOmaticproductos y otros en sustitutos de MAPP, [20] ahora que el verdadero gas MAPP ya no está disponible.
Reacciones [ editar ]
El propeno se parece a otros alquenos en que sufre reacciones de adición con relativa facilidad a temperatura ambiente. La relativa debilidad de su doble enlace explica su tendencia a reaccionar con sustancias que pueden lograr esta transformación. Las reacciones de los alquenos incluyen: 1) polimerización , 2) oxidación , 3) halogenación e hidrohalogenación , 4) alquilación , 5) hidratación , 6) oligomerización y 7) hidroformilación .
Combustión [ editar ]
El propeno sufre reacciones de combustión de manera similar a otros alquenos . En presencia de oxígeno suficiente o en exceso, el propeno se quema para formar agua y dióxido de carbono .
- 2 C 3 H 6 + 9 O 2 → 6 CO 2 + 6 H 2 O
Cuando hay una cantidad insuficiente de oxígeno para una combustión completa, se produce una combustión incompleta que permite que se forme también monóxido de carbono y / o hollín ( carbono ).
- C 3 H 6 + 2 O 2 → 3 H 2 O + 2 C + CO
Seguridad ambiental [ editar ]
El propeno es un producto de la combustión de incendios forestales, humo de cigarrillos y gases de escape de vehículos de motor y aviones. Es una impureza en algunos gases de calefacción. Las concentraciones observadas han estado en el rango de 0.1 a 4.8 partes por billón ( ppb ) en el aire rural, 4-10.5 ppb en el aire urbano y 7-260 ppb en muestras de aire industrial. [7]
En los Estados Unidos y algunos países europeos se estableció un valor límite de 500 partes por millón ( ppm ) para la exposición ocupacional ( promedio ponderado en el tiempo de 8 horas ). Se considera un compuesto orgánico volátil (COV) y las emisiones están reguladas por muchos gobiernos, pero la Agencia de Protección Ambiental de EE. UU. (EPA) no lo enumera como un contaminante peligroso del aire según la Ley de Aire Limpio . Con una vida media relativamente corta, no se espera que se bioacumule. [7]
El propeno tiene una baja toxicidad aguda por inhalación. La inhalación del gas puede provocar efectos anestésicos y, en concentraciones muy elevadas, pérdida del conocimiento. Sin embargo, el límite de asfixia para humanos es aproximadamente 10 veces mayor (23%) que el nivel de inflamabilidad más bajo. [7]
Almacenamiento y manipulación [ editar ]
Dado que el propeno es volátil e inflamable, se deben tomar precauciones para evitar riesgos de incendio en la manipulación del gas. Si se carga propeno en cualquier equipo capaz de causar ignición, dicho equipo debe apagarse mientras se carga, descarga, conecta o desconecta. El propeno generalmente se almacena como líquido a presión, aunque también es posible almacenarlo de manera segura como gas a temperatura ambiente en recipientes aprobados. [21]
Farmacología [ editar ]
El propeno actúa como un sistema nervioso central depresor través alostérico agonismo del GABA A receptor. [ cita requerida ] La exposición excesiva puede resultar en sedación y amnesia , progresando al coma y la muerte en un mecanismo equivalente a la sobredosis de benzodiazepinas . La inhalación intencional también puede provocar la muerte por asfixia (muerte súbita por inhalación).
Ocurrencia en la naturaleza [ editar ]
El propeno se detecta en el medio interestelar mediante espectroscopía de microondas. [22] El 30 de septiembre de 2013, la NASA también anunció que la nave espacial Cassini, parte de la misión Cassini-Huygens , había descubierto pequeñas cantidades de propeno natural en la atmósfera de Titán utilizando espectroscopía. [23] [24]
Ver también [ editar ]
- Desastre de Los Alfaques
- Abuso de inhalantes
- 2014 explosiones de gas de Kaohsiung
- 2020 explosión de Houston
Referencias [ editar ]
- ^ "Materia principal". Nomenclatura de la química orgánica: Recomendaciones y nombres preferidos de la IUPAC 2013 (Libro azul) . Cambridge: La Real Sociedad de Química . 2014. p. 31. doi : 10.1039 / 9781849733069-FP001 . ISBN 978-0-85404-182-4.
- ^ "Propileno" .
- ^ Productos químicos dedicados, directos e inteligentes de base biológica
- ^ Duurzame bioplásticos op base van hernieuwbare grondstoffen
- ↑ Giovanni Maggini (17 de abril de 2013). "Economía de la tecnología: propileno a través de la deshidrogenación de propano, parte 3" . Slideshare.net . Consultado el 12 de noviembre de 2013 .
- ^ Diccionario de productos químicos industriales de Ashford, tercera edición, 2011, ISBN 978-0-9522674-3-0 , páginas 7766-9
- ^ a b c d "Evaluación de la seguridad del producto (PSA): propileno" . Dow Chemical Co. Archivado desde el original el 22 de junio de 2013 . Consultado el 11 de julio de 2011 .
- ^ Ghashghaee, Mohammad (2018). "Catalizadores heterogéneos para la conversión en fase gaseosa de etileno en olefinas superiores". Rev. Chem. Eng . 34 (5): 595–655. doi : 10.1515 / revce-2017-0003 . S2CID 103664623 .
- ^ Bancos, RL; Bailey, GC (1964). "Desproporción de olefinas. Un nuevo proceso catalítico". Investigación y desarrollo de productos de química industrial e ingeniería . 3 (3): 170-173. doi : 10.1021 / i360011a002 .
- ^ Lionel Delaude, Alfred F. Noels (2005). "Metátesis". Enciclopedia Kirk-Othmer de tecnología química . Weinheim: Wiley-VCH. doi : 10.1002 / 0471238961.metanoel.a01 . ISBN 978-0471238966.Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ^ Amghizar, Ismaël; Vandewalle, Laurien A .; Van Geem, Kevin M .; Marín, Guy B. (2017). "Nuevas tendencias en la producción de olefinas" . Ingeniería . 3 (2): 171-178. doi : 10.1016 / J.ENG.2017.02.006 .
- ↑ de Guzman, Doris (12 de octubre de 2012). "Bioenergías globales en biopropileno" . Blog de productos químicos verdes .
- ^ a b "Estudio de mercado: propileno (2ª edición), Ceresana, diciembre de 2014" . ceresana.com . Consultado el 3 de febrero de 2015 .
- ^ Budavari, Susan, ed. (1996). "8034. Propileno". The Merck Index, duodécima edición . Nueva Jersey: Merck & Co. págs. 1348-1349.
- ^ JGL, Fierro (Ed.) (2006). Óxidos metálicos, química y aplicaciones . Prensa CRC. págs. 414–455.CS1 maint: texto adicional: lista de autores ( enlace )
- ^ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; et al. (Marzo del 2014). "La red de reacción en la oxidación del propano sobre catalizadores de óxido MoVTeNb M1 de fase pura". Revista de catálisis . 311 : 369–385. doi : 10.1016 / j.jcat.2013.12.008 . hdl : 11858 / 00-001M-0000-0014-F434-5 .
- ^ Amakawa, Kazuhiko; Kolen'Ko, Yury V .; Villa, Alberto; et al. (7 de junio de 2013). "Multifuncionalidad de catalizadores de óxido cristalino MoV (TeNb) M1 en oxidación selectiva de propano y alcohol bencílico". Catálisis ACS . 3 (6): 1103-1113. doi : 10.1021 / cs400010q . hdl : 11858 / 00-001M-0000-000E-FA39-1 .
- ^ Hävecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; et al. (Enero de 2012). "Química de la superficie del óxido M1 MoVTeNb de fase pura durante la operación en la oxidación selectiva de propano a ácido acrílico". Revista de catálisis . 285 (1): 48–60. doi : 10.1016 / j.jcat.2011.09.012 . hdl : 11858 / 00-001M-0000-0012-1BEB-F .
- ^ Csepei, Lénárd-István (2011). Los estudios cinéticos de la oxidación de propano en Mo y catalizadores de óxido mixto basado V . págs. 3-24, 93. doi : 10.14279 / depositonce-2972 .
- ^ Por ejemplo, "MAPP-Pro"
- ^ Enciclopedia de tecnología química, cuarta edición, 1996, ISBN 0471-52689-4 (v.20), página 261
- ↑ Marcelino, N .; Cernicharo, J .; Agúndez, M .; et al. (10 de agosto de 2007). "Descubrimiento de propileno interestelar (CH2CHCH3): eslabones perdidos en química interestelar en fase gaseosa" . El diario astrofísico . PIO. 665 (2): L127 – L130. doi : 10.1086 / 521398 . S2CID 15832967 .
- ^ "La nave espacial encuentra propileno en la luna de Saturno, Titán" . UPI.com. 2013-09-30 . Consultado el 12 de noviembre de 2013 .
- ^ "Cassini encuentra ingrediente de plástico doméstico en la luna de Saturno" . Spacedaily.com . Consultado el 12 de noviembre de 2013 .