Multiplicidad (química)
En espectroscopia y química cuántica , la multiplicidad de un nivel de energía se define como 2S+1 , donde S es el momento angular de espín total . [1] [2] [3] Los estados con multiplicidad 1, 2, 3, 4, 5 se denominan respectivamente singletes , dobletes , tripletes , cuartetos y quintetos. [2]
En el estado fundamental de un átomo o molécula, los electrones no apareados suelen tener espín paralelo. En este caso la multiplicidad también es igual al número de electrones desapareados más uno. [4]
La multiplicidad suele ser igual al número de orientaciones posibles del espín total [3] en relación con el momento angular orbital total L y, por lo tanto, al número de niveles casi degenerados que difieren solo en su energía de interacción espín-órbita .
Por ejemplo, el estado fundamental del átomo de carbono es un estado 3P . El superíndice tres (leído como triplete ) indica que la multiplicidad 2S+1 = 3, por lo que el espín total S = 1. Este espín se debe a dos electrones desapareados , como resultado de la regla de Hund que favorece el llenado único de orbitales degenerados. . El triplete consta de tres estados con componentes de espín +1, 0 y -1 a lo largo de la dirección del momento angular orbital total, que también es 1 como lo indica la letra P. El número cuántico del momento angular total J puede variar de L+S = 2 a L–S = 0 en pasos enteros, de modo que J = 2, 1 o 0. [1] [2]
Sin embargo, la multiplicidad es igual al número de orientaciones de espín solo si S ≤ L. Cuando S > L solo hay 2L+1 orientaciones de momento angular total posibles, que van desde S+L hasta SL. [2] [3] El estado fundamental del átomo de nitrógeno es un estado 4 S, para el cual 2S + 1 = 4 en un estado de cuarteto , S = 3/2 debido a tres electrones desapareados. Para un estado S, L = 0, por lo que J solo puede ser 3/2 y solo hay un nivel aunque la multiplicidad sea 4.
La mayoría de las moléculas orgánicas estables tienen capas de electrones completas sin electrones desapareados y, por lo tanto, tienen estados fundamentales de singlete. Esto también es cierto para las moléculas inorgánicas que contienen solo elementos del grupo principal . Las excepciones importantes son el dioxígeno (O 2 ), así como el metileno (CH 2 ) y otros carbenos .
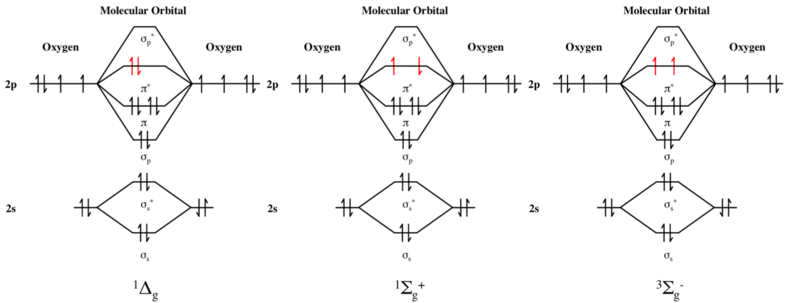
gramooxígeno singlete (segundo estado excitado), y 3 Σ-
gramo Oxígeno triplete (estado fundamental).