Ribosomal s6 quinasa
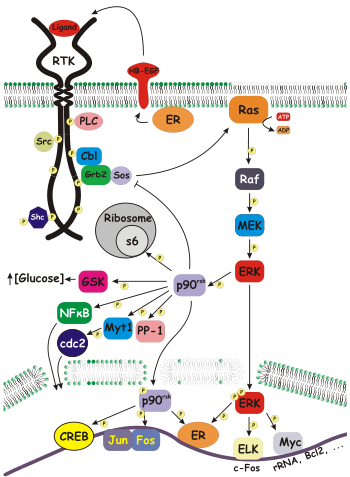
En biología molecular , la quinasa ribosomal s6 ( rsk ) es una familia de proteínas quinasas involucradas en la transducción de señales . Hay dos subfamilias de rsk, p90 rsk , también conocida como proteína quinasa-1 activada por MAPK (MAPKAP-K1), y p70 rsk , también conocida como quinasa S6-H1 o simplemente quinasa S6 . Hay tres variantes de p90 rsk en humanos, rsk 1-3. Las Rsk son serina/treonina quinasas y son activadas por la vía MAPK/ERK . Hay dos homólogos mamíferos conocidos de S6 Kinase: S6K1 yS6K2 .
Tanto p90 como p70 Rsk fosforilan la proteína ribosómica s6 , parte de la maquinaria de traducción, pero se han identificado varios otros sustratos, incluidas otras proteínas ribosómicas. Los sustratos citosólicos de p90 rsk incluyen proteína fosfatasa 1 ; glucógeno sintasa quinasa 3 (GSK3); L1 CAM , una molécula de adhesión de células neurales; Hijo de Sevenless , el factor de cambio de Ras ; y Myt1 , un inhibidor de cdc2 . [1]
La fosforilación RSK de SOS1 ( Hijo de Sevenless ) en Serines 1134 y 1161 crea un sitio de acoplamiento 14-3-3 . Esta interacción de fosfo SOS1 y 14-3-3 regula negativamente la vía Ras-MAPK . [2]
p90 rsk también regula los factores de transcripción, incluida la proteína de unión al elemento de respuesta cAMP (CREB); receptor de estrógeno -α (ERα); IκBα / NF-κB ; y c-Fos . [1]
p90 Rsk-2 se encuentra en Xp22.2 y contiene 22 exones . Las mutaciones en este gen se han asociado con el síndrome de Coffin-Lowry , una enfermedad caracterizada por un retraso psicomotor grave y otras anomalías del desarrollo. [4]
La principal característica distintiva entre p90 rsk y p70 rsk es que la familia de 90 kDa contiene dos dominios de quinasa no idénticos, mientras que la familia de 70 kDa contiene solo un dominio de quinasa.