| Estreptavidina | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Identificadores | |||||||
| Organismo | |||||||
| Símbolo | ? | ||||||
| UniProt | P22629 | ||||||
| |||||||
Estreptavidina / ˌ s t r ɛ p t æ v ɪ d ɪ n / es un 52,8 (tetrámero) kDa proteína purificada a partir de la bacteria Streptomyces avidinii . Los homo-tetrámeros de estreptavidina tienen una afinidad extraordinariamente alta por la biotina (también conocida como vitamina B7 o vitamina H). Con una constante de disociación (K d ) del orden de ≈10 −14 mol / L, [1]la unión de biotina a estreptavidina es una de las interacciones no covalentes más fuertes conocidas en la naturaleza. La estreptavidina se utiliza ampliamente en biología molecular y bionanotecnología debido a la resistencia del complejo estreptavidina-biotina a disolventes orgánicos, desnaturalizantes (p. Ej., Cloruro de guanidinio ), detergentes (p. Ej. SDS , Triton X-100 ), enzimas proteolíticas y temperaturas y pH extremos.
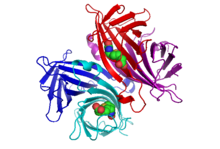
Estructura [ editar ]
La estructura cristalina de la estreptavidina con biotina unida fue informada por dos grupos en 1989. La estructura se resolvió usando difracción anómala de múltiples longitudes de onda por Hendrickson et al. [2] en la Universidad de Columbia y utilizando reemplazo isomorfo múltiple por Weber et al. [3] en el Departamento Central de Investigación y Desarrollo de EI DuPont. A septiembre de 2017, hay 171 estructuras depositadas en el Protein Data Bank . Ver este enlacepara obtener una lista completa. Los extremos N y C de la proteína de longitud completa de 159 residuos se procesan para dar una estreptavidina de "núcleo" más corta, generalmente compuesta por los residuos 13-139; la eliminación de los extremos N y C es necesaria para obtener la mayor afinidad de unión a biotina. La estructura secundaria de un monómero de estreptavidina se compone de ocho hebras β antiparalelas, que se pliegan para dar una estructura terciaria de barril β antiparalela . Una biotinaEl sitio de unión se encuentra en un extremo de cada barril β. Cuatro monómeros de estreptavidina idénticos (es decir, cuatro barriles β idénticos) se asocian para dar la estructura cuaternaria tetramérica de la estreptavidina. El sitio de unión de biotina en cada barril consiste en residuos del interior del barril, junto con un Trp120 conservado de una subunidad vecina. De esta manera, cada subunidad contribuye al sitio de unión en la subunidad vecina, por lo que el tetrámero también puede considerarse un dímero de dímeros funcionales.
Orígenes de la alta afinidad [ editar ]
Las numerosas estructuras cristalinas del complejo estreptavidina-biotina han arrojado luz sobre los orígenes de la notable afinidad. En primer lugar, existe una alta complementariedad de forma entre el bolsillo de unión y la biotina. En segundo lugar, existe una extensa red de enlaces de hidrógeno que se forman con la biotina cuando se encuentran en el sitio de unión. Hay ocho enlaces de hidrógenodirectamente a los residuos en el sitio de unión (la llamada "primera capa" del enlace de hidrógeno), que involucra los residuos Asn23, Tyr43, Ser27, Ser45, Asn49, Ser88, Thr90 y Asp128. También hay una 'segunda capa' de enlace de hidrógeno que involucra residuos que interactúan con los residuos de la primera capa. Sin embargo, la afinidad entre la estreptavidina y la biotina supera la que se podría predecir a partir de las interacciones de enlace de hidrógeno solas, lo que sugiere otro mecanismo que contribuye a la alta afinidad. [4] La bolsa de unión a biotina es hidrofóbica y hay numerosas fuerzas de van der Waals-contactos e interacciones hidrófobas mediados por la biotina cuando está en el bolsillo, lo que también se cree que explica la alta afinidad. En particular, el bolsillo está revestido con residuos de triptófano conservados. Por último, la unión de biotina se acompaña de la estabilización de un bucle flexible que conecta las cadenas β 3 y 4 (L3 / 4), que se cierra sobre la biotina unida, actuando como una 'tapa' sobre el bolsillo de unión y contribuyendo a la biotina extremadamente lenta. tasa de disociación.
La mayoría de los intentos de mutar la estreptavidina dan como resultado una menor afinidad de unión a biotina, lo que es de esperar en un sistema tan optimizado. Sin embargo, se encontró que un mutante de estreptavidina recientemente diseñado, llamado traptavidina, tenía una disociación de biotina diez veces más lenta, además de una mayor estabilidad térmica y mecánica. [5] Esta disminución de la tasa de disociación fue acompañada por una disminución del doble en la tasa de asociación.
La afinidad de unión a biotina puede verse afectada por el marcaje químico de la estreptavidina, como ocurre con los fluoróforos reactivos con amina . La flavidina es un mutante de estreptavidina sin cadenas laterales de lisina, que conserva buenas características de unión a biotina después de dicho marcaje con colorante fluorescente. [6]
Usos en biotecnología [ editar ]
Entre los usos más comunes de la estreptavidina se encuentran la purificación o detección de diversas biomoléculas. La fuerte interacción estreptavidina-biotina puede usarse para unir varias biomoléculas entre sí o sobre un soporte sólido. Se necesitan condiciones severas para romper la interacción estreptavidina-biotina, que a menudo desnaturaliza la proteína de interés que se está purificando. Sin embargo, se ha demostrado que una breve incubación en agua por encima de 70 ° C romperá reversiblemente la interacción (al menos para el ADN biotinilado) sin desnaturalizar la estreptavidina, permitiendo la reutilización del soporte sólido de estreptavidina. [7] Una aplicación adicional de la estreptavidina es para la purificación y detección de proteínas modificadas genéticamente con el péptido Strep-tag . La estreptavidina se usa ampliamente en la transferencia Westerne inmunoensayos conjugados con alguna molécula informadora, como peroxidasa de rábano picante . La estreptavidina también se ha utilizado en el campo en desarrollo de la nanobiotecnología , el uso de moléculas biológicas como proteínas o lípidos para crear dispositivos / estructuras a nanoescala . En este contexto, la estreptavidina puede usarse como un bloque de construcción para unir moléculas de ADN biotiniladas para crear andamios de nanotubos de carbono de pared única [8] o incluso poliedros de ADN complejos. [9] La estreptavidina tetramérica también se ha utilizado como un centro alrededor del cual se pueden organizar otras proteínas, ya sea por una etiqueta de afinidad como Strep-tag o AviTag o por fusión genética aSpyTag . [10] Fusion to SpyTag permitió la generación de ensamblajes con 8 o 20 subunidades de estreptavidina. Además de una sonda de fuerza molecular para estudios de microscopía de fuerza atómica , [11] también se han creado nuevos materiales como las redes cristalinas 3D [12] . La estreptavidina tiene un punto isoeléctrico (pI) ligeramente ácido de ~ 5, pero también está disponible comercialmente una forma recombinante de estreptavidina con un pI casi neutro.
- Inmunoterapia predefinida
La inmunoterapia pre-dirigida usa estreptavidina conjugada con un anticuerpo monoclonal contra antígenos específicos de células cancerosas, seguida de una inyección de biotina marcada radiactivamente para administrar la radiación solo a la célula cancerosa. Los obstáculos iniciales implican la saturación de los sitios de unión de biotina en la estreptavidina con biotina endógena en lugar de la biotina marcada radiactivamente inyectada, y un alto grado de exposición radiactiva en los riñones debido a las fuertes propiedades de adsorción celular de la estreptavidina. Actualmente se piensa que este alto nivel de unión a tipos de células adherentes, como plaquetas activadas y melanomas, es el resultado de la unión de integrinas mediada a través de la secuencia RYD en estreptavidina. [13]
Variantes con un número controlado de sitios de unión [ editar ]
- Monovalente frente a monomérico
La estreptavidina es un tetrámero y cada subunidad se une a la biotina con igual afinidad. La multivalencia es una ventaja en algunas aplicaciones, por ejemplo, cuando los efectos de la avidez mejoran la capacidad de las moléculas unidas a la estreptavidina para detectar células T específicas. [14] En otros casos, como el uso de estreptavidina para obtener imágenes de proteínas específicas en las células, la multivalencia puede perturbar la función de la proteína de interés. La estreptavidina monovalente es una forma recombinante de estreptavidina que es un tetrámero pero solo uno de los cuatro sitios de unión es funcional. Este único sitio de unión tiene una afinidad de 10-14 mol / L y no puede causar reticulación. [15] Las aplicaciones de la estreptavidina monovalente han incluido el seguimiento fluorescente de los receptores de la superficie celular., decorando origami de ADN y actuando como un puntero para identificar regiones específicas para microscopía crioelectrónica .
La estreptavidina monomérica es una forma recombinante de estreptavidina con mutaciones para romper el tetrámero en un monómero y mejorar la solubilidad de la subunidad aislada resultante. Las versiones de estreptavidina monomérica tienen una afinidad por la biotina de 10-7 mol / L 10-8 mol / L y, por lo tanto, no son ideales para aplicaciones de marcaje, pero son útiles para purificación, donde la reversibilidad es deseable. [16] [17]
- Bivalente
Se puede producir una estreptavidina con exactamente dos sitios de unión de biotina por tetrámero mezclando subunidades con y sin un sitio de unión de biotina funcional y purificación por cromatografía de intercambio iónico . Los sitios de unión funcionales aquí tienen la misma estabilidad de unión a biotina que la estreptavidina de tipo salvaje. La estreptavidina divalente con los dos sitios de unión de biotina juntos (cis-divalente) o separados (trans-divalente) se puede purificar por separado. [18]
- Trivalente
También se puede producir una estreptavidina con exactamente tres sitios de unión de biotina por tetrámero utilizando el mismo principio que para producir estreptavidinas divalentes. [19]
- Estreptavidinas de alta valencia
Se han obtenido estreptavidinas de valencia más alta utilizando la química de la conjugación de enlaces isopéptidos utilizando la tecnología SpyTag / SpyCatcher . [20] Esto implica tener un tetrámero de estreptavidina con tres sitios de unión de biotina y una estreptavidina muerta fusionada con SpyTag o SpyCatcher. Cuando los diferentes tetrámeros se mezclan, se produce un enlace covalente para permitir un mayor número de sitios de unión de biotina. Con este método se han creado seis y doce sitios de unión de biotina por molécula.
Comparación con la avidina [ editar ]
La estreptavidina no es la única proteína capaz de unirse a la biotina con alta afinidad. La avidina es la otra proteína de unión a biotina más notable. Originalmente aislada de la yema de huevo, la avidina solo tiene un 30% de identidad de secuencia con la estreptavidina, pero una estructura secundaria, terciaria y cuaternaria casi idéntica. La avidina tiene una mayor afinidad por la biotina (Kd ~ 10-15M) pero a diferencia de la estreptavidina, la avidina está glicosilada, cargada positivamente, tiene actividad pseudocatalítica (la avidina puede mejorar la hidrólisis alcalina de un enlace éster entre biotina y un grupo nitrofenilo) y tiene una mayor tendencia a la agregación. Por otro lado, la estreptavidina es el mejor aglutinante conjugado de biotina; la avidina tiene una afinidad de unión más baja que la estreptavidina cuando la biotina se conjuga con otra molécula, a pesar de que la avidina tiene mayor afinidad por la biotina libre no conjugada. Debido a que la estreptavidina carece de cualquier modificación de carbohidratos y tiene un pI casi neutro , tiene la ventaja de una unión inespecífica mucho menor que la de la avidina. Avidina desglicosilada (NeutrAvidin) es más comparable al tamaño, pI y unión inespecífica de estreptavidina.
Ver también [ editar ]
- Etiqueta de proteína
Referencias [ editar ]
- ^ Green NM (1975). "Avidin". Avances en la química de proteínas . 29 : 85-133. doi : 10.1016 / s0065-3233 (08) 60411-8 . PMID 237414 .
- ^ Hendrickson WA, Pähler A, Smith JL, Satow Y, Merritt EA, Phizackerley RP (abril de 1989). "Estructura cristalina de estreptavidina del núcleo determinada a partir de difracción anómala de múltiples longitudes de onda de radiación de sincrotrón" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 86 (7): 2190–4. doi : 10.1073 / pnas.86.7.2190 . PMC 286877 . PMID 2928324 .
- ^ Weber PC, Ohlendorf DH, Wendoloski JJ, Salemme FR (enero de 1989). "Orígenes estructurales de la unión de biotina de alta afinidad a estreptavidina". Ciencia . 243 (4887): 85–8. doi : 10.1126 / science.2911722 . PMID 2911722 .
- ^ DeChancie J, Houk KN (mayo de 2007). "Los orígenes de la unión proteína-ligando femtomolar: cooperatividad de enlace de hidrógeno y energéticas de desolvatación en el sitio de unión de biotina- (estreptococo) avidina" . Revista de la Sociedad Química Estadounidense . 129 (17): 5419–29. doi : 10.1021 / ja066950n . PMC 2527462 . PMID 17417839 .
- ^ Chivers CE, Crozat E, Chu C, Moy VT, Sherratt DJ, Howarth M (mayo de 2010). "Una variante de estreptavidina con disociación de biotina más lenta y mayor mecanoestabilidad" . Métodos de la naturaleza . 7 (5): 391–3. doi : 10.1038 / nmeth.1450 . PMC 2862113 . PMID 20383133 .
- ^ Jacobsen MT, Fairhead M, Fogelstrand P, Howarth M (agosto de 2017). "Paisajismo de amina para maximizar la fluorescencia proteína-colorante y la interacción proteína-ligando ultraestable" . Biología química celular . 24 (8): 1040–1047.e4. doi : 10.1016 / j.chembiol.2017.06.015 . PMC 5563079 . PMID 28757182 .
- ^ Holmberg A, Blomstergren A, Nord O, Lukacs M, Lundeberg J, Uhlén M (febrero de 2005). "La interacción biotina-estreptavidina se puede romper de forma reversible utilizando agua a temperaturas elevadas". Electroforesis . 26 (3): 501–10. doi : 10.1002 / elps.200410070 . PMID 15690449 .
- ^ Ostojic GN, Hersam MC (junio de 2012). "Montaje dirigido por biomoléculas de andamios de nanotubos de carbono de pared simple autoportantes, nanoporosos, conductores y luminiscentes". Pequeño . 8 (12): 1840–5. doi : 10.1002 / smll.201102536 . PMID 22461319 .
- ^ Zhang C, Tian C, Guo F, Liu Z, Jiang W, Mao C (abril de 2012). "Organización proteica tridimensional dirigida por ADN". Angewandte Chemie . 51 (14): 3382–5. doi : 10.1002 / anie.201108710 . PMID 22374892 .
- ^ Fairhead M, Veggiani G, Lever M, Yan J, Mesner D, Robinson CV, Dushek O, van der Merwe PA, Howarth M (septiembre de 2014). "Los concentradores SpyAvidin permiten un nanoensamblaje ortogonal preciso y ultraestable" . Revista de la Sociedad Química Estadounidense . 136 (35): 12355–63. doi : 10.1021 / ja505584f . PMC 4183622 . PMID 25111182 .
- ^ Kim M, Wang CC, Benedetti F, Marszalek PE (febrero de 2012). "Una sonda de fuerza a nanoescala para medir interacciones intermoleculares" . Angewandte Chemie . 51 (8): 1903–6. doi : 10.1002 / anie.201107210 . PMC 3279624 . PMID 22253141 .
- ^ Sinclair JC, Davies KM, Vénien-Bryan C, Noble ME (julio de 2011). "Generación de redes de proteínas mediante la fusión de proteínas con simetría rotacional coincidente". Nanotecnología de la naturaleza . 6 (9): 558–62. doi : 10.1038 / nnano.2011.122 . PMID 21804552 .
- ^ Alon R, Bayer EA, Wilchek M (agosto de 1992). "Las propiedades adhesivas celulares de la estreptavidina están mediadas por la exposición de un sitio RYD similar a RGD". Revista europea de biología celular . 58 (2): 271–9. PMID 1425765 .
- ^ Xu XN, Screaton GR (octubre de 2002). "Estudios basados en tetrámeros de MHC / péptido de la función de las células T". Revista de métodos inmunológicos . 268 (1): 21–8. doi : 10.1016 / S0022-1759 (02) 00196-5 . PMID 12213339 .
- ^ Howarth M, Chinnapen DJ, Gerrow K, Dorrestein PC, Grandy MR, Kelleher NL, El-Husseini A, Ting AY (abril de 2006). "Una estreptavidina monovalente con un único sitio de unión de biotina femtomolar" . Métodos de la naturaleza . 3 (4): 267–73. doi : 10.1038 / nmeth861 . PMC 2576293 . PMID 16554831 .
- ^ Wu SC, Wong SL (junio de 2005). "Ingeniería de estreptavidina monomérica soluble con capacidad de unión a biotina reversible" . La Revista de Química Biológica . 280 (24): 23225–31. doi : 10.1074 / jbc.M501733200 . PMID 15840576 .
- ^ Lim KH, Huang H, Pralle A, Park S (octubre de 2011). "Monómero y dímero de estreptavidina diseñados con estabilidad y función mejoradas". Bioquímica . 50 (40): 8682–91. doi : 10.1021 / bi2010366 . PMID 21892837 .
- ^ Fairhead M, Krndija D, Lowe ED, Howarth M (enero de 2014). "Emparejamiento plug-and-play a través de estreptavidinas divalentes definidas" . Revista de Biología Molecular . 426 (1): 199–214. doi : 10.1016 / j.jmb.2013.09.016 . PMC 4047826 . PMID 24056174 .
- ↑ Dubacheva, Galina V .; Araya-Callis, Carolina; Geert Volbeda, Anne; Fairhead, Michael; Codée, Jeroen; Howarth, Mark; Richter, Ralf P. (9 de marzo de 2017). "Control de la unión multivalente a través de la química de superficies: estudio modelo sobre estreptavidina" . Revista de la Sociedad Química Estadounidense . 139 (11): 4157–4167. doi : 10.1021 / jacs.7b00540 . PMC 5364436 . PMID 28234007 .
- ^ Fairhead, Michael; Veggiani, Gianluca; Palanca, Melissa; Yan, Jun; Mesner, Dejan; Robinson, Carol V .; Dushek, Omer; van der Merwe, P. Anton; Howarth, Mark (21 de agosto de 2014). "Los concentradores SpyAvidin permiten nanoensamblaje ortogonal preciso y ultraestable" . Revista de la Sociedad Química Estadounidense . 136 (35): 12355-12363. doi : 10.1021 / ja505584f . PMC 4183622 . PMID 25111182 .
Lectura adicional [ editar ]
- Hutchens TW, Porath JO (septiembre de 1987). "Reconocimiento de proteínas de ligandos inmovilizados: promoción de la adsorción selectiva" . Química clínica . 33 (9): 1502–8. PMID 3621554 .
- Chodosh LA, Buratowski S (2001). "Purificación de proteínas de unión a ADN utilizando sistemas de afinidad de biotina / estreptavidina". Protocolos actuales en la ciencia de las proteínas . 9.7.1–9.7.13. doi : 10.1002 / 0471140864.ps0907s12 . ISBN 978-0-471-14086-3.
- Zimmermann RM, Cox EC (febrero de 1994). "ADN que se extiende sobre superficies de oro funcionalizadas" . Investigación de ácidos nucleicos . 22 (3): 492–7. doi : 10.1093 / nar / 22.3.492 . PMC 523609 . PMID 8127690 .
Enlaces externos [ editar ]
- Entrada Swiss-Prot para el precursor de estreptavidina de Streptomyces avidinii
- Estreptavidina en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- Interacción de huevo-stremely útil Artículo de estructura de PDB bastante interesante en PDBe
Grupos que investigan y desarrollan estreptavidina o proteínas de la familia de las avidinas (orden alfabético)
- Laboratorio Howarth (Universidad de Oxford)
- Laboratorio Hytönen (Universidad de Tampere)
- Laboratorio Kulomaa (Universidad de Tampere)
- Laboratorio Livnah (Universidad Hebrea de Jerusalén)
- Park Lab (Universidad de Buffalo)
- Laboratorio Stenkamp (Universidad de Washington)
- Wong lab (Universidad de Calgary)