Ácido sulfénico
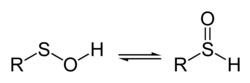
Un ácido sulfénico es un azufre orgánico con compuesto y oxoácido con la fórmula general R S O H . Es el primer miembro de la familia de los oxoácidos organosulfurados, que también incluyen ácidos sulfínicos y ácidos sulfónicos , R S O 2 H y R S O 3 H , respectivamente. El miembro base de la serie del ácido sulfénico con R = H es tioperóxido de hidrógeno .
Propiedades
A diferencia de los ácidos sulfínico y sulfónico, los ácidos sulfénicos simples, como el ácido metanosulfénico, CH 3 SOH, son muy reactivos y no pueden aislarse en solución. En la fase gaseosa, la vida útil del ácido metanosulfénico es de aproximadamente un minuto. Por espectroscopía de microondas ( espectroscopía rotacional ) se encontró que la estructura en fase gaseosa del ácido metanosulfénico es CH 3 –S – O – H. [1] Los ácidos sulfénicos pueden estabilizarse mediante efectos estéricos, que evitan que el ácido sulfénico se condense consigo mismo para formar tiosulfinatos , RS (O) SR, como la alicina del ajo . Mediante el uso de cristalografía de rayos X, se demostró que la estructura de dichos ácidos sulfénicos estabilizados es R – S – O – H. [2] [3] Se ha encontrado que el ácido sulfénico 1-tripticensulfénico, estable y estéricamente impedido, tiene un p K a de 12,5 y una energía de disociación del enlace O – H (bde) de 71,9 ± 0,3 kcal / mol, que puede ser comparado con ap K una de ≥14 y O-H BDE de ~ 88 kcal / mol para los (valencia) isoelectrónicos hidroperóxidos , R O O H . [4]
Formación y ocurrencia
En naturaleza
Los ácidos sulfénicos son producidos por la descomposición enzimática de aliína y compuestos relacionados después del daño tisular del ajo , la cebolla y otras plantas del género Allium . Ácido 1-Propenesulfenic, formado cuando las cebollas son corte, se reordena rápidamente por una segunda enzima, el factor sintasa lacrimógeno, dando syn -propanethial- S -óxido . [5] Se cree que el ácido 2-propenosulfénico, formado a partir de la alicina , es responsable de la potente actividad antioxidante del ajo. [6] Espectrometría de masas con una fuente de iones DARTse utilizaron para identificar el 2-propensulfénico formado cuando se corta o tritura el ajo y para demostrar que este ácido sulfénico tiene una vida útil de menos de un segundo. [7] Se propone que la actividad farmacológica de ciertos medicamentos, como omeprazol , esomeprazol , ticlopidina , clopidogrel y prasugrel, involucran intermedios de ácido sulfénico. [8] Se sugiere que la oxidación de los residuos de cisteína en la proteína a los ácidos sulfénicos de proteína correspondientes es importante en la transducción de señales mediada por redox . [9] [10]
Los ligandos basados en sulfenato se encuentran en el sitio activo de las nitrilo hidratasas . El grupo S - O se propone como el nucleófilo que ataca al nitrilo. [11]
En la cocina
El ácido sulfénico forma parte de la serie de reacciones químicas que se producen al cortar cebollas. Las glándulas lagrimales están irritadas por el producto final de las reacciones, sin-propanetial-S-óxido , lo que provoca desgarros. [12]
Química Orgánica
Los sulfóxidos pueden sufrir eliminación térmica a través de un mecanismo E i para producir alquenos y ácidos sulfénicos: [13] [14]
- RS (O) CH 2 CH 2 R ′ → RSOH + CH 2 = CHR ′
Otros compuestos de sulfenilo
El prefijo sulfenilo en la nomenclatura orgánica denota el grupo RS (R ≠ H). Un ejemplo es el cloruro de metanosulfenilo , CH 3 SCl. [15]
Los ésteres de sulfenato tienen la fórmula RSOR ′. Surgen por la reacción de cloruros de sulfenilo sobre alcoholes. [16] Los ésteres de sulfenato son productos intermedios en la transposición de Mislow-Evans de los sulfóxidos de alilo. [13] Las sulfenamidas tienen la fórmula RSNR ′ 2 .
Referencias
- ^ Penn RE, Bloque E, Revelle LK (1978). "Ácido metanosulfénico". Revista de la Sociedad Química Estadounidense . 100 (11): 3622–3624. doi : 10.1021 / ja00479a068 .
- ^ Ir a K, Holler M, Okazaki R (1997). "Síntesis, estructura y reacciones de un ácido sulfénico que lleva un nuevo sustituyente tipo cuenco: la primera síntesis de un ácido sulfénico estable por oxidación directa de un tiol". Revista de la Sociedad Química Estadounidense . 119 (6): 1460-1461. doi : 10.1021 / ja962994s .
- ^ Ishii A, Komiya K, Nakayama J (1996). "Síntesis de un ácido sulfénico estable por oxidación de un tiol estéricamente impedido (tiofenotripticeno-8-tiol) 1 y su caracterización". Revista de la Sociedad Química Estadounidense . 118 (50): 12836–12837. doi : 10.1021 / ja962995k .
- ^ McGrath AJ, Garrett GE, Valgimigli L, Pratt DA (2010). "La química redox de los ácidos sulfénicos". Revista de la Sociedad Química Estadounidense . 132 (47): 16759–16761. doi : 10.1021 / ja1083046 . PMID 21049943 .
- ^ Bloque, E. (2010). Ajo y otros alliums: el saber y la ciencia . Real Sociedad de Química. ISBN 978-0-85404-190-9.
- ^ Vaidya V, Ingold KU, Pratt DA (2009). "Ajo: fuente de los últimos antioxidantes - ácidos sulfénicos". Angewandte Chemie International Edition . 48 (1): 157–60. doi : 10.1002 / anie.200804560 . PMID 19040240 .
- ^ Bloque E, Dane AJ, Thomas S, Cody RB (2010). "Aplicaciones del análisis directo en tiempo real-espectrometría de masas (DART-MS) en la química del allium . Ácidos 2-propensulfénico y 2-propenesulfínico, dialil trisulfano S -óxido y otros compuestos de azufre reactivos de ajo machacado y otros alios". Revista de Química Agrícola y Alimentaria . 58 (8): 4617–4625. doi : 10.1021 / jf1000106 . PMID 20225897 .
- ^ Mansuy D, Dansette PM (2011). "Ácidos sulfénicos como intermediarios reactivos en el metabolismo xenobiótico" . Archivos de Bioquímica y Biofísica . 507 (1): 174-185. doi : 10.1016 / j.abb.2010.09.015 . PMID 20869346 .
- ^ Kettenhofen, Nueva Jersey, Wood, MJ (2010). "Formación, reactividad y detección de ácidos proteicos sulfénicos" . Chem. Res. Toxicol . 23 (11): 1633–1646. doi : 10.1021 / tx100237w . PMC 2990351 . PMID 20845928 . CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Gupta, Vinayak; Kate S. Carroll (febrero de 2014). "Química del ácido sulfénico, detección y vida celular" . Biochimica et Biophysica Acta (BBA) - Temas generales . 1840 (2): 847–875. doi : 10.1016 / j.bbagen.2013.05.040 . PMC 4184475 . PMID 23748139 .
- ^ Harrop, Todd C .; Mascharak, Pradip K. (2004). "Centros Fe (III) y Co (III) con coordinación de nitrógeno carboxamido y azufre modificado: lecciones aprendidas de la nitrilo hidratasa". Cuentas de Investigación Química . 37 (4): 253–260. doi : 10.1021 / ar0301532 . PMID 15096062 .
- ^ "¿Por qué picar una cebolla te hace llorar?" . Misterios cotidianos . La Biblioteca del Congreso . Consultado el 1 de abril de 2019 .
- ^ a b Braverman, S., "Reordenamientos que involucran ácidos sulfénicos y sus derivados", en Ácidos sulfénicos y derivados, 1990, John Wiley & Sons. doi : 10.1002 / 9780470772287.ch8
- ^ Michael Carrasco, Robert J. Jones, Scott Kamel, H. Rapoport, Thien Truong (1992). "Éster metílico de N- (benciloxicarbonil) -L-vinilglicina". Síntesis orgánicas . 70 : 29. doi : 10.15227 / orgsyn.070.0029 .CS1 maint: varios nombres: lista de autores ( enlace )
- ^ IUPAC , Compendio de terminología química , 2ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) " grupos sulfenilo ". doi : 10.1351 / goldbook.S06098
- ^ Petrovic, Goran; Saicic, Radomir N .; Cekovic, Zivorad (2005). "Fenilsulfenilación de átomos de carbono no activados por fotólisis de alquilbencenosulfenados: preparación de 2-feniltio-5-heptanol" . Síntesis orgánicas . 81 : 244. doi : 10.15227 / orgsyn.081.0244 .
- Compuestos orgánicos de azufre