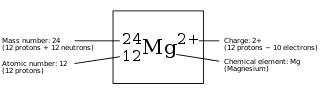
Símbolo químico
Los símbolos químicos son las abreviaturas utilizadas en química para elementos químicos , grupos funcionales y compuestos químicos. Los símbolos de elementos para elementos químicos normalmente consisten en una o dos letras del alfabeto latino y se escriben con la primera letra en mayúscula. En chino , cada elemento químico tiene un carácter dedicado , generalmente creado para este propósito (consulte Elementos químicos en los idiomas de Asia oriental ). Sin embargo, también se utilizan símbolos latinos, especialmente en fórmulas.
Los símbolos anteriores de los elementos químicos provienen del vocabulario clásico latino y griego . Para algunos elementos, esto se debe a que el material se conocía en la antigüedad, mientras que para otros, el nombre es una invención más reciente. Por ejemplo, Pb es el símbolo del plomo ( plumbum en latín); Hg es el símbolo del mercurio ( hydrargyrum en griego); y es el símbolo del helio (un nuevo nombre latino ) porque el helio no se conocía en la época romana antigua . Algunos símbolos provienen de otras fuentes, como W para tungsteno ( Wolfram en alemán) que no se conocía en la época romana.
Se puede asignar un símbolo temporal de tres letras a un elemento recién sintetizado (o aún no sintetizado). Por ejemplo, "Uno" era el símbolo temporal de hassium (elemento 108) que tenía el nombre temporal de unniloctium , basado en los dígitos de su número atómico. También hay algunos símbolos históricos que ya no se utilizan oficialmente.
Además de las letras del elemento en sí, se pueden agregar detalles adicionales al símbolo como superíndices o subíndices de un isótopo particular , estado de ionización u oxidación , u otro detalle atómico. [1] Algunos isótopos tienen sus propios símbolos específicos en lugar de solo un detalle isotópico agregado a su símbolo de elemento.
Los subíndices o superíndices adjuntos que especifican un nucleido o molécula tienen los siguientes significados y posiciones:
- El número de nucleón (número de masa ) se muestra en la posición de superíndice de la izquierda (por ejemplo, 14 N). Este número define el isótopo específico. También se pueden usar aquí varias letras, como "m" y "f" para indicar un isómero nuclear (por ejemplo, 99m Tc ). Alternativamente, el número aquí puede representar un estado de giro específico (por ejemplo, 1 O 2 ). Estos detalles se pueden omitir si no son relevantes en un contexto determinado.
- El número de protón (número atómico ) puede indicarse en la posición del subíndice de la izquierda (por ejemplo, 64 Gd). El número atómico es redundante para el elemento químico, pero a veces se usa para enfatizar el cambio de número de nucleones en una reacción nuclear.
- Si es necesario, se puede indicar un estado de ionización o un estado excitado en la posición de superíndice de la derecha (por ejemplo, estado de ionización Ca 2+ ).
- El número de átomos de un elemento en una molécula o compuesto químico se muestra en la posición del subíndice de la derecha (p. Ej., N 2 o Fe 2 O 3 ). Si este número es uno, normalmente se omite; el número uno se entiende implícitamente si no se especifica.
- Un radical se indica con un punto en el lado derecho (por ejemplo, Cl • para un átomo de cloro neutro). Esto a menudo se omite a menos que sea relevante para un determinado contexto porque ya es deducible de la carga y el número atómico, como ocurre generalmente con los electrones de valencia no enlazados en estructuras esqueléticas .
Muchos grupos funcionales también tienen su propio símbolo químico, por ejemplo, Ph para el grupo fenilo y Me para el grupo metilo .
Aquí se incluye una lista de signos y símbolos actuales, fechados, así como propuestos e históricos, con su significado . También se da el número atómico de cada elemento , el peso atómico o la masa atómica del isótopo más estable , los números de grupo y período en la tabla periódica y la etimología del símbolo.
Los pictogramas de peligro son otro tipo de símbolos utilizados en química.
Símbolos de elementos químicos
| Z [I] | Símbolo | Nombre | Origen del nombre [2] [3] | Grupo | Período | Peso atómico [4] [5] ( u (±) ) |
|---|---|---|---|---|---|---|
| 1 | H | Hidrógeno | Elementos griegos hidrógeno y gen , que significa ' formación de agua ' | 1 | 1 | 1,008 [II] [III] [IV] [V] |
| 2 | Él | Helio | Griego hḗlios , ' sol ' | 18 | 1 | 4.002602 (2) [II] [IV] |
| 3 | Li | Litio | Líthos griego , ' piedra ' | 1 | 2 | 6,94 [II] [III] [IV] [VI] [V] |
| 4 | Ser | Berilio | berilo , un mineral (en última instancia, del nombre de Belur en el sur de la India) | 2 | 2 | 9.0121831 (5) |
| 5 | B | Boro | bórax , un mineral (del árabe bawraq ) | 13 | 2 | 10,81 [II] [III] [IV] [V] |
| 6 | C | Carbón | Latín carbo , ' carbón ' | 14 | 2 | 12.011 [II] [IV] [V] |
| 7 | norte | Nitrógeno | Nítron griego y -gen , que significa ' formador de niter ' | 15 | 2 | 14.007 [II] [IV] [V] |
| 8 | O | Oxígeno | Oxy- y -gen griego , que significa ' formador de ácido ' | dieciséis | 2 | 15.999 [II] [IV] [V] |
| 9 | F | Flúor | Latín fluere , 'fluir' | 17 | 2 | 18.998403163 (6) |
| 10 | Nordeste | Neón | Griego néon , 'nuevo' | 18 | 2 | 20.1797 (6) [II] [III] |
| 11 | N / A | Sodio | Soda inglesa (el símbolo Na se deriva del nuevo latín natrium , acuñado del alemán Natron , ' natron ') | 1 | 3 | 22.98976928 (2) |
| 12 | Mg | Magnesio | Magnesia , un distrito del este de Tesalia en Grecia | 2 | 3 | 24.305 [V] |
| 13 | Alabama | Aluminio | alúmina , del latín alumen (gen. exalumnos ), 'sal amarga, alumbre ' | 13 | 3 | 26,9815384 (3) |
| 14 | Si | Silicio | Silex latino , ' pedernal ' (originalmente silicio ) | 14 | 3 | 28.085 [IV] [V] |
| 15 | PAG | Fósforo | Phōsphóros griego , 'portador de luz' | 15 | 3 | 30.973761998 (5) |
| dieciséis | S | Azufre | Azufre latino , 'azufre' | dieciséis | 3 | 32.06 [II] [IV] [V] |
| 17 | Cl | Cloro | Chlōrós griego , 'amarillo verdoso' | 17 | 3 | 35.45 [II] [III] [IV] [V] |
| 18 | Arkansas | Argón | Griego argós , 'inactivo' (debido a su inercia ) | 18 | 3 | 39,948 [II] [IV] [V] |
| 19 | K | Potasio | Nuevo latín potassa , ' potasa ' (el símbolo K se deriva del latín kalium ) | 1 | 4 | 39.0983 (1) |
| 20 | California | Calcio | Calx latino , ' lima ' | 2 | 4 | 40.078 (4) [II] |
| 21 | Carolina del Sur | Escandio | Latin Scandia , ' Escandinavia ' | 3 | 4 | 44,955908 (5) |
| 22 | Ti | Titanio | Titanes , los hijos de la diosa Tierra de la mitología griega | 4 | 4 | 47.867 (1) |
| 23 | V | Vanadio | Vanadis , un nombre nórdico antiguo para la diosa escandinava Freyja | 5 | 4 | 50,9415 (1) |
| 24 | Cr | Cromo | Chróma griego , ' color ' | 6 | 4 | 51.9961 (6) |
| 25 | Minnesota | Manganeso | corrompido de magnesia negra ; ver magnesio | 7 | 4 | 54,938043 (2) |
| 26 | Fe | Planchar | Palabra inglesa (el símbolo Fe se deriva del latín ferrum ) | 8 | 4 | 55.845 (2) |
| 27 | Co | Cobalto | German Kobold , ' duende ' | 9 | 4 | 58.933194 (3) |
| 28 | Ni | Níquel | Nickel, un pícaro sprite de la mitología minera alemana | 10 | 4 | 58.6934 (4) |
| 29 | Cu | Cobre | Palabra inglesa, del latín cuprum , del griego antiguo Kýpros ' Chipre ' | 11 | 4 | 63.546 (3) [IV] |
| 30 | Zn | Zinc | Muy probablemente del alemán Zinke , 'prong' o 'tooth', aunque algunos sugieren que el persa cantó , 'piedra' | 12 | 4 | 65,38 (2) |
| 31 | Georgia | Galio | Latin Gallia , ' Francia ' | 13 | 4 | 69.723 (1) |
| 32 | Ge | Germanio | Latin Germania , ' Alemania ' | 14 | 4 | 72.630 (8) |
| 33 | Como | Arsénico | Arsénico francés , del griego arsenikón 'arsénico amarillo' (influenciado por arsenikós , 'masculino' o 'viril'), de una palabra errante de Asia occidental en última instancia del antiguo iraní * zarniya-ka , 'dorado' | 15 | 4 | 74,921595 (6) |
| 34 | Se | Selenio | Griego selḗnē , ' luna ' | dieciséis | 4 | 78,971 (8) [IV] |
| 35 | Br | Bromo | Brômos griego , 'hedor' | 17 | 4 | 79.904 [V] |
| 36 | Kr | Criptón | Kryptós griego , 'oculto' | 18 | 4 | 83.798 (2) [II] [III] |
| 37 | Rb | Rubidio | Latín rubidus , 'rojo profundo' | 1 | 5 | 85.4678 (3) [II] |
| 38 | Sr | Estroncio | Strontian , un pueblo de Escocia | 2 | 5 | 87,62 (1) [II] [IV] |
| 39 | Y | Itrio | Ytterby , un pueblo de Suecia | 3 | 5 | 88.90584 (1) |
| 40 | Zr | Circonio | circón , un mineral | 4 | 5 | 91.224 (2) [II] |
| 41 | Nótese bien | Niobio | Niobe , hija del rey Tántalo de la mitología griega | 5 | 5 | 92.90637 (1) |
| 42 | Mes | Molibdeno | Griego molýbdaina , 'trozo de plomo ', de mólybdos , 'plomo' | 6 | 5 | 95,95 (1) [II] |
| 43 | Tc | Tecnecio | Griego tekhnētós , 'artificial' | 7 | 5 | [97] [VII] |
| 44 | Ru | Rutenio | Nueva Rutenia Latina , ' Rusia ' | 8 | 5 | 101.07 (2) [II] |
| 45 | Rh | Rodio | Rhodóeis griego , ' color de rosa ', de rhódon , ' rosa ' | 9 | 5 | 102.90549 (2) |
| 46 | Pd | Paladio | el asteroide Pallas , considerado un planeta en ese momento | 10 | 5 | 106,42 (1) [II] |
| 47 | Ag | Plata | Palabra inglesa (el símbolo deriva del latín argentum ) | 11 | 5 | 107.8682 (2) [II] |
| 48 | CD | Cadmio | Nueva cadmia latina , del rey Kadmos | 12 | 5 | 112.414 (4) [II] |
| 49 | En | Indio | América indicum , ' índigo ' (color que se encuentra en su espectro) | 13 | 5 | 114,818 (1) |
| 50 | Sn | Estaño | Palabra inglesa (el símbolo deriva del latín stannum ) | 14 | 5 | 118.710 (7) [II] |
| 51 | Sb | Antimonio | América antimonio , cuyo origen es incierto: etimologías populares sugieren que se deriva del griego ANTI ( 'contra') + Mónos ( 'solo'), o el francés antiguo anti- Moine , 'pesadilla de Monk', pero podría plausiblemente ser de o relacionado con el árabe ʾiṯmid , 'antimonio', reformateado como palabra latina. (El símbolo deriva del latín stibium ' stibnite '). | 15 | 5 | 121.760 (1) [II] |
| 52 | Te | Telurio | Latín tellus , 'el suelo, la tierra' | dieciséis | 5 | 127,60 (3) [II] |
| 53 | I | Yodo | Yodo francés , del griego ioeidḗs , 'violeta' | 17 | 5 | 126.90447 (3) |
| 54 | Xe | Xenón | Xénon griego , forma neutra de xénos 'extraño' | 18 | 5 | 131.293 (6) [II] [III] |
| 55 | Cs | Cesio | Latín caesius , 'celeste' | 1 | 6 | 132.90545196 (6) |
| 56 | Licenciado en Letras | Bario | Barys griegos , 'pesado' | 2 | 6 | 137,327 (7) |
| 57 | La | Lantano | Griego lanthánein , 'mentir escondido' | 6 | 138.90547 (7) [II] | |
| 58 | Ce | Cerio | el planeta enano Ceres , considerado un planeta en ese momento | 6 | 140.116 (1) [II] | |
| 59 | Pr | Praseodimio | Prásios dídymos griego , 'gemelo verde' | 6 | 140.90766 (1) | |
| 60 | Dakota del Norte | Neodimio | Griego néos dídymos , 'nuevo gemelo' | 6 | 144.242 (3) [II] | |
| 61 | Pm | Prometeo | Prometeo de la mitología griega | 6 | [145] [VII] | |
| 62 | Sm | Samario | samarskita , un mineral que lleva el nombre del coronel Vasili Samarsky-Bykhovets , funcionario de la mina rusa | 6 | 150,36 (2) [II] | |
| 63 | UE | Europio | Europa | 6 | 151,964 (1) [II] | |
| 64 | Di-s | Gadolinio | gadolinita , un mineral que lleva el nombre de Johan Gadolin , químico, físico y mineralogista finlandés | 6 | 157.25 (3) [II] | |
| sesenta y cinco | Tuberculosis | Terbio | Ytterby , un pueblo de Suecia | 6 | 158,925354 (8) | |
| 66 | Dy | Disprosio | Disprósitos griegos , 'difícil de conseguir' | 6 | 162.500 (1) [II] | |
| 67 | Ho | Holmio | New Latin Holmia , ' Estocolmo ' | 6 | 164,930328 (7) | |
| 68 | Er | Erbio | Ytterby , un pueblo de Suecia | 6 | 167.259 (3) [II] | |
| 69 | Tm | Tulio | Thule , el nombre antiguo de una ubicación norteña poco clara | 6 | 168,934218 (6) | |
| 70 | Yb | Iterbio | Ytterby , un pueblo de Suecia | 6 | 173.045 (10) [II] | |
| 71 | Lu | Lutecio | Latin Lutetia , ' Paris ' | 3 | 6 | 174,9668 (1) [II] |
| 72 | Hf | Hafnio | New Latin Hafnia , ' Copenhagen ' (del danés havn ) | 4 | 6 | 178,49 (2) |
| 73 | Ejército de reserva | Tantalio | Rey Tántalo , padre de Niobe de la mitología griega | 5 | 6 | 180,94788 (2) |
| 74 | W | Tungsteno | Sueco tung sten , 'piedra pesada' (el símbolo es de wolfram , el antiguo nombre del mineral de tungsteno wolframita ) | 6 | 6 | 183,84 (1) |
| 75 | Re | Renio | Latín Rhenus , ' el Rin ' | 7 | 6 | 186.207 (1) |
| 76 | Os | Osmio | Osmḗ griego , ' olor ' | 8 | 6 | 190.23 (3) [II] |
| 77 | Ir | Iridio | Iris , la diosa griega del arco iris | 9 | 6 | 192.217 (2) |
| 78 | Pt | Platino | Platina española , 'pequeña plata', de plata 'plata' | 10 | 6 | 195.084 (9) |
| 79 | Au | Oro | Palabra inglesa (el símbolo deriva del latín aurum ) | 11 | 6 | 196,966570 (4) |
| 80 | Hg | Mercurio | Mercurio , dios romano del comercio, la comunicación y la suerte, conocido por su velocidad y movilidad (el símbolo proviene del nombre latino del elemento hydrargyrum , derivado del griego hydrárgyros , 'agua- plata ') | 12 | 6 | 200.592 (3) |
| 81 | Tl | Talio | Thallós griego , 'brote verde o ramita' | 13 | 6 | 204,38 [V] |
| 82 | Pb | Dirigir | Palabra inglesa (el símbolo deriva del latín plumbum ) | 14 | 6 | 207.2 (1) [II] [IV] |
| 83 | Bi | Bismuto | Wismut alemán , de weiß Masse 'masa blanca', a menos que del árabe | 15 | 6 | 208,98040 (1) [VII] |
| 84 | Correos | Polonio | Latin Polonia , ' Polonia ' (el país de origen de Marie Curie ) | dieciséis | 6 | [209] [VII] |
| 85 | A | Astatine | Ástatos griego , 'inestable' | 17 | 6 | [210] [VII] |
| 86 | Rn | Radón | radio | 18 | 6 | [222] [VII] |
| 87 | P. | Francio | Francia | 1 | 7 | [223] [VII] |
| 88 | Real academia de bellas artes | Radio | Francés radio , del latín radio , ' rayo ' | 2 | 7 | [226] [VII] |
| 89 | C.A | Actinio | Griego aktís , 'ray' | 7 | [227] [VII] | |
| 90 | Th | Torio | Thor , el dios escandinavo del trueno | 7 | 232.0377 (4) [VII] [II] | |
| 91 | Pensilvania | Protactinio | proto- (del griego prôtos , 'primero, antes') + actinio , que se produce a través de la desintegración radiactiva del protactinio | 7 | 231.03588 (1) [VII] | |
| 92 | U | Uranio | Urano , el séptimo planeta del Sistema Solar | 7 | 238.02891 (3) [VII] | |
| 93 | Notario público | Neptunio | Neptuno , el octavo planeta del Sistema Solar | 7 | [237] [VII] | |
| 94 | Pu | Plutonio | el planeta enano Plutón , considerado el noveno planeta del Sistema Solar en ese momento | 7 | [244] [VII] | |
| 95 | Soy | Americio | Las Américas , como el elemento se sintetizó por primera vez en el continente, por analogía con el europio | 7 | [243] [VII] | |
| 96 | Cm | Curio | Pierre Curie y Marie Curie , físicos y químicos franceses | 7 | [247] [VII] | |
| 97 | Bk | Berkelio | Berkeley , California, donde el elemento se sintetizó por primera vez, por analogía con el terbio. | 7 | [247] [VII] | |
| 98 | Cf | Californio | California , donde el elemento se sintetizó por primera vez | 7 | [251] [VII] | |
| 99 | Es | Einstenio | Albert Einstein , físico alemán | 7 | [252] [VII] | |
| 100 | Fm | Fermio | Enrico Fermi , físico italiano | 7 | [257] [VII] | |
| 101 | Maryland | Mendelevio | Dmitri Mendeleev , químico e inventor ruso que propuso la tabla periódica | 7 | [258] [VII] | |
| 102 | No | Nobelio | Alfred Nobel , químico e ingeniero sueco | 7 | [259] [VII] | |
| 103 | Lr | Lawrencium | Ernest O. Lawrence , físico estadounidense | 3 | 7 | [266] [VII] |
| 104 | Rf | Rutherfordio | Ernest Rutherford , químico y físico británico | 4 | 7 | [267] [VII] |
| 105 | Db | Dubnium | Dubna , Rusia, donde el Instituto Conjunto de Investigación Nuclear se encuentra | 5 | 7 | [268] [VII] |
| 106 | Sg | Seaborgio | Glenn T. Seaborg , químico estadounidense | 6 | 7 | [269] [VII] |
| 107 | Bh | Bohrium | Niels Bohr , físico danés | 7 | 7 | [270] [VII] |
| 108 | Hs | Hassium | New Latin Hassia , ' Hesse ' (un estado en Alemania) | 8 | 7 | [270] [VII] |
| 109 | Monte | Meitnerio | Lise Meitner , física austriaca | 9 | 7 | [278] [VII] |
| 110 | Ds | Darmstadtium | Darmstadt , Alemania, donde el elemento se sintetizó por primera vez | 10 | 7 | [281] [VII] |
| 111 | Rg | Roentgenio | Wilhelm Conrad Röntgen , físico alemán | 11 | 7 | [282] [VII] |
| 112 | Cn | Copérnico | Nicolaus Copernicus , astrónomo polaco | 12 | 7 | [285] [VII] |
| 113 | Nueva Hampshire | Nihonium | Nihon japonés , ' Japón ' (donde el elemento se sintetizó por primera vez) | 13 | 7 | [286] [VII] |
| 114 | Florida | Flerovio | Laboratorio de Reacciones Nucleares Flerov , parte del JINR , donde se sintetizó el elemento; sí mismo el nombre de Georgy Flyorov , físico ruso | 14 | 7 | [289] [VII] |
| 115 | Mc | Moscovium | Óblast de Moscú , Rusia, donde se sintetizó por primera vez el elemento | 15 | 7 | [290] [VII] |
| 116 | Lv | Livermorium | Laboratorio Nacional Lawrence Livermore en Livermore, California , que colaboró con JINR en su síntesis | dieciséis | 7 | [293] [VII] |
| 117 | Ts | Tennessine | Tennessee , Estados Unidos | 17 | 7 | [294] [VII] |
| 118 | Og | Oganesson | Yuri Oganessian , físico ruso | 18 | 7 | [294] [VII] |
Notas
- ^ Z es el símbolo estándar para el número atómico
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al La composición isotópica de este elemento varía en algunos especímenes geológicos , y la variación puede exceder la incertidumbre indicada en la tabla.
- ^ a b c d e f g La composición isotópica del elemento puede variar en los materiales comerciales, lo que puede hacer que el peso atómico se desvíe significativamente del valor dado.
- ^ a b c d e f g h i j k l m n o La composición isotópica varía en el material terrestre de tal manera que no se puede dar un peso atómico más preciso.
- ^ a b c d e f g h i j k l m El valor indicado es el valor de peso atómico convencional adecuado para el comercio y el comercio. El valor real puede diferir dependiendo de la composición isotópica de la muestra. Desde 2009, IUPAC proporciona los valores estándar de peso atómico para estos elementos utilizando la notación de intervalo. Los pesos atómicos estándar correspondientes son:
- Hidrógeno: [1.00784, 1.00811]
- Litio: [6,938, 6,997]
- Boro: [10.806, 10.821]
- Carbono: [12.0096, 12.0116]
- Nitrógeno: [14.00643, 14.00728]
- Oxígeno: [15.99903, 15.99977]
- Magnesio: [24.304, 24.307]
- Silicio: [28.084, 28.086]
- Azufre: [32.059, 32.076]
- Cloro: [35,446, 35,457]
- Argón: [39,792, 39,963]
- Bromo: [79.901, 79.907]
- Talio: [204.382, 204.385]
- ^ El peso atómico del litio comercial puede variar entre 6,939 y 6,996; es necesario analizar el material específico para encontrar un valor más preciso.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al El elemento no tiene ningún nucleido estable y un valor entre paréntesis, por ejemplo, [209], indica el número másico del isótopo de vida más larga del elemento. Sin embargo, cuatro de estos elementos, bismuto, torio, protactinio y uranio, tienen composiciones isotópicas terrestres características y, por lo tanto, se dan sus pesos atómicos estándar.
Los átomos de antimateria se indican con una barra sobre el símbolo de su contraparte de materia, por lo que, por ejemplo, H es el símbolo del antihidrógeno .
Símbolos y nombres que no se utilizan actualmente
Esta sección necesita citas adicionales para su verificación . ( mayo de 2018 ) |
La siguiente es una lista de símbolos y nombres utilizados o sugeridos anteriormente para elementos, incluidos símbolos para nombres de marcadores de posición y nombres dados por reclamantes desacreditados para el descubrimiento.
| Símbolo | Nombre | Número atómico | Notas | ¿Por qué no se usa? | Refs |
|---|---|---|---|---|---|
| A | Argón | 18 | A utilizado para Argón hasta 1957. El símbolo actual es Ar . | [nb 1] | [6] |
| Ab | Alabamina | 85 | Reclamación desacreditada de descubrimiento de astato . | [nb 2] | [7] [8] |
| Anuncio | Aldebaranio | 70 | Antiguo nombre de iterbio . | [nb 2] | |
| Ah | Anglohelvetium | 85 | Reclamación desacreditada de descubrimiento de astato . | [nb 2] | [9] |
| Alaska | Alcalinio | 87 | Reclamación desacreditada de descubrimiento de francio . | [nb 2] | [7] |
| Soy | Alabamina | 85 | Reclamación desacreditada de descubrimiento de astato . El símbolo ahora se usa para americio . | [nb 2] | [7] [8] |
| Un | Atenio | 99 | Nombre propuesto para el einstenio . | [nb 3] | |
| Ao | Ausonio | 93 | Reclamación desacreditada del descubrimiento de neptunio . | [nb 2] | [7] |
| A | Austriacum | 84 | Reclamación desacreditada del descubrimiento de polonio . El símbolo ahora se usa para astato . | [nb 2] | |
| Arizona | Ázoe | 7 | Antiguo nombre del nitrógeno . | [nb 1] | |
| Bo | Bohemio | 93 | Reclamación desacreditada del descubrimiento de neptunio . | [nb 2] | |
| Bo | Boro | 5 | Símbolo actual es B . | [nb 1] | |
| Bv | Brevium | 91 | Antiguo nombre de protactinio . | [nb 1] | |
| Bz | Berzelium | 90 | Baskerville creyó erróneamente que el berzelium era un elemento nuevo. En realidad era torio . | [9] | |
| Cb | Columbio | 41 | Antiguo nombre del niobio . | [nb 1] | [7] [9] |
| Ch | Cromo | 24 | El símbolo actual es Cr . | [nb 1] | |
| Cl | Columbio | 41 | Antiguo nombre del niobio . El símbolo ahora se usa para cloro . | [nb 1] | |
| Cm | Catium | 87 | Nombre propuesto para el francio . El símbolo ahora se usa para curio . | [nb 3] | |
| Cn | Carolinio | 90 | Baskerville creyó erróneamente que el carolinio era un elemento nuevo. En realidad era torio . El símbolo ahora se usa para copernicium . | [9] | |
| Cp | Casiopeio | 71 | Antiguo nombre del lutecio . | [nb 1] | |
| Cp | Copérnico | 112 | El símbolo actual es Cn . | [nb 1] | |
| Connecticut | Celtium | 72 | Reclamación desacreditada del descubrimiento de hafnio . | [nb 2] | |
| Connecticut | Centurio | 100 | Nombre propuesto para fermio . | [nb 3] | |
| Cy | Ciclonio | 61 | Nombre propuesto para prometio . | [nb 3] | |
| D | Didimio | 59/60 | Mezcla de los elementos praseodimio y neodimio . Mosander creyó erróneamente que el didimio era un elemento. | [10] | |
| Da | Davyum | 43 | Reclamación desacreditada del descubrimiento de tecnecio . | [nb 2] | [7] |
| Db | Dubhium | 69 | Eder creyó erróneamente que el dubhium era un elemento nuevo. En realidad era tulio . El símbolo ahora se usa para dubnium . | ||
| Db | Dubnium | 104 | Nombre propuesto para el rutherfordio . En cambio, el símbolo y el nombre se utilizaron para el elemento 105. | [nb 1] [nb 3] | [7] |
| Corriente continua | Decipio | 62 | Delafontaine creía erróneamente que el decipium era un elemento nuevo. En realidad era samario . | ||
| Corriente continua | Dvicaesium | 87 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el francio coincidió con la predicción. | [nb 3] [nb 4] | |
| Delaware | Denebio | 69 | Eder creyó erróneamente que el denebio era un elemento nuevo. En realidad era tulio . | ||
| Di | Didimio | 59/60 | Mezcla de los elementos praseodimio y neodimio . Mosander creyó erróneamente que el didimio era un elemento. | [10] | |
| Hacer | Insecto | 85 | Reclamación desacreditada de descubrimiento de astato . | [nb 2] | [9] |
| Dn | Dubadio | 118 | Nombre propuesto para oganesson . | [nb 3] | |
| Dp | Decipio | 62 | Delafontaine creía erróneamente que el decipium era un elemento nuevo. En realidad era samario . | ||
| Ds | Disprosio | 66 | El símbolo actual es Dy . El símbolo ahora se usa para darmstadtium . | [nb 1] | |
| Dt | Dvitellurium | 84 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el polonio coincidió estrechamente con la predicción. | [nb 3] [nb 4] | |
| mi | Einstenio | 99 | El símbolo actual es Es . | [nb 1] | |
| mi | Erbio | 68 | El símbolo actual es Er . | [nb 1] | |
| Ea | Ekaaluminio | 31 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el galio coincidió con la predicción. | [nb 3] [nb 4] | |
| Eb | Ekaboron | 21 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el escandio coincidió con la predicción. | [nb 3] [nb 4] | [7] |
| Eb | Erebodio | 42 | Alexander Pringle creyó erróneamente que el erebodium era un elemento nuevo. En realidad era molibdeno . | ||
| El | Ekaaluminio | 31 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el galio coincidió con la predicción. | [nb 3] [nb 4] | [7] |
| Em | Ekamanganeso | 43 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el tecnecio coincidió con la predicción. | [nb 3] [nb 4] | [7] |
| Em | Emanación | 86 | También llamado "emanación de radio", el nombre fue originalmente dado por Friedrich Ernst Dorn en 1900. En 1923, este elemento se convirtió oficialmente en radón (el nombre dado en una época al 222 Rn, un isótopo identificado en la cadena de desintegración del radio ). | [nb 1] | [7] |
| Em | Emanium | 89 | Nombre alternativo propuesto anteriormente para el actinio . | [nb 3] | |
| Es | Ekasilicio | 32 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el germanio coincidió con la predicción. El símbolo ahora se usa para einstenio . | [nb 3] [nb 4] | [7] |
| Es | Esperio | 94 | Reclamación desacreditada del descubrimiento de plutonio . El símbolo ahora se usa para einstenio . | [nb 2] | [7] |
| Et | Ekatantalum | 91 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el protactinio coincidió estrechamente con la predicción. | [nb 3] [nb 4] | |
| Ex | Euxenio | 72 | Reclamación desacreditada del descubrimiento de hafnio . | [nb 2] | |
| Fa | Francio | 87 | Símbolo actual es el padre . | [nb 1] | |
| Florida | Florentium | 61 | Reclamación desacreditada del descubrimiento de prometio . El símbolo ahora se usa para flerovium . | [nb 2] | |
| Florida | Flúor | 9 | Símbolo actual es F . El símbolo ahora se usa para flerovium . | [nb 1] | |
| P. | Florentium | 61 | Reclamación desacreditada del descubrimiento de prometio . El símbolo ahora se usa para francio . | [nb 2] | [7] |
| GRAMO | Glucinio | 4 | Antiguo nombre del berilio . | [nb 1] | |
| Gh | Ghiorsium | 118 | Reclamación desacreditada del descubrimiento de oganesson . | [nb 2] | |
| Gl | Glucinio | 4 | Antiguo nombre del berilio . | [nb 1] | [7] |
| Decir ah | Hahnio | 105 | Nombre propuesto para dubnium . | [nb 3] | |
| Hn | Hahnio | 108 | Nombre propuesto para hassium . | [nb 3] | [7] |
| Hv | Helvecio | 85 | Reclamación desacreditada de descubrimiento de astato . | [nb 2] | [9] |
| Hy | Mercurio | 80 | Hy del griego hydrargyrum para "plata líquida". El símbolo actual es Hg . | [nb 1] | [6] |
| I | Iridio | 77 | El símbolo actual es Ir . El símbolo ahora se usa para el yodo . | [nb 1] | |
| Ic | Incognitium | sesenta y cinco | Demarçay creía erróneamente que el incognitium era un elemento nuevo. En realidad era terbio . | ||
| Illinois | Illinium | 61 | Reclamación desacreditada del descubrimiento de prometio . | [nb 2] | [7] |
| Illinois | Ilmenio | 41/73 | Mezcla de los elementos niobio y tantalio . R. Hermann creyó erróneamente que el ilmenio era un elemento. | ||
| Io | Ionio | sesenta y cinco | Demarçay creyó erróneamente que el ionio era un elemento nuevo. En realidad era terbio . | ||
| J | Jodio | 53 | Antiguo nombre del yodo . | [nb 1] | |
| Jg | Jargonium | 72 | Reclamación desacreditada del descubrimiento de hafnio . | [nb 2] | [7] |
| Jl | Joliotium | 105 | Nombre propuesto para dubnium . | [nb 3] | [7] |
| Jp | Japonio | 113 | Nombre propuesto para nihonium . | [nb 3] | |
| Ka | Potasio | 19 | Símbolo actual es K . | [nb 1] | |
| Ku | Kurchatovium | 104 | Nombre propuesto para el rutherfordio . | [nb 3] | [7] |
| L | Litio | 3 | El símbolo actual es Li . | [nb 1] | |
| Lw | Lawrencium | 103 | El símbolo actual es Lr . | [nb 1] | |
| METRO | Muriaticum | 17 | Antiguo nombre del cloro . | [nb 1] | |
| Mamá | Manganeso | 25 | El símbolo actual es Mn . | [nb 1] | |
| Mamá | Masurium | 43 | Reclamación controvertida sobre el descubrimiento de tecnecio . | [nb 2] | [7] |
| Maryland | Mendelevio | 97 | Nombre propuesto para el berkelio . El símbolo y el nombre se usaron más tarde para el elemento 101. | [nb 1] [nb 3] | |
| Ml | Moldavio | 87 | Reclamación desacreditada de descubrimiento de francio . | [nb 2] | [9] |
| Milisegundo | Magnesio | 12 | El símbolo actual es Mg . | [nb 1] | |
| Milisegundo | Masrium | 88 | Reclamación desacreditada del descubrimiento del radio . | [nb 2] | |
| Milisegundo | Masurium | 43 | Reclamación controvertida sobre el descubrimiento de tecnecio . | [nb 2] | |
| Milisegundo | Mosandrium | sesenta y cinco | Smith creyó erróneamente que el mosandrium era un elemento nuevo. En realidad era terbio . | ||
| Mv | Mendelevio | 101 | El símbolo actual es Md . | [nb 1] | |
| Ng | Noruego | 72 | Reclamación desacreditada del descubrimiento de hafnio . | [nb 2] | |
| No | Norium | 72 | Reclamación desacreditada del descubrimiento de hafnio . El símbolo ahora se usa para nobelio . | [nb 2] | |
| Notario público | Neptunio | 91 | Reclamación desacreditada del descubrimiento de protactinio . El símbolo y el nombre se usaron más tarde para el elemento 93. | [nb 2] | [11] |
| Notario público | Nipponio | 43 | Reclamación desacreditada del descubrimiento de tecnecio . El símbolo ahora se usa para neptunio . | [nb 2] | [7] |
| Ns | Nielsbohrium | 105 | Nombre propuesto para dubnium . | [nb 3] | [7] |
| Ns | Nielsbohrium | 107 | Nombre propuesto para bohrium . | [nb 3] | [7] |
| Nuevo Testamento | Niton | 86 | Antiguo nombre del radón . | [nb 1] | [7] |
| Nueva York | Neoytterbium | 70 | Antiguo nombre de iterbio . | [nb 1] | |
| PAG | Dirigir | 82 | El símbolo actual es Pb . El símbolo ahora se usa para fósforo . | [nb 1] | |
| Pensilvania | Paladio | 46 | El símbolo actual es Pd . El símbolo ahora se usa para protactinio . | [nb 1] | |
| Educación física | Pelopium | 41 | Antiguo nombre del niobio . | [nb 1] | |
| Doctorado | Fósforo | 15 | Símbolo actual es P . | [nb 1] | |
| Pl | Paladio | 46 | El símbolo actual es Pd . | [nb 1] | |
| Pm | Polymnestum | 33 | Alexander Pringle creyó erróneamente que el polymnestum era un elemento nuevo. En realidad era arsénico . El símbolo ahora se usa para prometio . | ||
| Correos | Potasio | 19 | Símbolo actual es K . El símbolo ahora se usa para polonio . | [nb 1] | |
| Páginas | Philippium | 67 | Delafontaine creía erróneamente que el filipio era un elemento nuevo. En realidad era holmio . | ||
| R | Rodio | 45 | El símbolo actual es Rh . (El símbolo ahora se usa a veces para un grupo alquilo ). | [nb 1] | |
| Rd | Radio | 88 | El símbolo actual es Ra . | [nb 1] | |
| Rf | Rutherfordio | 106 | Nombre propuesto para el seaborgio . En cambio, el símbolo y el nombre se utilizaron para el elemento 104. | [nb 1] [nb 3] | [7] |
| Ro | Rodio | 45 | El símbolo actual es Rh . | [nb 1] | |
| Sa | Samario | 62 | El símbolo actual es Sm . | [nb 1] | [7] |
| Entonces | Sodio | 11 | El símbolo actual es Na . | [nb 1] | |
| Cuadrados | Sequanium | 93 | Reclamación desacreditada del descubrimiento de neptunio . | [nb 2] | |
| S t | Antimonio | 51 | El símbolo actual es Sb . | [nb 1] | |
| S t | Estaño | 50 | El símbolo actual es Sn . | [nb 1] | |
| Tm | Trimanganeso | 75 | Nombre dado por Mendeleev a un elemento aún no descubierto. Cuando se descubrió, el renio coincidió con la predicción. El símbolo ahora se usa para el tulio . | [nb 3] [nb 4] | |
| Tennesse | Tungsteno | 74 | Símbolo actual es W . | [nb 1] | |
| Tr | Terbio | sesenta y cinco | El símbolo actual es Tb . | [nb 1] | |
| Tu | Tulio | 69 | El símbolo actual es Tm . | [nb 1] | |
| Tu | Tungsteno | 74 | Símbolo actual es W . | [nb 1] | |
| Unb | Unnilbium | 102 | Nombre temporal dado a nobelium hasta que fue nombrado permanentemente por IUPAC. | [nb 4] | |
| Une | Unnilennium | 109 | Nombre temporal dado a meitnerium hasta que fue nombrado permanentemente por IUPAC. | [nb 4] | |
| Unh | Unnilhexium | 106 | Nombre temporal dado al seaborgio hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Uno | Unniloctium | 108 | Nombre temporal dado al hassium hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Unp | Unnilpentio | 105 | Nombre temporal dado a dubnium hasta que fue nombrado permanentemente por IUPAC. | [nb 4] | |
| Unq | Unnilquadium | 104 | Nombre temporal dado al rutherfordio hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Uns | Unnilseptium | 107 | Nombre temporal dado a bohrium hasta que fue nombrado permanentemente por IUPAC. | [nb 4] | |
| Unt | Unniltrium | 103 | Nombre temporal dado a lawrencium hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Unu | Unnilunium | 101 | Nombre temporal dado al mendelevio hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Uub | Ununbio | 112 | Nombre temporal dado al copernicium hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Uuh | Ununhexio | 116 | Nombre temporal dado a livermorium hasta que fue nombrado permanentemente por IUPAC. | [nb 4] | |
| Uun | Ununnilium | 110 | Nombre temporal dado a darmstadtium hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Uuo | Ununoctium | 118 | Nombre temporal dado a oganesson hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Uup | Ununpentio | 115 | Nombre temporal dado a moscovium hasta que fue nombrado permanentemente por IUPAC. | [nb 4] | |
| Uuq | Ununquadium | 114 | Nombre temporal dado a flerovium hasta que fue nombrado de forma permanente por la IUPAC. | [nb 4] | |
| Uus | Ununseptium | 117 | Nombre temporal dado a tennessine hasta que fue nombrado permanentemente por IUPAC. | [nb 4] | |
| Uut | Ununtrio | 113 | Nombre temporal dado al nihonium hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Uuu | Unununio | 111 | Nombre temporal dado al roentgenio hasta que la IUPAC lo nombró de forma permanente. | [nb 4] | |
| Ur | Uralio | 75 | Reclamación desacreditada del descubrimiento de renio . | [nb 2] | |
| Ur | Uranio | 92 | Símbolo actual es T . | [nb 1] | |
| Vc | Victorium | 64 | Crookes creyó erróneamente que el victorium era un elemento nuevo. En realidad era gadolinio . | ||
| Vi | Victorium | 64 | Crookes creyó erróneamente que el victorium era un elemento nuevo. En realidad era gadolinio . | ||
| Vi | Virginium | 87 | Reclamación desacreditada de descubrimiento de francio . | [nb 2] | [7] |
| Vm | Virginium | 87 | Reclamación desacreditada de descubrimiento de francio . | [nb 2] | [7] |
| Virginia | Vanadio | 23 | Símbolo actual es V . | [nb 1] | |
| Wo | Tungsteno | 74 | Símbolo actual es W . | [nb 1] | |
| X | Xenón | 54 | El símbolo actual es Xe . El símbolo ahora se usa para halógenos . | [nb 1] | |
| Yt | Itrio | 39 | Símbolo actual es S . | [nb 1] | [7] |
Símbolos pictográficos
La siguiente es una lista de símbolos pictográficos empleados para simbolizar elementos conocidos desde la antigüedad (por ejemplo, para los alquimistas ). No se incluyen en esta lista las representaciones simbólicas de sustancias anteriormente llamadas elementos (como ciertas mezclas de minerales de tierras raras y los elementos clásicos fuego y agua de la filosofía antigua) que hoy se conocen como multi-atómicos. Tampoco se incluyen las representaciones simbólicas que se utilizan actualmente para elementos en otros idiomas, como los caracteres chinos para elementos . La notación alfabética moderna fue introducida en 1814 por Jöns Jakob Berzelius . [12]
| Símbolo químico | Nombre original | Nombre moderno | Número atómico | Origen del símbolo |
|---|---|---|---|---|
| ☉ | Hidrógeno | Hidrógeno | 1 | Símbolo daltoniano circa 1808. |
| ⬤ | Carbón | Carbón | 6 | Símbolo daltoniano circa 1808. |
| ⦶ | Ázoe | Nitrógeno | 7 | Símbolo daltoniano circa 1808. |
| ◯ | Oxígeno | Oxígeno | 8 | Símbolo daltoniano circa 1808. |
| ⦷ | soda | Sodio | 11 | Símbolo daltoniano circa 1808. |
| ⊛ | Magnesio | Magnesio | 12 | Símbolo alquímico . También adoptado como símbolo del magnesio por Dalton en 1808. |
| 🟕 | Silicio | Silicio | 14 | Símbolo daltoniano circa 1808. |
| 🜏 | Azufre | Azufre | dieciséis | Símbolo alquímico . |
| Palas | Azufre | dieciséis | Símbolo alquímico . | |
| 🜍 | Azufre | Azufre | dieciséis | Símbolo alquímico . |
| ⴲ | Azufre | Azufre | dieciséis | Símbolo daltoniano circa 1808. |
| ⦾ | Calcio | Calcio | 20 | Símbolo daltoniano circa 1808. |
| ♂ | Marte | Planchar | 26 | Símbolo alquímico . |
| Ⓘ | Planchar | Planchar | 26 | Símbolo daltoniano circa 1808. |
| Ⓝ | Níquel | Níquel | 28 | Símbolo daltoniano circa 1808. |
| Stellae Fixae | Cobre | 29 | Símbolo alquímico anterior al siglo XVI . | |
| ♀ | Venus | Cobre | 29 | Símbolo alquímico . |
| Cobre | Cobre | 29 | Símbolo alquímico . | |
| Ⓒ | Cobre | Cobre | 29 | Símbolo daltoniano circa 1808. |
| Ⓩ | Zinc | Zinc | 30 | Símbolo daltoniano circa 1808. |
| Arsénico | Arsénico | 33 | Símbolo alquímico . | |
| 🜺 | Arsénico | Arsénico | 33 | Símbolo alquímico . |
| ⊕ | Itrio | Itrio | 39 | Símbolo daltoniano circa 1808. |
| ☽ | Luna | Plata | 47 | Símbolo alquímico . |
| 🜛 | Plata | Plata | 47 | Símbolo alquímico . |
| Ⓢ | Plata | Plata | 47 | Símbolo daltoniano circa 1808. |
| ♃ | Iúpiter | Estaño | 50 | Símbolo alquímico . |
| Ⓣ | Estaño | Estaño | 50 | Símbolo daltoniano circa 1808. |
| ♁ | Antimonio | Antimonio | 51 | Símbolo alquímico . |
| ☉☾ | Platino | Platino | 78 | Símbolo alquímico . |
| ⛢ | Urano | Platino | 78 | Símbolo alquímico . |
| Ⓟ | Platino | Platino | 78 | Símbolo daltoniano circa 1808. |
| ☼ | Sol | Oro | 79 | Símbolo alquímico del siglo XVI. |
| ☉ | Sol | Oro | 79 | Símbolo alquímico desde 1700 hasta 1783. |
| 🜚 | Oro | Oro | 79 | Símbolo alquímico . |
| Ⓖ | Oro | Oro | 79 | Símbolo daltoniano circa 1808. |
| ♓︎ | Piscis | Mercurio | 80 | Símbolo alquímico anterior al siglo XVI . |
| ♆ | Neptuno | Mercurio | 80 | Símbolo alquímico del siglo XVII. |
| ☿ | Mercurio | Mercurio | 80 | Símbolo alquímico desde 1700 hasta 1783. |
| ♄ | Saturno | Dirigir | 82 | Símbolo alquímico circa 1783. |
| Ⓛ | Dirigir | Dirigir | 82 | Símbolo daltoniano circa 1808. |
| ♉︎ | Tauro | Bismuto | 83 | Símbolo alquímico . |
| Ⓑ | Bismuto | Bismuto | 83 | Símbolo daltoniano circa 1808. |
| Ⓤ | Uranio | Uranio | 92 | Símbolo daltoniano circa 1808. |
Símbolos para isótopos con nombre
La siguiente es una lista de isótopos de elementos dados en las tablas anteriores que han sido designados como símbolos únicos. Con esto se quiere decir que una lista completa de los símbolos sistemáticos actuales (en la forma u Atom) no se incluye en la lista y, en cambio, se puede encontrar en la tabla de índice de isótopos . Los símbolos para los isótopos nombrados de hidrógeno , deuterio (D) y tritio (T) todavía se usan hoy en día, al igual que el torón (Tn) para el radón-220 (aunque no el actinón ; generalmente se usa An para un actínido genérico ). . Agua pesada y otros disolventes deuteradosse usan comúnmente en química, y es conveniente usar un solo carácter en lugar de un símbolo con un subíndice en estos casos. La práctica también continúa con los compuestos de tritio. Cuando se da el nombre del solvente, a veces se usa una d minúscula. Por ejemplo, se pueden utilizar d 6 -benceno y C 6 D 6 en lugar de [ 2 H 6 ] C 6 H 6 . [13]
Los símbolos de los isótopos de elementos distintos del hidrógeno y el radón ya no se utilizan en la comunidad científica. Muchos de estos símbolos fueron designados durante los primeros años de la radioquímica , y varios isótopos (a saber, los de las cadenas de desintegración de actinio , radio y torio ) llevan nombres de marcadores de posición utilizando el sistema de nombres temprano ideado por Ernest Rutherford . [14]
| Símbolo químico | Nombre | Número atómico | Origen del símbolo |
|---|---|---|---|
| C.A | Actinio | 89 | Del griego aktinos . Nombre restringido en un momento a 227 Ac, un isótopo del actinio . Este isótopo nombrado más tarde se convirtió en el nombre oficial del elemento 89 . |
| AcA | Actinio A | 84 | Desde actinio y A. Nombre de marcador de posición dado de una vez a 215 Po, un isótopo de polonio identificado en la cadena de desintegración del actinio . |
| AcB | Actinio B | 82 | Desde actinio y B. Nombre de marcador de posición dado de una vez a 211 Pb, un isótopo de plomo identificado en la cadena de desintegración del actinio . |
| AcC | Actinio C | 83 | Desde actinio y C. Nombre de marcador de posición dado en un momento a 211 Bi, un isótopo de bismuto identificado en la cadena de desintegración del actinio . |
| AcC ' | Actinio C ' | 84 | De actinio y C ' . Nombre de marcador de posición dado en una ocasión a 211 Po, un isótopo de polonio identificado en la cadena de desintegración del actinio . |
| AcC " | Actinio C " | 81 | De actinio y C " . Nombre de marcador de posición dado en un momento a 207 Tl, un isótopo del talio identificado en la cadena de desintegración del actinio . |
| AcK | Actinio K | 87 | Nombre dado al mismo tiempo a 223 Fr, un isótopo del francio identificado en la cadena de desintegración del actinio . |
| AcU | Actino-uranio | 92 | Nombre dado en una ocasión al 235 U, un isótopo del uranio . |
| AcX | Actinio X | 88 | Nombre dado en una ocasión a 223 Ra, un isótopo del radio identificado en la cadena de desintegración del actinio . |
| Un | Actinon | 86 | De actina io y emanati en . Nombre dado de una vez a 219 Rn, un isótopo del radón identificado en la cadena de desintegración del actinio . |
| D | Deuterio | 1 | Del griego deuteros . Nombre dado a 2 H. |
| Io | Ionio | 90 | Nombre dado a 230 Th, un isótopo de torio identificado en la cadena de desintegración del uranio . |
| MsTh 1 | Mesotorio 1 | 88 | Nombre dado a la vez a 228 Ra, un isótopo del radio . |
| MsTh 2 | Mesotorio 2 | 89 | Nombre dado de una vez al 228 Ac, un isótopo del actinio . |
| Pensilvania | Protactinio | 91 | Del griego protos y actinium . Nombre restringido en un momento a 231 Pa, un isótopo de protactinio . Este isótopo nombrado más tarde se convirtió en el nombre oficial del elemento 91 . |
| Real academia de bellas artes | Radio | 88 | Del radio latino . Nombre restringido en un momento a 226 Ra, un isótopo del radio . Este isótopo nombrado más tarde se convirtió en el nombre oficial del elemento 88 . |
| RaA | Radio A | 84 | Desde radio y A. Nombre de marcador de posición dado de una vez a 218 Po, un isótopo de polonio identificado en la cadena de desintegración del radio . |
| RaB | Radio B | 82 | Desde radio y B. Nombre de marcador de posición dado de una vez a 214 Pb, un isótopo de plomo identificado en la cadena de desintegración del radio . |
| RaC | Radio C | 83 | Desde radio y C. Nombre de marcador de posición dado en un momento a 214 Bi, un isótopo de bismuto identificado en la cadena de desintegración del radio . |
| RaC ' | Radio C ' | 84 | De radio y C ' . Nombre de marcador de posición dado en una ocasión a 214 Po, un isótopo de polonio identificado en la cadena de desintegración del radio . |
| RaC " | Radio C " | 81 | De radio y C " . Nombre de marcador de posición dado de una vez a 210 Tl, un isótopo del talio identificado en la cadena de desintegración del radio . |
| RaD | Radio D | 82 | Desde radio y D. Nombre de marcador de posición dado de una vez a 210 Pb, un isótopo de plomo identificado en la cadena de desintegración del radio . |
| RaE | Radio E | 83 | Desde radio y E. Nombre de marcador de posición dado en un momento a 210 Bi, un isótopo de bismuto identificado en la cadena de desintegración del radio . |
| RaE " | Radio E " | 81 | De radio y E " . Nombre de marcador de posición dado en una ocasión a 206 Tl, un isótopo del talio identificado en la cadena de desintegración del radio . |
| RaF | Radio F | 84 | Desde radio y F. Nombre de marcador de posición dado de una vez a 210 Po, un isótopo de polonio identificado en la cadena de desintegración del radio . |
| RdAc | Radioactinio | 90 | Nombre dado a la vez a 227 Th, un isótopo de torio . |
| RdTh | Radiotorio | 90 | Nombre dado a la vez a 228 Th, un isótopo de torio . |
| Rn | Radón | 86 | De rad ium y emanati en adelante . Nombre restringido en un momento a 222 Rn, un isótopo del radón identificado en la cadena de desintegración del radio . Este isótopo nombrado más tarde se convirtió en el nombre oficial del elemento 86 en 1923. |
| T | Tritio | 1 | Del griego tritos . Nombre dado a 3 H. |
| Th | Torio | 90 | Después de Thor . Nombre restringido en un momento a 232 Th, un isótopo de torio . Este isótopo nombrado más tarde se convirtió en el nombre oficial del elemento 90 . |
| ThA | Torio A | 84 | De torio y A. Nombre de marcador de posición dado en un momento a 216 Po, un isótopo de polonio identificado en la cadena de desintegración del torio . |
| ThB | Torio B | 82 | Desde torio y B. Nombre de marcador de posición dado en un momento a 212 Pb, un isótopo de plomo identificado en la cadena de desintegración del torio . |
| ThC | Torio C | 83 | Desde torio y C. Nombre de marcador de posición dado en un momento a 212 Bi, un isótopo de bismuto identificado en la cadena de desintegración del torio . |
| ThC ' | Torio C ' | 84 | De torio y C ' . Nombre de marcador de posición dado en una ocasión a 212 Po, un isótopo de polonio identificado en la cadena de desintegración del torio . |
| ThC " | Torio C " | 81 | De torio y C " . Nombre de marcador de posición dado en un momento a 208 Tl, un isótopo del talio identificado en la cadena de desintegración del torio . |
| Gracias | Torio X | 88 | Nombre dado en una ocasión a 224 Ra, un isótopo del radio identificado en la cadena de desintegración del torio . |
| Tennesse | Thoron | 86 | Desde thor ium y emanati en adelante . Nombre dado en una ocasión a 220 Rn, un isótopo del radón identificado en la cadena de desintegración del torio . |
| Interfaz de usuario | Uranio I | 92 | Nombre dado en una ocasión al 238 U, un isótopo del uranio . |
| UII | Uranio II | 92 | Nombre dado en una ocasión al 234 U, un isótopo del uranio . |
| UX 1 | Uranio X 1 | 90 | Nombre dado en una ocasión a 234 Th, un isótopo de torio identificado en la cadena de desintegración del uranio . |
| UX 2 | Uranio X 2 | 91 | Nombre dado en una ocasión a 234m Pa, un isótopo de protactinio identificado en la cadena de desintegración del uranio . |
| UY | Uranio Y | 90 | Nombre dado en una ocasión a 231 Th, un isótopo de torio identificado en la cadena de desintegración del uranio . |
| UZ | Uranio Z | 91 | Nombre dado a la vez a 234 Pa, un isótopo de protactinio identificado en la cadena de desintegración del uranio . |
Otros simbolos
General:
- A: un ácido desprotonado o un anión
- An: cualquier actínido
- B: una base , a menudo en el contexto de la teoría ácido-base de Lewis o la teoría ácido-base de Brønsted-Lowry
- E: cualquier elemento o electrófilo
- L: cualquier ligando
- Ln: cualquier lantánido
- M: cualquier metal
- Mm: mischmetall (usado ocasionalmente) [15]
- Ng: cualquier gas noble (a veces se usa Rg, pero también se usa para el elemento roentgenio : ver arriba)
- Nu: cualquier nucleófilo
- R: cualquier radical no especificado ( resto ) que no es importante para la discusión
- St: acero (usado ocasionalmente)
- X: cualquier halógeno (o, a veces, pseudohalógeno )
De la química orgánica:
- Ac: acetil - (también usado para el elemento actinio : ver arriba)
- Anuncio: 1- adamantyl
- Todos: alilo
- Am: amilo ( pentilo ) - (también usado para el elemento americio : ver arriba)
- Ar: aryl - (también usado para el elemento argón : ver arriba)
- Bn: bencilo
- Bs: brosilo o bencenosulfonilo (desactualizado)
- Bu: butilo (los prefijos i -, s - o t - pueden usarse para denotar isómeros iso -, sec - o terc -, respectivamente)
- Bz: benzoilo
- Cp: ciclopentadienilo
- Cp *: pentametilciclopentadienilo
- Cy: ciclohexilo
- Cyp: ciclopentilo
- Et: etilo
- Yo: metilo
- Mes: mesitilo (2,4,6-trimetilfenilo)
- Ms: mesilo (metilsulfonilo)
- Np: neopentyl - (también usado para el elemento neptunio : ver arriba)
- Ns: nosyl
- Pent: pentyl
- Ph, Φ : fenilo
- Pr: propilo - (el prefijo i - puede usarse para denotar isopropilo. También se usa para el elemento praseodimio : ver arriba)
- R: En contextos de química orgánica, a menudo se entiende que una "R" no especificada es un grupo alquilo.
- Tf: triflilo (trifluorometanosulfonilo)
- Tr, Trt: tritilo (trifenilmetilo)
- Ts, Tos: tosyl ( para -toluensulfonyl) - (Ts también se usa para el elemento tennessine : ver arriba)
- Vi: vinilo
Átomos exóticos:
- Mu: muonio
- Pn: protonio
- Ps: positronio
Ver también
- Lista de elementos químicos que nombran controversias
- Lista de elementos
- Notación nuclear
Notas
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar como en au av aw ax ay az ba bb El nombre cambió debido a una estandarización, modernización o actualización de un símbolo antiguo utilizado anteriormente.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae Nombre designado por el reclamante desacreditado / en disputa.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y Nombre propuesto antes del descubrimiento / creación del elemento o antes del cambio de nombre oficial de un nombre de marcador de posición.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa Nombre de marcador de posición temporal.
Referencias
- ^ Recomendaciones provisionales de la IUPAC: IR-3: Elementos y grupos de elementos (PDF) (Informe). IUPAC . Marzo de 2004.
- ^ "Tabla periódica - Real Sociedad de Química" . www.rsc.org .
- ^ "Diccionario de etimología en línea" . etymonline.com .
- ^ Wieser, Michael E .; et al. (2013). Pesos atómicos de los elementos 2011 (Informe técnico de la IUPAC). Pure Appl. Chem. (Reporte). 85 . págs. 1047–1078. doi : 10.1351 / PAC-REP-13-03-02 . (para pesos atómicos estándar de elementos)
- ^ Sonzogni, Alejandro. "Gráfico interactivo de nucleidos" . Centro Nacional de Datos Nucleares: Laboratorio Nacional de Brookhaven . Consultado el 6 de junio de 2008 . (para pesos atómicos de elementos con números atómicos 103-118)
- ↑ a b Holden, NE (12 de marzo de 2004). "Historia del origen de los elementos químicos y sus descubridores" . Centro Nacional de Datos Nucleares .
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Leal, João P. (2013). "Los nombres olvidados de los elementos químicos". Fundamentos de la ciencia . 19 (2): 175–183. doi : 10.1007 / s10699-013-9326-y .
- ^ a b "Fred Allison" . Enciclopedia de Alabama .
- ↑ a b c d e f g Fontani, Marco ; Costa, Mariagrazia; Orna, Mary Virginia (2014). Los elementos perdidos: el lado oscuro de la tabla periódica . Prensa de la Universidad de Oxford . ISBN 9780199383344.
- ^ a b Praseodimio en was.chemistryexplained.com.
- ↑ Rang, F. (1895). "El período-tabla". The Chemical News y Journal of Physical Science . 72 : 200–201.
- ↑ Berzelius, Jöns Jakob. "Ensayo sobre la causa de las proporciones químicas y sobre algunas circunstancias relacionadas con ellas: junto con un método breve y fácil de expresarlas". Annals of Philosophy 2, págs. 443–454 (1813); 3, págs. 51–52, 93–106, 244–255, 353–364 (1814); (Posteriormente republicado en "A Source Book in Chemistry, 1400-1900", eds. Leicester, Henry M. & Herbert S. Klickstein. 1952.)
- ^ IUPAC. "Compuestos isotópicamente modificados" . IUPAC . Consultado el 31 de marzo de 2015 .
- ^ Morgan, GT, ed. (1905). "Informes anuales sobre el progreso de la química para 1904". Revista de la Sociedad Química . Gurney y Jackson. 1 : 268.
En vista de la naturaleza extraordinariamente compleja de los cambios posteriores ocurridos en Radium, Rutherford ha propuesto un nuevo y conveniente sistema de nomenclatura. El primer producto del cambio de la emanación de radio se denomina radio A, el siguiente radio B, y así sucesivamente.
- ↑ Jurczyk, M .; Rajewski, W .; Majchrzycki, W .; Wójcik, G. (30 de agosto de 1999). "Materiales tipo MmNi 5 aleados mecánicamente para electrodos de hidruro metálico". Revista de aleaciones y compuestos . 290 (1–2): 262–266. doi : 10.1016 / S0925-8388 (99) 00202-9 .
- Elementimología y elementos Multidict , etimologías de nombres de elementos. Consultado el 15 de julio de 2005.
- Pesos atómicos de los elementos 2001, aplicación pura. Chem. 75 (8), 1107–1122, 2003 . Consultado el 30 de junio de 2005. Pesos atómicos de elementos con números atómicos del 1 al 109 tomados de esta fuente.
- Pesos atómicos estándar de la IUPAC revisados (2005).
- Tabla periódica de WebElements . Consultado el 30 de junio de 2005. Pesos atómicos de elementos con números atómicos 110-116 tomados de esta fuente.
- Lapp, Ralph E. Matter . Biblioteca de Ciencias de la Vida. Nueva York: Time, Inc. 1963.
- Leighton, Robert B. Principios de la física moderna . Nueva York: McGraw-Hill. 1959.
- Scerri, ER "La tabla periódica, su historia y su significado". Nueva York, Oxford University Press. 2007.
enlaces externos
| Wikimedia Commons tiene medios relacionados con símbolos químicos . |
- Lista de elementos de Berzelius
- Historia de los valores de peso atómico de la IUPAC (1883 a 1997)
- Comité de Nomenclatura, Terminología y Símbolos , American Chemical Society
- Simbolos
- Elementos químicos