 | |
 | |
| Datos clinicos | |
|---|---|
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Vida media de eliminación | 6 horas aprox. |
| Identificadores | |
| |
| Número CAS |
|
| PubChem CID | |
| ChemSpider | |
| UNII |
|
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Datos químicos y físicos | |
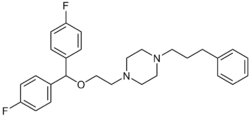
| Fórmula | C 28 H 32 F 2 N 2 O |
| Masa molar | 450,563 g / mol (base libre); 523,494 g / mol (diclorhidrato) g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
| | |
La vanoxerina ( GBR-12909 ) es un derivado de piperazina que es un inhibidor de la recaptación de dopamina (DRI) potente y selectivo . GBR-12909 se une al sitio objetivo en el transportador de dopamina (DAT) ~ 50 veces más fuertemente que la cocaína , [1] pero simultáneamente inhibe la liberación de dopamina. Este efecto combinado solo eleva ligeramente los niveles de dopamina , dando a la vanoxerina solo efectos estimulantes leves. [2] También se ha observado que la vanoxerina es un potente bloqueador del canal IKr (hERG). [3] GBR-12909 también se une con afinidad nanomolar al transportador de serotonina. [4]
Vanoxerina como tratamiento para la dependencia de la cocaína [ editar ]
La vanoxerina se ha investigado para su uso en el tratamiento de la dependencia de la cocaína tanto como sustituto de la cocaína como para bloquear los efectos gratificantes. Esta estrategia de utilizar un agonista competidor con una vida media más larga se ha utilizado con éxito para tratar la adicción a opiáceos como la heroína sustituyéndolo por metadona . Se esperaba que la vanoxerina tuviera un uso similar en el tratamiento de la adicción a la cocaína. [5] [6]
La investigación también indica que la vanoxerina puede tener mecanismos de acción adicionales, incluida la acción antagonista en los receptores nicotínicos de acetilcolina , [7] y también se ha demostrado que reduce el consumo de alcohol en modelos animales de abuso de alcohol. [8]
La vanoxerina ha pasado por ensayos en humanos hasta la Fase II, [9] [10] [11] pero su desarrollo se detuvo debido a los efectos observados en el QTc en el contexto del consumo de cocaína. [12] Este artículo se refiere a la vanoxerina como GBR 12909.
Sin embargo, los análogos de GBR 12909 continúan estudiándose como tratamientos para la adicción a la cocaína. [13] [14] Como ejemplo, los compuestos de GBR se basan en piperazina y contienen un nitrógeno proximal y uno distal. Se encontró que los análogos de piperidina siguen siendo DRI completamente activos, aunque no tienen ninguna afinidad por el "sitio de unión de piperazina" a diferencia de los compuestos de GBR. Además, el SAR reveló que, si bien hay 4 átomos que conectan los dos anillos de fluorofenilo a la piperazina, el éter de la cadena podría omitirse a cambio de un nitrógeno terciario. La vanoxerina, un bloqueador del portador de dopamina que carece de acción sobre el portador de noradrenalina, aunque aumenta completamente la dopamina en el núcleo accumbens, es ineficaz para aumentar la dopamina extracelular en la corteza prefrontal. [15]
Vanoxerina como antiarrítmico [ editar ]
La vanoxerina es un fármaco que se encontraba en proceso de reclutar participantes para un ensayo clínico en humanos de fase III para su uso como antiarrítmico cardíaco cuando surgieron problemas de seguridad. Había pasado las pruebas en humanos de fase IIb sin ninguna preocupación, pero la compañía, Laguna Pharmaceuticals, encontró problemas de seguridad que los llevaron a cerrar su compañía y al esfuerzo de $ 30 millones para producir un nuevo medicamento para el corazón. [16] Anteriormente estaba indicado como tratamiento para la enfermedad de Parkinson y la depresión ; sin embargo, no tuvo un beneficio significativo con estas enfermedades. [17]
Usos médicos [ editar ]
La vanoxerina es un tratamiento potencialmente eficaz para los ritmos cardíacos anormales . Una causa importante de ritmos cardíacos anormales es la reentrada, un evento electrofisiológico en el que la señal en proliferación se niega a terminar y persiste para preexcitar el corazón después del período refractario. [18]
Es probable que la vanoxerina actúe para prevenir la reentrada en los circuitos. Vanoxerine termina aleteo atrial y fibrilaciones atriales (ambos cardíacos ritmos cardíacos anormales) mediante el bloqueo de la señal eléctrica de recirculación, y la prevención de la reforma del circuito reentrante. [19] La vanoxerina también ha mostrado una tendencia a reducir la recurrencia de arritmias cardíacas, ya que era extremadamente difícil reproducir un aleteo o fibrilación auricular en un sujeto que había estado tomando vanoxerina. [3]
Se han realizado experimentos con éxito en cultivos celulares [ cita requerida ] , huéspedes caninos, y las pruebas se han orientado hacia ensayos en humanos.
En ensayos clínicos en humanos con dosis crecientes, la vanoxerina ha demostrado tener un índice terapéutico muy favorable, sin mostrar efectos secundarios a concentraciones mucho más altas que la dosis terapéutica. [3] En caninos, la dosis terapéutica efectiva estuvo entre 76 ng / ml y 99 ng / ml, sin embargo el fármaco alcanzó concentraciones plasmáticas de 550 ng / ml sin efectos secundarios dañinos, presentando un índice terapéutico deseable. [3]
Uno de los principales beneficios de la vanoxerina es que no parece causar los mismos efectos secundarios dañinos que su competidor más comparable, la amiodarona . [17]
Mecanismo celular [ editar ]
A nivel celular, la vanoxerina actúa bloqueando los canales iónicos cardíacos. [17] La vanoxerina es un bloqueador multicanal que actúa sobre los canales iónicos IKr (potasio), calcio tipo L y sodio. [17] Al bloquear estos canales específicos, existe una prolongación del potencial de acción de la célula, evitando la reactivación por un circuito reentrante. El bloqueo depende en gran medida de la frecuencia: a medida que aumenta el ritmo del corazón, también lo hace la frecuencia del bloqueo de los canales iónicos por la vanoxerina. [17]
Mecanismo molecular [ editar ]
En este momento, se sabe poco sobre el mecanismo molecular de la vanoxerina y se están tomando medidas para comprender cómo funciona la vanoxerina a nivel molecular.
Ver también [ editar ]
- Potencialmente, una metino podría reemplazar al éter, cf Lidoflazine & Mioflazine .
- Lista de análogos de la clase GBR "Vanoxerine"
- GBR-12783
- GBR-12935
- GBR-13069
- GBR-13098
- DBL-583 (éster decanoato de hidroxi-vanoxerina)
- RTI-120
Referencias [ editar ]
- ^ Izenwasser S, Werling LL, Cox BM (junio de 1990). "Comparación de los efectos de la cocaína y otros inhibidores de la absorción de dopamina en el cuerpo estriado de rata, núcleo accumbens, tubérculo olfatorio y corteza prefrontal medial". Investigación del cerebro . 520 (1–2): 303–9. doi : 10.1016 / 0006-8993 (90) 91719-W . PMID 2145054 . S2CID 24436917 .
- ^ Singh S (marzo de 2000). "Química, diseño y relación estructura-actividad de los antagonistas de la cocaína". Revisiones químicas . 100 (3): 925-1024. doi : 10.1021 / cr9700538 . PMID 11749256 .
- ^ a b c d Cakulev I, Lacerda AE, Khrestian CM, Ryu K, Brown AM, Waldo AL (noviembre de 2011). "La vanoxerina oral previene la reinducción de taquiarritmias auriculares: resultados preliminares" . Revista de electrofisiología cardiovascular . 22 (11): 1266–73. doi : 10.1111 / j.1540-8167.2011.02098.x . PMC 3172341 . PMID 21615815 .
- ^ Cararas SA, Izenwasser S, Wade D, Housman A, Verma A, Lomenzo SA, Trudell ML (diciembre de 2011). "Más estudios de relación estructura-actividad en derivados de 3- [2- (diarilmetoxietilidenil)] - 8-azabiciclo [3.2.1] octano sustituido en 8 en transportadores de monoamina" . Química bioorgánica y medicinal . 19 (24): 7551–8. doi : 10.1016 / j.bmc.2011.10.028 . PMC 3230044 . PMID 22055716 .
- ^ Vetulani J (2001). "Drogadicción. Parte III. Farmacoterapia de la adicción" (PDF) . Revista polaca de farmacología . 53 (5): 415–34. PMID 11990060 .
- ^ Preti A (junio de 2007). "Nuevos desarrollos en la farmacoterapia del abuso de cocaína". Biología de las adicciones . 12 (2): 133–51. doi : 10.1111 / j.1369-1600.2007.00061.x . PMID 17508985 . S2CID 21834607 .
- ^ Szasz BK, Vizi ES, Kiss JP (marzo de 2007). "Propiedad antagonista del receptor nicotínico de acetilcolina del inhibidor selectivo de la captación de dopamina, GBR-12909 en cortes de hipocampo de rata". Neurociencia . 145 (1): 344–9. doi : 10.1016 / j . neurociencia.2006.11.032 . PMID 17207584 . S2CID 25447970 .
- ^ Kamdar NK, Miller SA, Syed YM, Bhayana R, Gupta T, Rhodes JS (junio de 2007). "Efectos agudos de naltrexona y GBR 12909 en beber etanol en la oscuridad en ratones C57BL / 6J". Psicofarmacología . 192 (2): 207-17. doi : 10.1007 / s00213-007-0711-5 . PMID 17273875 . S2CID 12497800 .
- ^ Søgaard U, Michalow J, Butler B, Lund Laursen A, Ingersen SH, Skrumsager BK, Rafaelsen OJ (octubre de 1990). "Un estudio de tolerancia de la dosificación única y múltiple del inhibidor selectivo de la captación de dopamina GBR 12909 en sujetos sanos". Psicofarmacología Clínica Internacional . 5 (4): 237–51. doi : 10.1097 / 00004850-199010000-00001 . PMID 2150527 . S2CID 32605858 .
- ^ Preti A (octubre de 2000). "Instituto Nacional de Vanoxerina sobre el Abuso de Drogas". Opinión actual sobre drogas en investigación . 1 (2): 241–51. PMID 11249581 .
- ^ Gorelick DA, Gardner EL, Xi ZX (2004). "Agentes en desarrollo para el manejo del abuso de cocaína" . Drogas . 64 (14): 1547–73. doi : 10.2165 / 00003495-200464140-00004 . PMID 15233592 . S2CID 5421657 .
- ^ Herman BH, Elkashef A, Vocci F (2005). "Medicamentos para el tratamiento de la adicción a la cocaína: candidatos emergentes". Descubrimiento de drogas hoy . 2 (1): 87–92. doi : 10.1016 / j.ddstr.2005.05.014 .
- ^ Rothman RB, Baumann MH, Prisinzano TE, Newman AH (enero de 2008). "Inhibidores del transporte de dopamina basados en GBR12909 y benztropina como medicamentos potenciales para tratar la adicción a la cocaína" . Farmacología bioquímica . 75 (1): 2-16. doi : 10.1016 / j.bcp.2007.08.007 . PMC 2225585 . PMID 17897630 .
- ^ Runyon SP, Carroll FI (2006). "Ligandos del transportador de dopamina: desarrollos recientes y potencial terapéutico". Temas actuales en química medicinal . 6 (17): 1825–43. doi : 10.2174 / 156802606778249775 . PMID 17017960 .
- ^ Tanda G, Bassareo V, Di Chiara G (enero de 1996). "Mianserin aumenta marcada y selectivamente la dopamina extracelular en la corteza prefrontal en comparación con el núcleo accumbens de la rata". Psicofarmacología . 123 (2): 127-30. doi : 10.1007 / bf02246169 . PMID 8741935 . S2CID 43300151 .
- ^ Glenn B. "El desarrollador de drogas ChanRx cierra la inversión de la serie A, contrata a CEO" . Noticias MEDCITY . Consultado el 11 de marzo de 2012 .
- ↑ a b c d e Lacerda AE, Kuryshev YA, Yan GX, Waldo AL, Brown AM (marzo de 2010). "Vanoxerina: mecanismo celular de un nuevo antiarrítmico" . Revista de electrofisiología cardiovascular . 21 (3): 301–10. doi : 10.1111 / j.1540-8167.2009.01623.x . PMC 3107714 . PMID 19817928 .
- ^ Mahmud F, Shiozawa N, Makikawa M, Nomura T (junio de 2011). "Excitación reentrante en un modelo de circuito híbrido analógico-digital de tejido cardíaco". Caos . 21 (2): 023121. Bibcode : 2011Chaos..21b3121M . doi : 10.1063 / 1.3597645 . PMID 21721763 .
- ^ Matsumoto N, Khrestian CM, Ryu K, Lacerda AE, Brown AM, Waldo AL (marzo de 2010). "Vanoxerina, un nuevo fármaco para acabar con la fibrilación auricular y el aleteo". Revista de electrofisiología cardiovascular . 21 (3): 311–9. doi : 10.1111 / j.1540-8167.2009.01622.x . PMID 19817929 . S2CID 32305356 .