| Endocarditis infecciosa | |
|---|---|
| Otros nombres | Endocarditis bacteriana |
 | |
| Una válvula mitral vegetación causada por endocarditis bacteriana. | |
| Especialidad | Cardiología , Enfermedad infecciosa |
| Síntomas | Fiebre , pequeñas áreas de sangrado en la piel , soplo cardíaco , sensación de cansancio, niveles bajos de glóbulos rojos [1] |
| Complicaciones | Insuficiencia valvular , insuficiencia cardíaca , accidente cerebrovascular , insuficiencia renal [1] [2] |
| Causas | Infección bacteriana , infección por hongos [1] |
| Factores de riesgo | Cardiopatía valvular, incluida enfermedad reumática , cardiopatía congénita , válvulas artificiales , hemodiálisis , uso de drogas intravenosas , marcapasos electrónicos [3] |
| Método de diagnóstico | Basado en síntomas, hemocultivos , ecografía [1] |
| Tratamiento | Antibióticos , cirugía cardíaca [1] |
| Pronóstico | 25% de riesgo de muerte [3] |
| Frecuencia | 5 por 100.000 por año [3] |
La endocarditis infecciosa es una infección de la superficie interna del corazón , generalmente las válvulas . [1] Los signos y síntomas pueden incluir fiebre , pequeñas áreas de sangrado en la piel , soplo cardíaco , sensación de cansancio y recuento bajo de glóbulos rojos . [1] Las complicaciones pueden incluir flujo sanguíneo inverso en el corazón , insuficiencia cardíaca (el corazón lucha por bombear una cantidad suficiente de sangre para satisfacer las necesidades del cuerpo, conducción eléctrica anormal en el corazón , accidente cerebrovascular e insuficiencia renal). [1] [2]
La causa suele ser una infección bacteriana y, con menos frecuencia, una infección por hongos . [1] Los factores de riesgo incluyen enfermedad cardíaca valvular , incluida enfermedad reumática , enfermedad cardíaca congénita , válvulas artificiales , hemodiálisis , uso de drogas intravenosas y marcapasos electrónicos . [3] Las bacterias más comúnmente involucradas son los estreptococos o estafilococos . [1] El diagnóstico se sospecha sobre la base de los síntomas y está respaldado por hemocultivos o ecografías.del corazón. [1] También existe una forma no infecciosa de endocarditis . [1]
La utilidad de los antibióticos después de los procedimientos dentales para la prevención no está clara. [4] Algunos los recomiendan para personas con alto riesgo. [1] El tratamiento generalmente es con antibióticos por vía intravenosa . [1] La elección de los antibióticos se basa en los resultados de los hemocultivos. [1] Ocasionalmente se requiere cirugía cardíaca . [1]
El número de personas afectadas es de aproximadamente 5 por cada 100.000 por año. [3] Sin embargo, las tasas varían entre las regiones del mundo. [3] La endocarditis infecciosa ocurre en hombres con más frecuencia que en mujeres. [1] El riesgo de muerte entre los infectados es de aproximadamente el 25%. [3] Sin tratamiento, es casi universalmente fatal. [1]
Clasificación
La endocarditis infecciosa se divide en tres categorías: aguda, subaguda y crónica según la duración de los síntomas. [5] La endocarditis infecciosa aguda se refiere a la presencia de signos y síntomas de endocarditis infecciosa que están presentes durante días hasta seis semanas. [5] Si estos signos y síntomas persisten durante más de seis semanas pero menos de tres meses, se trata de endocarditis infecciosa subaguda. [5] La endocarditis infecciosa crónica se refiere a la presencia de tales signos y síntomas cuando persisten durante más de tres meses. [5]
- La endocarditis bacteriana subaguda (SBE) a menudo se debe a estreptococos de baja virulencia (principalmente estreptococos viridans ) y enfermedad leve a moderada que progresa lentamente durante semanas y meses (> 2 semanas) y tiene baja propensión a sembrar hematógenamente sitios extracardíacos.
- La endocarditis bacteriana aguda (EBA) es una enfermedad fulminante que dura días o semanas (<2 semanas), y es más probable que se deba a Staphylococcus aureus , que tiene una virulencia mucho mayor o capacidad de producir enfermedades y con frecuencia causa infección metastásica. [6]
Esta clasificación ahora se desaconseja, porque las asociaciones adscritas (en términos de organismo y pronóstico) no eran lo suficientemente fuertes como para confiar en ellas clínicamente. Se prefieren los términos incubación corta (que significa menos de aproximadamente seis semanas) e incubación prolongada (más de aproximadamente seis semanas). [7]
Resultados de cultivo
La endocarditis infecciosa también se puede clasificar como cultivo positivo o cultivo negativo . Con mucho, la causa más común de endocarditis "con cultivo negativo" es la administración previa de antibióticos. [8]
A veces, los microorganismos pueden tardar más en crecer en los medios de cultivo, por ejemplo, Cutibacterium spp. [9] y el grupo de bacterias HACEK. Se dice que algunos organismos son exigentes porque tienen requisitos de crecimiento exigentes. Algunos ejemplos incluyen patógenos como especies de Aspergillus , especies de Brucella , Coxiella burnetii , especies de Chlamydia . Debido al retraso en el crecimiento y la identificación en estos casos, los pacientes pueden clasificarse erróneamente como endocarditis "con cultivo negativo". [10]
Lado del corazón
La endocarditis también se puede clasificar por el lado del corazón afectado:
- Las personas que se inyectan opioides por vía intravenosa como la heroína o la metanfetamina pueden introducir una infección que puede viajar al lado derecho del corazón, afectando clásicamente la válvula tricúspide y, con mayor frecuencia, causada por S. aureus . [6]
- Independientemente de la causa, la endocarditis del lado izquierdo es más común en personas que se inyectan drogas intravenosas y personas que no consumen sustancias que la endocarditis del lado derecho. [6]
Configuración de la infección
Otra forma de endocarditis es la endocarditis asociada a la atención médica cuando se cree que el organismo infectante se transmite en un entorno de atención médica como un hospital, una unidad de diálisis o un hogar de ancianos residencial. La endocarditis nosocomial es una forma de endocarditis asociada a la asistencia sanitaria en la que el organismo infeccioso se adquiere durante la estancia hospitalaria y suele ser secundaria a la presencia de catéteres intravenosos, vías de nutrición parenteral total , marcapasos , etc. [11]
Tipo de válvula
Por último, la distinción entre la endocarditis de la válvula nativa y la endocarditis de válvula protésica es clínicamente importante. La endocarditis valvular protésica puede ser temprana (<60 días de la cirugía valvular), intermedia (60 días a 1 año) o tardía (> 1 año después de la cirugía valvular). [ cita requerida ]
- La endocarditis precoz de la válvula protésica suele deberse a contaminación intraoperatoria o contaminación bacteriana posoperatoria que suele ser de naturaleza nosocomial .
- La endocarditis tardía de la válvula protésica suele deberse a microorganismos extrahospitalarios. [11]
La endocarditis de la válvula protésica es causada comúnmente por Staphylococcus epidermidis, ya que es capaz de crecer como una biopelícula en superficies plásticas. [12] Cutibacterium acnes causa casi exclusivamente endocarditis en válvulas cardíacas protésicas. [9]
Signos y síntomas
- La fiebre se presenta en el 97% de las personas; malestar y fatiga por resistencia en el 90% de las personas. [13]
- Un soplo cardíaco nuevo o cambiante , pérdida de peso y tos ocurren en el 35% de las personas. [13]
- Fenómenos vasculares: embolia séptica (un fragmento de tejido o detritos infectados que se desprende y viaja a través del torrente sanguíneo a un lugar distante) (que causa problemas tromboembólicos como un accidente cerebrovascular o gangrena de los dedos), lesiones de Janeway (lesiones cutáneas hemorrágicas indoloras en las palmas de las manos) y plantas), sangrado en el cerebro , hemorragia conjuntival , hemorragias en astilla , infartos renales e infartos esplénicos . [14] La endocarditis infecciosa también puede conducir a la formación de aneurismas micóticos . [5]
- Fenómenos inmunológicos: glomerulonefritis que permite la entrada de sangre y albúmina en la orina , [6] nódulos de Osler ("manchas efímeras de un eritema nodular doloroso, principalmente en la piel de las manos y los pies"), manchas de Roth en la retina , suero positivo factor reumatoide
- Otros signos pueden incluir sudores nocturnos, escalofríos, anemia, agrandamiento del bazo [15]
Porque
Muchos microorganismos pueden causar endocarditis infecciosa. Estos se aíslan generalmente mediante hemocultivo , donde se extrae la sangre del paciente y se observa e identifica cualquier crecimiento. El término endocarditis bacteriana (EB) se utiliza comúnmente, lo que refleja el hecho de que la mayoría de los casos de EI se deben a bacterias; sin embargo, la endocarditis infecciosa (EI) se ha convertido en el término preferido. [ cita requerida ]
Bacteriano
Staphylococcus aureus es la principal causa de endocarditis infecciosa en la mayor parte del mundo y es responsable de aproximadamente el 31% de los casos. [5] Staphylococcus aureus es la causa más común de endocarditis en personas que usan drogas intravenosas. [16] Los estreptococos viridans y los enterococos son el segundo y tercer organismo más común responsable de la endocarditis infecciosa. [5] Los estreptococos viridans son una causa común de endocarditis infecciosa en América del Sur. Otros estreptococos también son una causa frecuente. La endocarditis infecciosa por Streptococcus bovis ocurre con más frecuencia en Europa que en América del Norte. [5] HACEKgrupo de bacterias también son causas raras de endocarditis infecciosa en América del Norte. [17]
El grupo viridans incluye S. oralis , S. mitis , S. sanguis , S. gordonii y S. parasanguis . Los hábitats principales de estos organismos son la cavidad bucal y el tracto respiratorio superior. [18] Estas bacterias están presentes en la flora oral normal y entran al torrente sanguíneo debido a la rotura de los tejidos de la boca cuando se realizan procedimientos quirúrgicos dentales (extracciones dentales) o manipulación genitourinaria. De manera similar, los organismos HACEK son un grupo de bacterias que viven en las encías dentales y se pueden ver en personas que se inyectan drogas que contaminan sus agujas con saliva. Los pacientes también pueden tener antecedentes de mala higiene dental o enfermedad valvular preexistente. [19]
Los estreptococos alfa-hemolíticos viridans , que están presentes en la boca, son los microorganismos aislados con mayor frecuencia cuando la infección se adquiere en un entorno comunitario. Por el contrario, las infecciones del torrente sanguíneo por Staphylococcus se adquieren con frecuencia en un entorno de atención médica donde pueden ingresar al torrente sanguíneo a través de procedimientos que causan roturas en la integridad de la piel, como cirugía, cateterismo o durante el acceso a catéteres permanentes a largo plazo o como consecuencia de una inyección intravenosa. de las drogas recreativas. [ cita requerida ]
El enterococo puede ingresar al torrente sanguíneo como consecuencia de anomalías en los tractos gastrointestinal o genitourinario. [ cita requerida ]
Algunos organismos, cuando se aíslan, dan pistas valiosas sobre la causa, ya que tienden a ser específicos.
- Las especies de Pseudomonas , que son organismos muy resistentes que prosperan en el agua, pueden contaminar las drogas ilegales que se han contaminado con el agua potable. P. aeruginosa puede infectar a un niño a través de pinchazos en el pie y puede causar tanto endocarditis como artritis séptica . [20]
- S. bovis y Clostridium septicum , que forman parte de la flora natural del intestino, están asociados con los cánceres de colon . Cuando se presentan como el agente causante de la endocarditis, generalmente haceque se realiceuna colonoscopia de inmediato debido a preocupaciones con respecto a la propagación de bacterias desde el colon a través del torrente sanguíneo debido a que el cáncer rompe la barrera entre el interior del colon (luz) y los vasos sanguíneos que drenan el intestino. [21] [22]
- Bartonella , Chlamydia psittaci y Coxiella incluyen entre las bacterias responsables de la denominada "endocarditis con cultivo negativo" con menos frecuencia . [23] Estas bacterias pueden identificarse mediante serología, cultivo del tejido valvular extirpado, esputo, líquido pleural y émbolos, y mediante reacción en cadena de la polimerasa o secuenciación del ARN ribosómico 16S bacteriano.
Se han publicado varios informes de casos de endocarditis infecciosa causada por organismos poco comunes. Cutibacterium spp., Que son flora cutánea normal, ha sido responsable de endocarditis infecciosa, preferiblemente en pacientes con válvulas cardíacas protésicas, que en raras ocasiones han llevado a la muerte. [24] Tropheryma whipplei ha causado endocarditis sin afectación gastrointestinal. [25] Citrobacter koseri se encontró en un adulto inmunocompetente. [26] Se encontró Neisseria bacilliformis en una persona con válvula aórtica bicúspide . [27]
Hongos
La endocarditis fúngica (FE) suele ser mortal y una de las formas más graves de endocarditis infecciosa. Los tipos de hongos más vistos asociados con esta enfermedad son:
Candida albicans se encuentra como una levadura de gemación esférica u ovalada. Se asocia con endocarditis en personas que se inyectan drogas, pacientes con prótesis valvulares ypacientes inmunodeprimidos . Forma biopelículas alrededor de estructuras de reposo de paredes gruesas como válvulas cardíacas protésicas y, además, coloniza y penetra las paredes endoteliales . [18] C. albicans es responsable de 24 a 46% de todos los casos deEFy su tasa de mortalidad es de 46,6 a 50%. [28]
Otros hongos que han demostrado causar endocarditis son Histoplasma capsulatum y Aspergillus . [23] Aspergillus contribuye a aproximadamente el 25% de los casos de EF. [28] También se informó endocarditis con Tricosporon asahii en un informe de caso. [29]
Factores de riesgo
Los factores de riesgo de endocarditis infecciosa se basan en la premisa de que en un individuo sano, la bacteriemia (bacterias que ingresan al torrente sanguíneo) se elimina rápidamente sin consecuencias adversas. [30] Sin embargo, si una válvula cardíaca está dañada, las bacterias pueden adherirse a la válvula y provocar una endocarditis infecciosa. Además, en personas con sistemas inmunitarios debilitados, la concentración de bacterias en la sangre puede alcanzar niveles lo suficientemente altos como para aumentar la probabilidad de que algunas se adhieran a la válvula. A continuación se enumeran algunos factores de riesgo importantes: [5] [30]
- Válvulas cardíacas artificiales
- Dispositivos intracardíacos, como desfibriladores automáticos implantables
- Defectos cardíacos congénitos cianóticos no reparados
- Historia de endocarditis infecciosa
- Enfermedad neoplásica
- Enfermedad cardíaca reumática crónica , que es una respuesta autoinmune a la infección repetida por Streptococcus pyogenes (principalmente en el mundo en desarrollo)
- Lesiones valvulares degenerativas relacionadas con la edad
- Anomalías congénitas de las válvulas cardíacas
- Hemodiálisis , un procedimiento médico que filtra la sangre de personas con insuficiencia renal.
- Mala higiene bucal
- Condiciones coexistentes, especialmente las que inhiben la inmunidad. La diabetes mellitus , el trastorno por consumo de alcohol , la enfermedad hepática crónica, el VIH / SIDA y el consumo de drogas intravenosas se incluyen en esta categoría.
A continuación se proporcionan descripciones más detalladas de estos y otros factores de riesgo.
Otras afecciones que provocan la entrada de una gran cantidad de bacterias en el torrente sanguíneo incluyen el cáncer colorrectal (principalmente Streptococcus bovis ), [21] infecciones graves del tracto urinario (principalmente enterococos ) y la inyección de fármacos ( Staphylococcus aureus ). Con una gran cantidad de bacterias, incluso una válvula cardíaca normal puede infectarse.
Un organismo más virulento (como Staphylococcus aureus ) puede causar endocarditis infecciosa al infectar incluso una válvula cardíaca normal. [ cita requerida ]
Las personas que se inyectan drogas tienden a infectarse las válvulas cardíacas del lado derecho porque las venas que se inyectan drenan hacia el lado derecho del corazón. En la cardiopatía reumática, la infección se produce en las válvulas aórtica y mitral del lado izquierdo del corazón. [ cita requerida ]
Otros factores que aumentan el riesgo de desarrollar endocarditis infecciosa son niveles bajos de glóbulos blancos , inmunodeficiencia o inmunosupresión, malignidad, diabetes mellitus y consumo excesivo de alcohol. [6]
Operaciones dentales
En el pasado, uno de cada ocho casos [18] de endocarditis infecciosa se debía a bacteriemia causada por procedimientos dentales (en la mayoría de los casos por Streptococcus viridans , que reside en la cavidad bucal), como la limpieza o extracción de un diente; se pensó que esto era clínicamente más significativo de lo que realmente era. Sin embargo, es importante que se informe al dentista o higienista dental de cualquier problema cardíaco antes de comenzar el tratamiento. Los antibióticos se administran a pacientes con ciertas afecciones cardíacas como medida de precaución, aunque esta práctica ha cambiado en los EE. UU., Con las nuevas pautas de la American Heart Association publicadas en 2007, [31]y en el Reino Unido a partir de marzo de 2008 debido a las nuevas directrices NICE. El cepillado diario y el uso de hilo dental también causarán bacteriemia, por lo que se debe cumplir en todo momento con un alto nivel de salud bucal. [18] Aunque hay poca evidencia que respalde la profilaxis con antibióticos para el tratamiento dental, las directrices actuales de la American Heart Association son muy aceptadas por los médicos [32] y los pacientes. [33]
Patogenia

Las válvulas y el endocardio dañados contribuyen al desarrollo de endocarditis infecciosa. [30] Específicamente, la parte dañada de una válvula cardíaca forma un coágulo de sangre local , una afección conocida como endocarditis trombótica no bacteriana (NBTE) . Los depósitos de plaquetas y fibrina que se forman como parte del proceso de coagulación de la sangre permiten que las bacterias se arraiguen y formen vegetaciones . Como se mencionó anteriormente, el cuerpo no tiene métodos directos para combatir las vegetaciones valvulares porque las válvulas no tienen un suministro de sangre dedicado. Esta combinación de válvulas dañadas, crecimiento bacteriano y falta de una respuesta inmune fuerte da como resultado una endocarditis infecciosa. [ cita requerida]
El daño a las válvulas y al endocardio puede ser causado por: [30]
- Flujo sanguíneo alterado y turbulento. Las áreas que fibrosa, coagulan o se endurecen como resultado de este flujo alterado se conocen como lesiones por chorro. La alteración del flujo sanguíneo es más probable en áreas de alta presión, por lo que los defectos del tabique ventricular o el conducto arterioso persistente pueden crear más susceptibilidad que los defectos del tabique auricular .
- Catéteres, electrodos y otros dispositivos protésicos intracardíacos.
- Partículas sólidas de inyecciones intravenosas repetidas.
- Inflamación crónica. Los ejemplos incluyen mecanismos autoinmunes y lesiones valvulares degenerativas.
Los factores de riesgo de la endocarditis infecciosa proporcionan una lista más extensa de afecciones que pueden dañar el corazón.
Diagnóstico
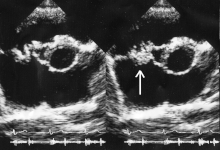
En general, deben cumplirse los criterios de Duke para establecer el diagnóstico de endocarditis. [5] [34] Aunque los criterios de Duke se utilizan ampliamente, tienen limitaciones significativas. [5] Por ejemplo, la sensibilidad de los criterios de Duke para detectar endocarditis infecciosa disminuye cuando hay válvulas cardíacas protésicas. [5]
Dado que los criterios de Duke dependen en gran medida de los resultados de la ecocardiografía, la investigación ha abordado cuándo solicitar un ecocardiograma mediante el uso de signos y síntomas para predecir la endocarditis oculta entre las personas que se inyectan drogas [35] [36] [37] y entre los pacientes que no abusan de las drogas . [38] [39] Sin embargo, esta investigación tiene más de veinte años y es posible que los cambios en la epidemiología de la endocarditis y bacterias como los estafilococos hagan que las siguientes estimaciones sean incorrectas.
No se ha encontrado que los análisis de sangre de proteína C reactiva (PCR) y procalcitonina sean particularmente útiles para ayudar a establecer o descartar el diagnóstico. [40]
Ultrasonido
La ecocardiografía es el principal tipo de diagnóstico por imagen que se utiliza para establecer el diagnóstico de endocarditis infecciosa. [5] Hay dos tipos principales de ecocardiografía que se utilizan para ayudar con el diagnóstico de la EI: la ecocardiografía transtorácica (ETT) y la ecocardiografía transesofágica (ETE). [5] El ecocardiograma transtorácico tiene una sensibilidad y especificidad de aproximadamente 65% y 95% si el ecocardiógrafo cree que hay evidencia "probable" o "casi segura" de endocarditis. [41] [42] Sin embargo, la ETT solo tiene una sensibilidad de aproximadamente 50% en personas con endocarditis de válvula protésica, mientras que la ETT tiene una sensibilidad que excede el 90% en estas personas. [5]La ETE también tiene una función diagnóstica importante cuando la ETT no revela evidencia de EI, pero la sospecha diagnóstica sigue siendo alta, ya que la ETE es más sensible a la EI que la ETT y puede caracterizar mejor el daño local que la EI causa a las válvulas cardíacas y los tejidos circundantes. . [5] Las pautas respaldan el uso inicial de ETT sobre ETE como una modalidad de diagnóstico por imágenes en personas con hemocultivos positivos, un nuevo soplo cardíaco y sospecha de endocarditis infecciosa. [5] La ETE es la forma inicial preferida de diagnóstico por imágenes en personas con sospecha de endocarditis infecciosa que tienen una probabilidad de endocarditis infecciosa previa a la prueba de moderada a alta, incluidas las personas con válvulas cardíacas protésicas, hemocultivos que desarrollan Staphylococcus o que tienen un dispositivo intracardíaco (como unmarcapasos ). [5]
- Reproducir medios
Ecografía que muestra endocarditis infecciosa [43]
- Reproducir medios
Ecografía que muestra endocarditis infecciosa [43]
- Reproducir medios
Ecografía que muestra endocarditis infecciosa [43]
- Reproducir medios
Ecografía que muestra otro caso de endocarditis infecciosa [44]
Criterios de Duke modificados
Establecidos en 1994 por el Servicio de Endocarditis de Duke y revisados en 2000, los criterios de Duke son una colección de criterios mayores y menores utilizados para establecer un diagnóstico de endocarditis infecciosa. [34] [45] Según los criterios de Duke, el diagnóstico de endocarditis infecciosa puede ser definitivo, posible o rechazado. [30] Un diagnóstico de endocarditis infecciosa es definitivo si se cumplen los siguientes criterios patológicos o clínicos:
Uno de estos criterios patológicos:
- La histología o cultivo de vegetación cardíaca, vegetación embolizada o absceso intracardíaco del corazón encuentra microorganismos
- Endocarditis activa
Una de estas combinaciones de criterios clínicos
- Dos criterios clínicos principales
- Un criterio mayor y tres menores
- Cinco criterios menores
El diagnóstico de endocarditis infecciosa es posible si se cumple una de las siguientes combinaciones de criterios clínicos:
- Un criterio mayor y uno menor
- Se cumplen tres criterios menores
Criterios principales
Hemocultivo positivo con microorganismo EI típico, definido como uno de los siguientes: [30]
- Microorganismo típico compatible con EI de dos hemocultivos separados, como se indica a continuación:
- Estreptococos del grupo viridans , o
- Streptococcus bovis, incluidas cepas variantes nutricionales, o
- Grupo HACEK , o
- Staphylococcus aureus o
- Enterococos adquiridos en la comunidad , en ausencia de un foco primario
- Microorganismos compatibles con EI de hemocultivos persistentemente positivos definidos como:
- Dos cultivos positivos de muestras de sangre extraídas con> 12 horas de diferencia, o
- Tres o la mayoría de ≥ cuatro hemocultivos separados (con la primera y la última muestra extraídas con al menos una hora de diferencia)
- Coxiella burnetii detectada mediante al menos un hemocultivo positivo o untítulo de anticuerpos IgG para elantígeno de fase 1 de la fiebre Q > 1: 800. Este era anteriormente un criterio menor
La evidencia de compromiso endocárdico con ecocardiograma positivo se define como
- Masa intracardíaca oscilante sobre válvulas o estructuras de soporte, en la trayectoria de los chorros regurgitantes o sobre material implantado en ausencia de una explicación anatómica alternativa, o
- Absceso, o
- Nueva dehiscencia parcial de la prótesis valvular o nueva regurgitación valvular (empeoramiento o cambio del soplo preexistente no es suficiente)
Criterios menores
- Factor predisponente: lesión cardíaca conocida, inyección de drogas recreativas
- Fiebre> 38 ° C
- Fenómenos vasculares : émbolos arteriales, infartos pulmonares , lesiones de Janeway , hemorragia conjuntival
- Fenómenos inmunológicos: glomerulonefritis , nódulos de Osler , manchas de Roth , factor reumatoide
- Evidencia microbiológica: hemocultivo positivo (que no cumple con un criterio principal) o evidencia serológica de infección por un organismo compatible con EI pero que no satisface el criterio principal
Riesgo
Entre las personas que no usan drogas intravenosas y tienen fiebre en el departamento de emergencias , hay menos del 5% de probabilidad de endocarditis oculta. Mellors en 1987 no encontró casos de endocarditis ni de bacteriemia estafilocócica entre 135 pacientes febriles en la sala de emergencias . [39] El intervalo de confianza superior para 0% de 135 es 5%, por lo que solo por razones estadísticas, existe hasta un 5% de probabilidad de endocarditis entre estos pacientes. En contraste, Leibovici encontró que entre 113 adultos no seleccionados ingresados en el hospital debido a fiebre hubo dos casos (1.8% con IC del 95%: 0% a 7%) de endocarditis. [38]
Entre las personas que usan drogas intravenosas y tienen fiebre en el departamento de emergencias, hay una prevalencia de endocarditis entre el 10% y el 15%. Esta estimación no cambia sustancialmente si el médico cree que el paciente tiene una explicación trivial para su fiebre. [37] Weisse encontró que 13% de 121 pacientes tenían endocarditis. [35] Marantz también encontró una prevalencia de endocarditis del 13% entre esos pacientes en el departamento de emergencias con fiebre. [37] Samet encontró una incidencia del 6% entre 283 de esos pacientes, pero después de excluir a los pacientes con una enfermedad grave inicialmente aparente para explicar la fiebre (incluidos 11 casos de endocarditis manifiesta), hubo una prevalencia de endocarditis del 7%. [36]
Entre las personas con bacteriemia estafilocócica (SAB), un estudio encontró una prevalencia del 29% de endocarditis en SAB adquirido en la comunidad frente al 5% en SAB nosocomial. [46] Sin embargo, solo el 2% de las cepas fueron resistentes a la meticilina, por lo que estos números pueden ser bajos en áreas de mayor resistencia. [ cita requerida ]
Prevención
No todas las personas con enfermedades cardíacas necesitan antibióticos para prevenir la endocarditis infecciosa. Las enfermedades cardíacas se han clasificado en riesgo alto, medio y bajo de desarrollar EI. Aquellos que caen en la categoría de alto riesgo requieren profilaxis de EI antes de endoscopias y procedimientos del tracto urinario. Las enfermedades enumeradas como de alto riesgo incluyen: [ cita requerida ]
- Endocarditis previa
- Cardiopatías congénitas cianóticas no reparadas
- Enfermedad cardíaca congénita completamente reparada en sus primeros 6 meses
- Válvulas cardíacas protésicas
- Cardiopatías congénitas incompletamente reparadas
- Valvulopatía de trasplante cardíaco
Los siguientes son los regímenes de antibióticos recomendados por la Asociación Estadounidense del Corazón para la profilaxis con antibióticos: [31]
- Amoxicilina oral una hora antes del procedimiento.
- Ampicilina intravenosa o intramuscular una hora antes del procedimiento
- En pacientes alérgicos a las penicilinas.
- Azitromicina o claritromicina por vía oral una hora antes del procedimiento
- Cefalexina por vía oral una hora antes del procedimiento.
- Clindamicina por vía oral una hora antes del procedimiento
En el Reino Unido, las guías clínicas de NICE ya no recomiendan la profilaxis porque no hay evidencia clínica de que reduzca la incidencia de EI y existen efectos negativos (por ejemplo, alergia y aumento de la resistencia bacteriana) de tomar antibióticos que pueden superar los beneficios. [47]
Históricamente, los antibióticos se recomendaban comúnmente para prevenir la EI en personas con problemas cardíacos que se sometían a procedimientos dentales (conocido como profilaxis con antibióticos dentales ). Sin embargo, no hay pruebas suficientes para respaldar si los antibióticos son efectivos o ineficaces para prevenir la EI cuando se administran antes de un procedimiento dental en personas con alto riesgo. [48] Se recomiendan con menos frecuencia para este procedimiento. [49]
En algunos países, por ejemplo en los EE. UU., Los pacientes de alto riesgo pueden recibir antibióticos profilácticos como penicilina o clindamicina para las personas alérgicas a la penicilina antes de los procedimientos dentales. [18] Los profilácticos deben ser bactericidas en lugar de bacteriostáticos . [18] Este tipo de medidas no se toman en ciertos países, como Escocia, por temor a la resistencia a los antibióticos . [50] Dado que las bacterias son la causa más común de endocarditis infecciosa, los antibióticos como la penicilina [18] y la amoxicilina (para la betalactamasabacterias productoras) se utilizan en la profilaxis.
Tratamiento
Los antibióticos en dosis altas son la piedra angular del tratamiento de la endocarditis infecciosa. Estos antibióticos se administran por vía intravenosa (IV) para maximizar la difusión de moléculas de antibióticos en la vegetación desde la sangre que llena las cámaras del corazón. Esto es necesario porque ni las válvulas cardíacas ni las vegetaciones adheridas a ellas son irrigadas por los vasos sanguíneos. Por lo general, los antibióticos se continúan durante dos a seis semanas, según las características de la infección y los microorganismos causantes . El tratamiento con antibióticos reduce el riesgo de complicaciones embólicas en personas con endocarditis infecciosa. [5]
En la endocarditis aguda, debido a la inflamación fulminante, la terapia antibiótica empírica se inicia inmediatamente después de que se haya extraído la sangre para cultivo para aclarar los organismos bacterianos responsables de la infección. Esto generalmente incluye infusiones intravenosas de vancomicina y ceftriaxona hasta que se identifica el organismo infectante y se dispone del informe de susceptibilidad con la concentración inhibitoria mínima . Una vez que esta información está disponible, esto permite al profesional sanitario supervisor modificar la terapia antimicrobiana para apuntar al microorganismo infeccioso específico. El uso rutinario de gentamicina para tratar la endocarditis ha caído en desgracia debido a la falta de evidencia que respalde su uso (excepto en infecciones causadas porEnterococcus y estreptococos nutricionalmente variantes) y la alta tasa de complicaciones. [51] En casos de endocarditis subaguda, en los que el estado hemodinámico de la persona suele ser estable, el tratamiento con antibióticos se puede retrasar hasta que se pueda identificar el microorganismo causante.
Los estreptococos del grupo viridans y Streptococcus bovis suelen ser muy susceptibles a la penicilina y pueden tratarse con penicilina o ceftriaxona. [52] Las cepas relativamente resistentes de estreptococos del grupo viridans y Streptococcus bovis se tratan con penicilina o ceftriaxona junto con un ciclo más corto de dos semanas de un aminoglucósido durante la fase inicial del tratamiento. [52] Cepas de estreptococos del grupo viridans altamente resistentes a la penicilina , estreptococos con variantes nutricionales como Granulicatella sp. , Gemella sp. ,La abiotrofia defectiva , [53] y los enterococos generalmente se tratan con una terapia combinada que consiste en penicilina y un aminoglucósido durante todo el período de cuatro a seis semanas. [52]
Algunas personas pueden ser tratadas con un ciclo de tratamiento relativamente más corto [52] (dos semanas) con bencilpenicilina IV si la infección es causada por estreptococos del grupo viridans o Streptococcus bovis , siempre que se cumplan las siguientes condiciones:
- Endocarditis de una válvula nativa, no de una válvula protésica
- Una CMI ≤ 0,12 mg / l
- Se produce una complicación como insuficiencia cardíaca , arritmia o embolia pulmonar.
- Sin evidencia de complicación extracardíaca como tromboembolismo séptico
- Sin vegetaciones> 5 mm de diámetro defectos de conducción
- Respuesta clínica rápida y eliminación de la infección del torrente sanguíneo.
Además, la endocarditis de la válvula nativa de Staphylococcus aureus susceptible a oxacilina del lado derecho también se puede tratar con un ciclo corto de 2 semanas de un antibiótico betalactámico como nafcilina con o sin aminoglucósidos.
El desbridamiento quirúrgico del material infectado y el reemplazo de la válvula por una válvula cardíaca artificial mecánica o bioprotésica es necesario en ciertas situaciones: [54]
- Pacientes con estenosis valvular significativa o regurgitación que causa insuficiencia cardíaca
- Evidencia de compromiso hemodinámico en forma de presión telediastólica ventricular izquierda o auricular izquierda elevada o hipertensión pulmonar moderada a grave
- Presencia de complicaciones intracardíacas como absceso paravalvular, defectos de conducción o lesiones penetrantes destructivas
- Recurrente séptico émbolos a pesar del tratamiento antibiótico apropiado
- Vegetaciones grandes (> 10 mm)
- Hemocultivos persistentemente positivos a pesar del tratamiento antibiótico adecuado
- Dehiscencia de la válvula protésica
- Infección recurrente en presencia de una válvula protésica.
- Formación de abscesos
- Cierre temprano de la válvula mitral
- Infección causada por hongos o bacterias gramnegativas resistentes.
Las directrices fueron actualizadas recientemente tanto por el Colegio Americano de Cardiología como por la Sociedad Europea de Cardiología . Se publicó un metaanálisis reciente que mostró que la intervención quirúrgica a los siete días o menos se asocia con una menor mortalidad. [55]
Pronóstico
La endocarditis infecciosa se asocia con un 18% de mortalidad hospitalaria. [17] Hasta el 50% de las personas con endocarditis infecciosa pueden experimentar complicaciones embólicas. [5]
Epidemiología
En los países desarrollados , la incidencia anual de endocarditis infecciosa es de 3 a 9 casos por 100.000 personas. [30] La endocarditis infecciosa ocurre con más frecuencia en hombres que en mujeres. [5] Hay una mayor incidencia de endocarditis infecciosa en personas de 65 años o más, lo que probablemente se deba a que las personas de este grupo de edad tienen una mayor cantidad de factores de riesgo de endocarditis infecciosa. En los últimos años, más de un tercio de los casos de endocarditis infecciosa en los Estados Unidos se asociaron con la atención médica . [30] Otra tendencia observada en los países desarrollados es que la cardiopatía reumática crónicarepresenta menos del 10% de los casos. Aunque el antecedente de valvulopatía tiene una asociación significativa con la endocarditis infecciosa, el 50% de todos los casos se desarrolla en personas sin antecedentes conocidos de valvulopatía. [ cita requerida ]
Historia
Pocas enfermedades presentan mayores dificultades de diagnóstico que la endocarditis maligna, dificultades que en muchos casos son prácticamente insuperables. No es un menosprecio para los muchos médicos capacitados que han dejado constancia de sus casos decir que, en total, la mitad del diagnóstico se hizo post mortem.
- William Osler, 1885
Lazare Riviére describió por primera vez la endocarditis infecciosa que afectaba a la válvula aórtica en 1616. [5] En 1806, Jean-Nicolas Corvisart acuñó el término vegetación para describir las acumulaciones de detritos que se encuentran en una válvula mitral afectada por endocarditis infecciosa. [5] El médico británico Joseph Hodgson fue el primero en describir las complicaciones embólicas de la endocarditis infecciosa en 1815. [5] No fue hasta 1878 que Theodor Klebs sugirió por primera vez que la endocarditis infecciosa tenía un origen infeccioso microbiano. [5] En 1909, William Oslerseñaló que las válvulas cardíacas que experimentaron degeneración y estaban escleróticas o con mal funcionamiento tenían un mayor riesgo de verse afectadas. [5] Más tarde, en 1924, Emanuel Libman y Benjamin Sacks describieron casos de endocarditis vegetativa que carecían de un origen microbiano claro y que a menudo se asociaban con la enfermedad autoinmune lupus eritematoso sistémico . [5] En 1944, los médicos informaron sobre el primer uso exitoso de penicilina para tratar un caso de endocarditis infecciosa. [5]
Referencias
- ^ a b c d e f g h i j k l m n o p q r "Endocarditis infecciosa - trastornos cardiovasculares" . Edición profesional de manuales de Merck . Septiembre de 2017 . Consultado el 11 de diciembre de 2017 .
- ↑ a b Njuguna B, Gardner A, Karwa R, Delahaye F (febrero de 2017). "Endocarditis infecciosa en países de ingresos bajos y medios". Clínicas de Cardiología . 35 (1): 153–163. doi : 10.1016 / j.ccl.2016.08.011 . hdl : 1805/14046 . PMID 27886786 .
- ^ a b c d e f g Ambrosioni J, Hernandez-Meneses M, Téllez A, Pericàs J, Falces C, Tolosana JM, Vidal B, Almela M, Quintana E, Llopis J, Moreno A, Miro JM (mayo de 2017). "La epidemiología cambiante de la endocarditis infecciosa en el siglo XXI". Informes actuales sobre enfermedades infecciosas . 19 (5): 21. doi : 10.1007 / s11908-017-0574-9 . PMID 28401448 . S2CID 24935834 .
- ^ Cahill TJ, Harrison JL, Jewell P, Onakpoya I, Chambers JB, Dayer M, Lockhart P, Roberts N, Shanson D, Thornhill M, Heneghan CJ, Prendergast BD (junio de 2017). "Profilaxis con antibióticos para la endocarditis infecciosa: una revisión sistemática y un metanálisis" (PDF) . Corazón . 103 (12): 937–944. doi : 10.1136 / heartjnl-2015-309102 . PMID 28213367 . S2CID 25918810 .
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab Hubers SA, DeSimone DC, Gersh BJ, Anavekar NS (mayo de 2020). "Endocarditis infecciosa: una revisión contemporánea" . Actas de Mayo Clinic . 95 (5): 982–997. doi : 10.1016 / j.mayocp.2019.12.008 . PMID 32299668 .
- ↑ a b c d e Mitchell RS, Kumar V, Robbins SL, Abbas AK, Fausto N (2007). Patología básica de Robbins (8ª ed.). Saunders / Elsevier. págs. 406–8. ISBN 978-1-4160-2973-1.
- ^ Morris AM (enero de 2006). "La mejor manera de tratar la endocarditis". Informes actuales sobre enfermedades infecciosas . 8 (1): 14-22. doi : 10.1007 / s11908-006-0030-8 . PMID 16448596 . S2CID 10450799 .
- ^ "Endocarditis" . Biblioteca de conceptos médicos de Lecturio . Consultado el 18 de julio de 2021 .
- ↑ a b Sohail MR, Gray AL, Baddour LM, Tleyjeh IM, Virk A (abril de 2009). "Endocarditis infecciosa por especies de Propionibacterium" . Microbiología clínica e infección . 15 (4): 387–94. doi : 10.1111 / j.1469-0691.2009.02703.x . PMID 19260876 .
- ^ Holland T, Baddour L, Bayer A, Hoen B, Miro J, Fowler V (1 de septiembre de 2016). "Endocarditis infecciosa" . Nature Reviews Cebadores de enfermedades . 2 : 16059. doi : 10.1038 / nrdp.2016.59 . PMC 5240923 . PMID 27582414 . Consultado el 1 de julio de 2021 .
- ↑ a b Kasper DL, Brunwald E, Fauci AS , Hauser S, Longo DL, Jameson JL (2005). Principios de Medicina Interna de Harrison . McGraw-Hill. págs. 731–40. ISBN 978-0-07-139140-5. OCLC 54501403 .CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Otto M (agosto de 2009). "Staphylococcus epidermidis - el patógeno 'accidental'" . Reseñas de la naturaleza. Microbiología . 7 (8): 555–67. doi : 10.1038 / nrmicro2182 . PMC 2807625 . PMID 19609257 .
- ^ a b Amal M, Deepi G, Jeffrey W, Joshua B, DeAngelis M, Peter D, et al. (2007). Medicina de emergencia: evitar las trampas y mejorar los resultados . Libros Blackwell / BMJ. pag. 63. ISBN 978-1-4051-4166-6.
- ^ Ferro JM, Fonseca AC (2014). "Endocarditis infecciosa". Aspectos neurológicos de enfermedad sistémica Parte I . Manual de neurología clínica. 119 . págs. 75–91. doi : 10.1016 / B978-0-7020-4086-3.00007-2 . ISBN 9780702040863. PMID 24365290 .
- ^ "Válvulas cardíacas y endocarditis infecciosa" . Asociación Americana del Corazón . Consultado el 18 de julio de 2021 .
- ^ Chan KL, Embil JM (2016). Endocarditis: diagnóstico y tratamiento . Saltador. pag. 39. ISBN 978-3-319-27784-4.
- ^ a b Murdoch DR, Corey GR, Hoen B, Miró JM, Fowler VG, Bayer AS, Karchmer AW, Olaison L, Pappas PA, Moreillon P, Chambers ST, Chu VH, Falcó V, Holland DJ, Jones P, Klein JL , Raymond NJ, Read KM, Tripodi MF, Utili R, Wang A, Woods CW, Cabell CH (marzo de 2009). "Presentación clínica, etiología y resultado de la endocarditis infecciosa en el siglo XXI: la colaboración internacional en el estudio de cohorte prospectivo de endocarditis" . Archivos de Medicina Interna . 169 (5): 463–73. doi : 10.1001 / archinternmed.2008.603 . PMC 3625651 . PMID 19273776 .
- ↑ a b c d e f g Bagg J (2006). Fundamentos de microbiología para estudiantes de odontología (2ª ed.). Oxford: Prensa de la Universidad de Oxford. ISBN 9780198564898. OCLC 61756542 .
- ^ Infecciones del grupo HACEK en eMedicine
- ^ " Pseudomonas aeruginosa " . Boletín Temas de Enfermedades Infecciosas . Agosto de 2001. Archivado desde el original el 24 de julio de 2008.
- ↑ a b Gold JS, Bayar S, Salem RR (julio de 2004). "Asociación de bacteriemia por Streptococcus bovis con neoplasia de colon y malignidad extracolónica" . Archivos de Cirugía . 139 (7): 760–5. doi : 10.1001 / archsurg.139.7.760 . PMID 15249410 .
- ^ Chew SS, Lubowski DZ (noviembre de 2001). "Clostridium septicum y malignidad". Revista ANZ de Cirugía . 71 (11): 647–9. doi : 10.1046 / j.1445-1433.2001.02231.x . PMID 11736823 . S2CID 7571197 .
- ↑ a b Lamas CC, Eykyn SJ (marzo de 2003). "Endocarditis con hemocultivo negativo: análisis de 63 casos que se presentan durante 25 años" . Corazón . 89 (3): 258–62. doi : 10.1136 / corazón.89.3.258 . PMC 1767579 . PMID 12591823 .
- ^ Clayton JJ, Baig W, Reynolds GW, Sandoe JA (agosto de 2006). "Endocarditis causada por especies de Propionibacterium: informe de tres casos y revisión de características clínicas y dificultades diagnósticas" . Revista de Microbiología Médica . 55 (Parte 8): 981–987. doi : 10.1099 / jmm.0.46613-0 . PMID 16849716 .
- ^ Dreier J, Szabados F, von Herbay A, Kröger T, Kleesiek K (octubre de 2004). "Infección por Tropheryma whipplei de una bioprótesis valvular acelular de corazón porcino en un paciente que no tenía enfermedad de Whipple intestinal" . Revista de microbiología clínica . 42 (10): 4487–93. doi : 10.1128 / JCM.42.10.4487-4493.2004 . PMC 522317 . PMID 15472298 .
- ^ Dzeing-Ella A, Szwebel TA, Loubinoux J, Coignard S, Bouvet A, Le Jeunne C, Aslangul E (diciembre de 2009). "Endocarditis infecciosa por Citrobacter koseri en un adulto inmunocompetente" . Revista de microbiología clínica . 47 (12): 4185–6. doi : 10.1128 / JCM.00957-09 . PMC 2786675 . PMID 19812281 .
- ^ Masliah-Planchon J, Breton G, Jarlier V, Simon A, Benveniste O, Herson S, Drieux L (junio de 2009). "Endocarditis por Neisseria bacilliformis en un paciente con válvula aórtica bicúspide" . Revista de microbiología clínica . 47 (6): 1973–5. doi : 10.1128 / JCM.00026-09 . PMC 2691068 . PMID 19386832 .
- ↑ a b Yuan SM (2016). "Endocarditis micótica" . Revista Brasileña de Cirugía Cardiovascular . 31 (3): 252-255. doi : 10.5935 / 1678-9741.20160026 . PMC 5062704 . PMID 27737409 .
- ^ Izumi K, Hisata Y, Hazama S (octubre de 2009). "Un caso raro de endocarditis infecciosa complicada por fungemia por Trichosporon asahii tratada mediante cirugía". Anales de Cirugía Torácica y Cardiovascular . 15 (5): 350–3. PMID 19901894 .
- ↑ a b c d e f g h Hoen B, Duval X (abril de 2013). "Práctica clínica. Endocarditis infecciosa". La Revista de Medicina de Nueva Inglaterra . 368 (15): 1425–33. doi : 10.1056 / NEJMcp1206782 . PMID 23574121 .
- ^ a b Wilson W, Taubert KA, Gewitz M, Lockhart PB, Baddour LM, Levison M, et al. (Octubre de 2007). "Prevención de la endocarditis infecciosa: directrices de la Asociación Estadounidense del Corazón: una directriz del Comité de Fiebre Reumática, Endocarditis y Enfermedad de Kawasaki de la Asociación Estadounidense del Corazón, el Consejo de Enfermedades Cardiovasculares en los Jóvenes y el Consejo de Cardiología Clínica, el Consejo de Cirugía Cardiovascular y Anestesia y el Grupo de Trabajo Interdisciplinario de Investigación de Calidad de Atención y Resultados " . Circulación . 116 (15): 1736–54. doi : 10.1161 / CIRCULATIONAHA.106.183095 . PMID 17446442 .
- ^ Zadik Y, Findler M, Livne S, Levin L, Elad S (diciembre de 2008). "Conocimiento e implementación de los dentistas de las directrices de 2007 de la American Heart Association para la prevención de la endocarditis infecciosa" . Cirugía Bucal, Medicina Bucal, Patología Bucal, Radiología Bucal y Endodoncia . 106 (6): e16–9. doi : 10.1016 / j.tripleo.2008.08.009 . PMID 19000604 .
- ^ Elad S, Binenfeld-Alon E, Zadik Y, Aharoni M, Findler M (marzo de 2011). "Encuesta de aceptación de las directrices de 2007 de la American Heart Association para la prevención de la endocarditis infecciosa: un estudio piloto" . Quintessence International . 42 (3): 243–51. PMID 21465012 . Archivado desde el original el 22 de diciembre de 2015.
- ↑ a b Durack DT, Lukes AS, Bright DK (marzo de 1994). "Nuevos criterios para el diagnóstico de endocarditis infecciosa: utilización de hallazgos ecocardiográficos específicos. Servicio de Endocarditis de Duke". La Revista Estadounidense de Medicina . 96 (3): 200–9. doi : 10.1016 / 0002-9343 (94) 90143-0 . PMID 8154507 .
- ↑ a b Weisse AB, Heller DR, Schimenti RJ, Montgomery RL, Kapila R (marzo de 1993). "El usuario de drogas parenterales febriles: un estudio prospectivo en 121 pacientes". La Revista Estadounidense de Medicina . 94 (3): 274–80. doi : 10.1016 / 0002-9343 (93) 90059-X . PMID 8452151 .
- ↑ a b Samet JH, Shevitz A, Fowle J, Singer DE (julio de 1990). "Decisión de hospitalización en usuarios febriles de drogas intravenosas". La Revista Estadounidense de Medicina . 89 (1): 53–7. doi : 10.1016 / 0002-9343 (90) 90098-X . PMID 2368794 .
- ↑ a b c Marantz PR, Linzer M, Feiner CJ, Feinstein SA, Kozin AM, Friedland GH (junio de 1987). "Incapacidad para predecir el diagnóstico en toxicómanos febriles por vía intravenosa". Annals of Internal Medicine . 106 (6): 823–8. doi : 10.7326 / 0003-4819-106-6-823 . PMID 3579068 .
- ↑ a b Leibovici L, Cohen O, Wysenbeek AJ (junio de 1990). "Infección bacteriana oculta en adultos con fiebre inexplicable. Validación de un índice de diagnóstico". Archivos de Medicina Interna . 150 (6): 1270–2. doi : 10.1001 / archinte.150.6.1270 . PMID 2353860 .
- ↑ a b Mellors JW, Horwitz RI, Harvey MR, Horwitz SM (abril de 1987). "Un índice simple para identificar la infección bacteriana oculta en adultos con fiebre aguda inexplicable". Archivos de Medicina Interna . 147 (4): 666–71. doi : 10.1001 / archinte.147.4.666 . PMID 3827454 .
- ^ Yu CW, Juan LI, Hsu SC, Chen CK, Wu CW, Lee CC, Wu JY (junio de 2013). "Papel de la procalcitonina en el diagnóstico de endocarditis infecciosa: un metaanálisis". The American Journal of Emergency Medicine . 31 (6): 935–41. doi : 10.1016 / j.ajem.2013.03.008 . PMID 23601504 .
- ^ Shively BK, Gurule FT, Roldan CA, Leggett JH, Schiller NB (agosto de 1991). "Valor diagnóstico de la ecocardiografía transesofágica en comparación con la transtorácica en la endocarditis infecciosa" . Revista del Colegio Americano de Cardiología . 18 (2): 391–7. doi : 10.1016 / 0735-1097 (91) 90591-V . PMID 1856406 .
- ^ Erbel R, Rohmann S, Drexler M, Mohr-Kahaly S, Gerharz CD, Iversen S, Oelert H, Meyer J (enero de 1988). "Mejora del valor diagnóstico de la ecocardiografía en pacientes con endocarditis infecciosa por abordaje transesofágico. Un estudio prospectivo". European Heart Journal . 9 (1): 43–53. doi : 10.1093 / oxfordjournals.eurheartj.a062389 . PMID 3345769 .
- ^ a b c "UOTW # 27 - Ultrasonido de la semana" . Ecografía de la semana . 26 de noviembre de 2014. Archivado desde el original el 9 de mayo de 2017 . Consultado el 27 de mayo de 2017 .
- ^ "UOTW # 60 - Ultrasonido de la semana" . Ecografía de la semana . 5 de octubre de 2015. Archivado desde el original el 9 de mayo de 2017 . Consultado el 27 de mayo de 2017 .
- ^ Li JS, Sexton DJ, Mick N, Nettles R, Fowler VG, Ryan T, Bashore T, Corey GR (abril de 2000). "Modificaciones propuestas a los criterios de Duke para el diagnóstico de endocarditis infecciosa" . Enfermedades Clínicas Infecciosas . 30 (4): 633–8. doi : 10.1086 / 313753 . PMID 10770721 .
- ^ Kaech C, Elzi L, Sendi P, Frei R, Laifer G, Bassetti S, Fluckiger U (abril de 2006). "Curso y resultado de la bacteriemia por Staphylococcus aureus: un análisis retrospectivo de 308 episodios en un centro de atención terciario suizo" . Microbiología clínica e infección . 12 (4): 345–52. doi : 10.1111 / j.1469-0691.2005.01359.x . PMID 16524411 .
- ^ "Profilaxis contra la endocarditis infecciosa: Profilaxis antimicrobiana contra la endocarditis infecciosa en adultos y niños sometidos a procedimientos intervencionistas" . Guías clínicas NICE . Instituto Nacional de Atención y Excelencia Sanitaria (Reino Unido). Marzo de 2008. Archivado desde el original el 26 de enero de 2013 . Consultado el 30 de abril de 2013 .
- ^ Glenny AM, Roberts GJ, Hooper L, Worthington HV (2013). "Antibióticos para la profilaxis de la endocarditis bacteriana en odontología". Base de datos Cochrane de revisiones sistemáticas (10): CD003813. doi : 10.1002 / 14651858.CD003813.pub4 . PMID 24108511 : a través de Cochrane.
- ^ "Profilaxis contra endocarditis infecciosa: profilaxis antimicrobiana contra endocarditis infecciosa en adultos y niños sometidos a procedimientos intervencionistas". Instituto Nacional de Excelencia en Salud y Atención (NICE) . 2008.
- ^ "Receta de medicamentos" . SDCEP . Consultado el 25 de enero de 2018 .
- ^ Cosgrove SE, Vigliani GA, Fowler VG, Abrutyn E, Corey GR, Levine DP, Rupp ME, Chambers HF, Karchmer AW, Boucher HW (marzo de 2009). "La gentamicina en dosis baja inicial para la bacteriemia y endocarditis por Staphylococcus aureus es nefrotóxica" . Enfermedades Clínicas Infecciosas . 48 (6): 713-21. doi : 10.1086 / 597031 . PMID 19207079 .
- ^ a b c d Baddour LM, Wilson WR, Bayer AS, Fowler VG, Bolger AF, Levison ME, et al. (Junio de 2005). "Endocarditis infecciosa: diagnóstico, terapia antimicrobiana y manejo de complicaciones: una declaración para los profesionales de la salud del Comité de Fiebre Reumática, Endocarditis y Enfermedad de Kawasaki, el Consejo de Enfermedades Cardiovasculares en los Jóvenes y los Consejos de Cardiología Clínica, Accidente Cerebrovascular y Cirugía cardiovascular y anestesia, American Heart Association: avalada por la Infectious Diseases Society of America " . Circulación . 111 (23): e394–434. doi : 10.1161 / CIRCULATIONAHA.105.165564 . PMID 15956145 .
- ^ Kalavakunta JK, Davenport DS, Tokala H, King A, Khagny M, Gupta V (enero de 2011). "Endocarditis destructiva por Abiotrophia defectiva". The Journal of Heart Valve Disease . 20 (1): 111–2. PMID 21404910 .
- ^ Bonow RO, Carabello BA, Chatterjee K, de Leon AC, Faxon DP, Freed MD, et al. (Septiembre de 2008). "Actualización centrada en 2008 incorporada en las directrices de 2006 de ACC / AHA para el tratamiento de pacientes con valvulopatías cardíacas: un informe del Grupo de trabajo sobre directrices de práctica del Colegio Estadounidense de Cardiología / Asociación Estadounidense del Corazón (Comité de redacción para revisar las directrices de 1998 para el tratamiento de pacientes con valvulopatías). Avalado por la Sociedad de Anestesiólogos Cardiovasculares, la Sociedad de Angiografía e Intervenciones Cardiovasculares y la Sociedad de Cirujanos Torácicos " . Revista del Colegio Americano de Cardiología . 52 (13): e1-142. doi : 10.1016 / j.jacc.2008.05.007 .PMID 18848134 .
- ^ Anantha Narayanan M, Mahfood Haddad T, Kalil AC, Kanmanthareddy A, Suri RM, Mansour G, Destache CJ, Baskaran J, Mooss AN, Wichman T, Morrow L, Vivekanandan R (2016). "Intervención quirúrgica temprana versus tardía o tratamiento médico para la endocarditis infecciosa: una revisión sistemática y un metanálisis". Corazón . 102 (12): 950–7. doi : 10.1136 / heartjnl-2015-308589 . PMID 26869640 . S2CID 12007082 . CS1 maint: varios nombres: lista de autores ( enlace )
Enlaces externos
| Clasificación | D
|
|---|---|
| Recursos externos |
|
Endocarditis infecciosa en Curlie