Encefalomielitis diseminada aguda
| Encefalomielitis diseminada aguda | |
|---|---|
| Otros nombres | Encefalomielitis desmielinizante aguda |
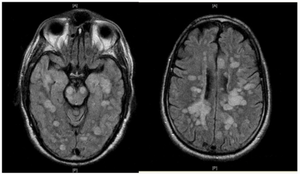 | |
| ADEM fulminante que muestra muchas lesiones. El paciente sobrevivió, pero permaneció en un estado vegetativo persistente. | |
| Especialidad | Neurología |
La encefalomielitis diseminada aguda ( ADEM ), o encefalomielitis desmielinizante aguda , es una enfermedad autoinmune rara caracterizada por un ataque repentino y generalizado de inflamación en el cerebro y la médula espinal . Además de hacer que el cerebro y la médula espinal se inflamen, ADEM también ataca los nervios del sistema nervioso central y daña su aislamiento de mielina, lo que, como resultado, destruye la sustancia blanca . A menudo se desencadena por una infección viral o (muy raramente) por vacunas . [1] [2] [3] [4] [5] [6]
Los síntomas de ADEM se asemejan a los síntomas de la esclerosis múltiple (EM), por lo que la enfermedad en sí se clasifica en la clasificación de enfermedades limítrofes de la esclerosis múltiple . Sin embargo, ADEM tiene varias características que lo distinguen de la EM. [7] A diferencia de la EM, la ADEM se presenta generalmente en niños y se caracteriza por fiebre rápida, aunque los adolescentes y adultos también pueden contraer la enfermedad. La ADEM consiste en un solo brote, mientras que la EM se caracteriza por varios brotes (o recaídas) durante un largo período de tiempo. Las recaídas después de ADEM se informan hasta en una cuarta parte de los pacientes, pero la mayoría de estas presentaciones "multifásicas" después de ADEM probablemente representan EM. [8]La ADEM también se distingue por pérdida del conocimiento, coma y muerte, lo que es muy raro en la EM, excepto en casos graves.
Afecta aproximadamente a 8 de cada 1.000.000 de personas por año. [9] Aunque ocurre en todas las edades, la mayoría de los casos notificados son en niños y adolescentes , con una edad promedio de entre 5 y 8 años. [10] [11] [12] [13] La enfermedad afecta a hombres y mujeres casi por igual. [14] El ADEM muestra una variación estacional con mayor incidencia en los meses de invierno y primavera, lo que puede coincidir con mayores infecciones virales durante estos meses. [13] La tasa de mortalidad puede llegar al 5%; sin embargo, se observa una recuperación completa en el 50 al 75% de los casos con un aumento en las tasas de supervivencia de hasta el 70 al 90% con cifras que incluyen también una discapacidad residual leve. [15] El tiempo promedio para recuperarse de los brotes de ADEM es de uno a seis meses.
ADEM produce múltiples lesiones inflamatorias en el cerebro y la médula espinal , particularmente en la sustancia blanca . Por lo general, se encuentran en la sustancia blanca central y subcortical y en la unión cortical gris-blanca de ambos hemisferios cerebrales , cerebelo , tronco del encéfalo y médula espinal, [16] pero la sustancia blanca periventricular y la sustancia gris de la corteza , los tálamos y los ganglios basales también pueden estar involucrado.
Cuando una persona tiene más de un episodio desmielinizante de ADEM, la enfermedad se denomina encefalomielitis diseminada recurrente [17] o encefalomielitis diseminada multifásica [18] ( MDEM ). Además, se ha descrito un curso fulminante en adultos. [19]
Signos y síntomas
ADEM tiene un inicio abrupto y un curso monofásico. Los síntomas generalmente comienzan de 1 a 3 semanas después de la infección. Los síntomas principales incluyen fiebre , dolor de cabeza , náuseas y vómitos , confusión , problemas de visión , somnolencia, convulsiones y coma . Aunque inicialmente los síntomas suelen ser leves, empeoran rápidamente en el transcurso de horas o días, siendo el tiempo medio hasta la máxima gravedad de unos cuatro días y medio. [20] Los síntomas adicionales incluyen hemiparesia, paraparesia y parálisis de pares craneales. [21]
ADEM en COVID-19
Los síntomas neurológicos fueron la presentación principal de COVID-19, que no se correlacionó con la gravedad de los síntomas respiratorios. Llama la atención la alta incidencia de ADEM con hemorragia. Es probable que la inflamación del cerebro sea causada por una respuesta inmune a la enfermedad más que por neurotropismo. El análisis del LCR no fue indicativo de un proceso infeccioso, no hubo deterioro neurológico en la fase aguda de la infección y los hallazgos de neuroimagen no fueron típicos de los trastornos tóxicos y metabólicos clásicos. El hallazgo de lesiones periventriculares bilaterales relativamente asimétricas asociadas con afectación profunda de la sustancia blanca, que también pueden estar presentes en la unión cortical de sustancia gris-blanca, tálamos, ganglios basales, cerebelo y tronco encefálico, sugiere un proceso de desmielinización aguda. [22]Además, también se encontraron en la sustancia blanca subcortical lesiones hemorrágicas de la sustancia blanca, grupos de macrófagos relacionados con la lesión axonal y apariencia similar a ADEM. [23]
Causas
Desde el descubrimiento de la especificidad de anti- MOG contra el diagnóstico de esclerosis múltiple [24] , se considera que la ADEM es una de las posibles causas clínicas de encefalomielitis asociada a anti-MOG [25].
Sobre cómo aparecen los anticuerpos anti-MOG en el suero de los pacientes, existen varias teorías:
- Se puede identificar un desafío antigénico anterior en aproximadamente dos tercios de las personas. [14] Algunas infecciones virales que se cree que inducen ADEM incluyen virus de la influenza , dengue , [26] enterovirus , sarampión , [27] paperas , rubéola , varicela zoster , virus de Epstein-Barr , citomegalovirus , virus del herpes simple , hepatitis A , coxsackievirus y COVID. -19 . [22] [28] Las infecciones bacterianas incluyen Mycoplasma pneumoniae, Borrelia burgdorferi , Leptospira y estreptococos beta-hemolíticos . [29]
- Exposición a las vacunas: La única vacuna relacionada con ADEM es la forma Semple de la vacuna contra la rabia , pero las vacunas contra la hepatitis B , la tos ferina , la difteria , el sarampión, las paperas, la rubéola, el neumococo , la varicela , la influenza, la encefalitis japonesa y la polio están implicadas. . La mayoría de los estudios que correlacionan la vacunación con el inicio de ADEM utilizan pequeñas muestras o estudios de casos. [ cita requerida ] Los estudios epidemiológicos a gran escala (por ejemplo, de la vacuna MMR o la vacuna contra la viruela) no muestran un mayor riesgo de ADEM después de la vacunación. [9] [30] [31][32] [20] [33] [34] [35] [36] [37] [38] Un límite superior para el riesgo de ADEM por la vacunación contra el sarampión , si existe, puede estimarse en 10 por millón, [ 39], que es mucho menor que el riesgo de desarrollar ADEM a partir de una infección real de sarampión, que es de aproximadamente 1 por cada 1.000 casos. Para una infección por rubéola, el riesgo es de 1 por cada 5,000 casos. [33] [40] Algunas vacunas tempranas, que luego se demostró que estaban contaminadas contejido del SNC del animal huésped, tenían tasas de incidencia de ADEM tan altas como 1 en 600. [30]
- En casos raros, ADEM parece ser el resultado de un trasplante de órganos . [20]
Diagnóstico
El término ADEM se ha utilizado de manera incoherente en diferentes momentos. [41] Actualmente, el estándar internacional comúnmente aceptado para la definición de caso clínico es el publicado por el International Pediatric MS Study Group , revisión 2007. [42]
Dado que la definición es clínica, actualmente se desconoce si todos los casos con ADEM son positivos para el autoanticuerpo anti- MOG , pero en cualquier caso, parece estar fuertemente relacionado con el diagnóstico de ADEM. [25]
Diagnóstico diferencial
Esclerosis múltiple
Si bien ADEM y MS implican desmielinización autoinmune, difieren en muchos aspectos clínicos, genéticos, de imagen e histopatológicos. [14] [43] Algunos autores consideran que la EM y sus formas limítrofes constituyen un espectro, que sólo difiere en cronicidad, gravedad y curso clínico, [44] [45] mientras que otros las consideran enfermedades discretamente diferentes. [6]
Por lo general, ADEM aparece en niños después de un desafío antigénico y permanece monofásico. Sin embargo, la ADEM ocurre en adultos, [8] [12] y también puede ser clínicamente multifásica. [46]
Los problemas para el diagnóstico diferencial aumentan debido a la falta de acuerdo para una definición de esclerosis múltiple. [47] Si la EM se definiera simplemente por la separación en el tiempo y el espacio de las lesiones desmielinizantes como lo hizo McDonald , [48] no sería suficiente para marcar una diferencia, ya que algunos casos de ADEM satisfacen estas condiciones. Por tanto, algunos autores proponen establecer la línea de separación en la forma de las lesiones alrededor de las venas, siendo por tanto "desmielinización perivenosa vs. confluente". [47] [49]
La patología de ADEM es muy similar a la de la EM con algunas diferencias. El sello patológico de ADEM es la inflamación perivenular con "mangas de desmielinización" limitadas. [50] [14] Sin embargo, pueden aparecer placas similares a la EM (desmielinización confluente) [51]
Las placas en la sustancia blanca en la EM están claramente delineadas, mientras que la cicatriz glial en ADEM es lisa. Los axones se conservan mejor en las lesiones ADEM. La inflamación en la ADEM está muy diseminada y mal definida y, finalmente, las lesiones son estrictamente perivenosas, mientras que en la EM se disponen alrededor de las venas, pero no de forma tan aguda. [52]
Sin embargo, la co-ocurrencia de desmielinización perivenosa y confluente en algunos individuos sugiere una superposición patogénica entre encefalomielitis diseminada aguda y esclerosis múltiple y clasificación errónea incluso con biopsia [49] o incluso post mortem [51] La ADEM en adultos puede progresar a EM [12]
Encefalomielitis diseminada multifásica
Cuando la persona tiene más de un episodio desmielinizante de ADEM, la enfermedad se denomina encefalomielitis diseminada recurrente o encefalomielitis diseminada multifásica [18] (MDEM).
Se ha encontrado que los autoanticuerpos anti- MOG están relacionados con este tipo de ADEM [53].
Se ha descrito otra variante de ADEM en adultos, también relacionada con los autoanticuerpos anti-MOG, que se ha denominado encefalomielitis diseminada fulminante, y se ha informado que es ADEM clínicamente, pero que muestra lesiones similares a la EM en la autopsia. [19] Se ha clasificado dentro de las enfermedades desmielinizantes inflamatorias asociadas a anti-MOG . [54]
Leucoencefalitis hemorrágica aguda
La leucoencefalitis hemorrágica aguda (AHL o AHLE), encefalomielitis hemorrágica aguda (AHEM), leucoencefalitis hemorrágica necrotizante aguda (ANHLE), síndrome de Weston-Hurst o enfermedad de Hurst, es una forma hiperaguda y frecuentemente fatal de ADEM. La AHL es relativamente rara (se han informado menos de 100 casos en la literatura médica hasta 2006 [actualizar]), [55] se observa en aproximadamente el 2% de los casos de ADEM, [20] y se caracteriza por vasculitis necrotizante de las vénulas y hemorragia, y edema. [56] La muerte es común en la primera semana [57] y la mortalidad general es de alrededor del 70%, [55]pero cada vez hay más pruebas que apuntan a resultados favorables después de un tratamiento agresivo con corticosteroides, inmunoglobulinas, ciclofosfamida y recambio plasmático. [29] Aproximadamente el 70% de los supervivientes muestran déficits neurológicos residuales, [56] pero algunos supervivientes han mostrado un déficit sorprendentemente pequeño considerando la magnitud de la sustancia blanca afectada. [57]
Esta enfermedad se ha asociado ocasionalmente con colitis ulcerosa y enfermedad de Crohn , malaria , [58] sepsis asociada con depósito de inmunocomplejos, intoxicación por metanol y otras afecciones subyacentes. También se ha informado una asociación anecdótica con la EM [59].
Los estudios de laboratorio que apoyan el diagnóstico de AHL son: leucocitosis periférica, pleocitosis del líquido cefalorraquídeo (LCR) asociada con glucosa normal y aumento de proteínas. En la resonancia magnética (MRI), las lesiones de AHL muestran típicamente hiperintensidades extensas de la sustancia blanca ponderadas en T2 y con recuperación de inversión atenuada por líquido (FLAIR) con áreas de hemorragias, edema significativo y efecto de masa. [60]
Tratamiento
No se han realizado ensayos clínicos controlados sobre el tratamiento con ADEM, pero el tratamiento agresivo dirigido a reducir rápidamente la inflamación del SNC es estándar. El tratamiento de primera línea ampliamente aceptado son dosis altas de corticosteroides intravenosos , [61] como metilprednisolona o dexametasona , seguidas de tres a seis semanas de dosis orales gradualmente más bajas de prednisolona . Los pacientes tratados con metilprednisolona han mostrado mejores resultados que los tratados con dexametasona. [20] Los ajustes orales de menos de tres semanas de duración muestran una mayor probabilidad de recaída, [11] [18] y tienden a mostrar peores resultados. [[cita requerida ]Se ha informado que otras terapias antiinflamatorias e inmunosupresoras muestran efectos beneficiosos, como laplasmaféresis, altas dosis deinmunoglobulinaintravenosa(IgIV),[61][62] mitoxantronayciclofosfamida. Se consideran terapias alternativas, que se utilizan cuando los corticosteroides no se pueden utilizar o no logran mostrar un efecto.[ cita requerida ]
Existe alguna evidencia que sugiere que los pacientes pueden responder a una combinación de metilprednisolona e inmunoglobulinas si no responden a ninguna de las dos por separado [63] En un estudio de 16 niños con ADEM, 10 se recuperaron completamente después de dosis altas de metilprednisolona, un caso grave que no respondió a los esteroides se recuperó por completo después de la Ig IV; los cinco casos más graves, con ADAM y neuropatía periférica grave , se trataron con metilprednisolona e inmunoglobulina en dosis altas combinadas, dos permanecieron parapléjicos, uno tenía discapacidades motoras y cognitivas y dos se recuperaron. [61]Una revisión reciente del tratamiento con IgIV de ADEM (del cual el estudio anterior formó la mayor parte de los casos) encontró que el 70% de los niños mostraron una recuperación completa después del tratamiento con IgIV o IgIV más corticosteroides. [64] Un estudio del tratamiento con IgIV en adultos con ADEM mostró que la IgIV parece más eficaz para tratar las alteraciones sensoriales y motoras, mientras que los esteroides parecen más eficaces para tratar las alteraciones de la cognición, la conciencia y el rigor. [62] Este mismo estudio encontró un sujeto, un hombre de 71 años que no había respondido a los esteroides, que respondió a un tratamiento con IgIV 58 días después del inicio de la enfermedad. [ cita requerida ]
Pronóstico
La recuperación completa se observa en el 50 al 70% de los casos, con un rango de recuperación del 70 al 90% con alguna discapacidad residual menor (generalmente evaluada usando medidas como mRS o EDSS ), el tiempo promedio para recuperarse es de uno a seis meses. [15] La tasa de mortalidad puede llegar al 5% al 10%. [15] [65] Los peores resultados se relacionan con la falta de respuesta al tratamiento con esteroides, síntomas neurológicos inusualmente graves o aparición repentina. Los niños tienden a tener resultados más favorables que los adultos, y los casos que se presentan sin fiebre tienden a tener peores resultados. [66] Este último efecto puede deberse a los efectos protectores de la fiebre oa que el diagnóstico y el tratamiento se buscan más rápidamente cuando hay fiebre. [cita requerida ]
ADEM puede progresar a EM. Se considerará EM si algunas lesiones aparecen en diferentes momentos y áreas del cerebro [67].
Déficits motores
Se estima que los déficits motores residuales permanecen en aproximadamente el 8 al 30% de los casos, el rango de gravedad desde torpeza leve hasta ataxia y hemiparesia . [29]
Neurocognitivo
Los pacientes con enfermedades desmielinizantes, como la EM, han mostrado déficits cognitivos incluso cuando existe una discapacidad física mínima. [68] La investigación sugiere que se observan efectos similares después de ADEM, pero que los déficits son menos graves que los observados en la EM. En un estudio de seis niños con ADEM (edad media de presentación 7,7 años) se evaluó una serie de pruebas neurocognitivas después de un promedio de 3,5 años de recuperación. [69] Los seis niños realizan en el rango normal en la mayoría de las pruebas, incluyendo el CI verbal y el CI de rendimiento , pero que se realiza al menos una desviación estándar por debajo de las normas de edad en al menos un dominio cognitivo, tales como la atención complejo (un niño), a corto memoria a término(un niño) y comportamiento / afecto internalizante (dos niños). Las medias de grupo para cada dominio cognitivo estaban todas dentro de una desviación estándar de las normas de edad, lo que demuestra que, como grupo, eran normales. Estos déficits fueron menos graves que los observados en niños de edades similares con diagnóstico de EM. [70]
Otro estudio comparó diecinueve niños con antecedentes de ADEM, de los cuales 10 tenían cinco años o menos en ese momento (edad promedio 3.8 años, evaluados un promedio de 3.9 años después) y nueve eran mayores (edad promedio 7.7 años en ese momento). de ADEM, probado un promedio de 2,2 años más tarde) a diecinueve controles emparejados. [71]Las puntuaciones en las pruebas de CI y el rendimiento educativo fueron más bajas para el grupo ADEM de inicio temprano (CI promedio 90) en comparación con los grupos de inicio tardío (CI promedio 100) y los grupos de control (CI promedio 106), mientras que los niños ADEM de inicio tardío obtuvieron calificaciones más bajas en el procesamiento verbal velocidad. Nuevamente, las medias de todos los grupos estuvieron dentro de una desviación estándar de los controles, lo que significa que, si bien los efectos fueron estadísticamente confiables, los niños en su conjunto todavía se encontraban dentro del rango normal. También hubo más problemas de comportamiento en el grupo de inicio temprano, aunque hay algunos indicios de que esto puede deberse, al menos en parte, al estrés de la hospitalización a una edad temprana. [72] [73]
Investigar
Actualmente se está investigando la relación entre ADEM y encefalomielitis asociada a anti-MOG . Se ha propuesto una nueva entidad denominada MOGDEM. [74]
Acerca de los modelos animales, el principal modelo animal para la EM, la encefalomielitis autoinmune experimental (EAE) es también un modelo animal para ADEM. [75] Al ser una enfermedad monofásica aguda, la EAE es mucho más similar a la ADEM que a la EM. [76]
Ver también
- Neuritis óptica
- Mielitis transversa
- Victoria Arlen
Referencias
- ^ Dale RC (abril de 2003). "Encefalomielitis aguda diseminada". Seminarios en Enfermedades Infecciosas Pediátricas . 14 (2): 90–95. doi : 10.1053 / spid.2003.127225 . PMID 12881796 .
- ^ Garg RK (enero de 2003). "Encefalomielitis aguda diseminada" . Revista Médica de Postgrado . 79 (927): 11-17. doi : 10.1136 / pmj.79.927.11 . PMC 1742586 . PMID 12566545 .
- ^ Jones CT (noviembre de 2003). "Enfermedades neurológicas autoinmunes infantiles del sistema nervioso central". Clínicas neurológicas . 21 (4): 745–64. doi : 10.1016 / S0733-8619 (03) 00007-0 . PMID 14743647 .
- ^ Huynh W, Cordato DJ, Kehdi E, Masters LT, Dedousis C (diciembre de 2008). "Encefalomielitis posvacunación: revisión de la literatura y caso ilustrativo" . Revista de neurociencia clínica . 15 (12): 1315-22. doi : 10.1016 / j.jocn.2008.05.002 . PMC 7125578 . PMID 18976924 .
- ^ Rust RS (junio de 2000). "Esclerosis múltiple, encefalomielitis diseminada aguda y afecciones relacionadas". Seminarios de Neurología Pediátrica . 7 (2): 66–90. doi : 10.1053 / pb.2000.6693 . PMID 10914409 .
- ↑ a b Poser CM, Brinar VV (octubre de 2007). "Encefalomielitis diseminada y esclerosis múltiple: dos enfermedades diferentes - una revisión crítica". Acta Neurologica Scandinavica . 116 (4): 201–06. doi : 10.1111 / j.1600-0404.2007.00902.x . PMID 17824894 . S2CID 44411472 .
- ^ Krupp LB, Banwell B, Tenembaum S (abril de 2007). "Definiciones de consenso propuestas para la esclerosis múltiple pediátrica y trastornos relacionados" (PDF) . Neurología . 68 (16 Suppl 2): S7-12. doi : 10.1212 / 01.wnl.0000259422.44235.a8 . PMID 17438241 . S2CID 26001350 . Archivado desde el original (PDF) el 9 de febrero de 2015.
- ^ a b Koelman DL, Chahin S, Mar SS, Venkatesan A, Hoganson GM, Yeshokumar AK, et al. (Mayo de 2016). "Encefalomielitis diseminada aguda en 228 pacientes: un estudio retrospectivo, multicéntrico de Estados Unidos". Neurología . 86 (22): 2085–93. doi : 10.1212 / WNL.0000000000002723 . PMID 27164698 . S2CID 20818721 .
- ^ a b Leake JA, Albani S, Kao AS, Senac MO, Billman GF, Nespeca MP, et al. (Agosto de 2004). "Encefalomielitis aguda diseminada en la infancia: características epidemiológicas, clínicas y de laboratorio". The Pediatric Infectious Disease Journal . 23 (8): 756–64. doi : 10.1097 / 01.inf.0000133048.75452.dd . PMID 15295226 . S2CID 31668039 .
- ^ Hynson JL, Kornberg AJ, Coleman LT, Shield L, Harvey AS, Kean MJ (mayo de 2001). "Características clínicas y neurorradiológicas de la encefalomielitis diseminada aguda en niños". Neurología . 56 (10): 1308-12. doi : 10.1212 / WNL.56.10.1308 . PMID 11376179 . S2CID 23898511 .
- ^ a b Anlar B, Basaran C, Kose G, Guven A, Haspolat S, Yakut A, et al. (Agosto de 2003). "Encefalomielitis aguda diseminada en niños: evolución y pronóstico". Neuropediatría . 34 (4): 194–99. doi : 10.1055 / s-2003-42208 . PMID 12973660 .
- ↑ a b c Schwarz S, Mohr A, Knauth M, Wildemann B, Storch-Hagenlocher B (mayo de 2001). "Encefalomielitis aguda diseminada: un estudio de seguimiento de 40 pacientes adultos". Neurología . 56 (10): 1313–18. doi : 10.1212 / WNL.56.10.1313 . PMID 11376180 . S2CID 25391094 .
- ^ a b Bhatt P, Bray L, Raju S, Dapaah-Siakwan F, Patel A, Chaudhari R, et al. (Marzo de 2019). "Tendencias temporales de hospitalizaciones pediátricas con encefalomielitis diseminada aguda en los Estados Unidos: un análisis de 2006 a 2014 utilizando la muestra nacional de pacientes hospitalizados". La Revista de Pediatría . 206 : 26–32.e1. doi : 10.1016 / j.jpeds.2018.10.044 . PMID 30528761 . S2CID 54478510 .
- ↑ a b c d Koelman DL, Mateen FJ (septiembre de 2015). "Encefalomielitis aguda diseminada: controversias actuales en el diagnóstico y resultado". Revista de Neurología . 262 (9): 2013–24. doi : 10.1007 / s00415-015-7694-7 . PMID 25761377 . S2CID 26642207 .
- ↑ a b c Menge T, Kieseier BC, Nessler S, Hemmer B, Hartung HP, Stüve O (junio de 2007). "Encefalomielitis aguda diseminada: un golpe agudo contra el cerebro". Opinión actual en neurología . 20 (3): 247–54. doi : 10.1097 / WCO.0b013e3280f31b45 . PMID 17495616 . S2CID 14049476 .
- ^ Wingerchuk DM (mayo de 2003). "Encefalomielitis posinfecciosa". Informes actuales de neurología y neurociencia . 3 (3): 256–64. doi : 10.1007 / s11910-003-0086-x . PMID 12691631 . S2CID 453016 .
- ^ Poser CM (mayo de 2008). "La esclerosis múltiple y la encefalomielitis diseminada recurrente son enfermedades diferentes". Archivos de Neurología . 65 (5): 674, respuesta del autor 674–75. doi : 10.1001 / archneur.65.5.674-a . PMID 18474749 .
- ^ a b c Dale RC, de Sousa C, Chong WK, Cox TC, Harding B, Neville BG (diciembre de 2000). "Encefalomielitis diseminada aguda, encefalomielitis diseminada multifásica y esclerosis múltiple en niños" . Cerebro . 123 (12): 2407-22. doi : 10.1093 / cerebro / 123.12.2407 . PMID 11099444 .
- ^ a b Di Pauli F, Höftberger R, Reindl M, Beer R, Rhomberg P, Schanda K, et al. (Diciembre de 2015). "Encefalomielitis desmielinizante fulminante: conocimientos de estudios de anticuerpos y neuropatología" . Neurología . 2 (6): e175. doi : 10.1212 / NXI.0000000000000175 . PMC 4635550 . PMID 26587556 .
- ↑ a b c d e Tenembaum S, Chamoles N, Fejerman N (octubre de 2002). "Encefalomielitis diseminada aguda: un estudio de seguimiento a largo plazo de 84 pacientes pediátricos". Neurología . 59 (8): 1224–31. doi : 10.1212 / WNL.59.8.1224 . PMID 12391351 . S2CID 37405227 .
- ^ Allmendinger A, Krauthamer A, Spektor V (2009). "Encefalomielitis aguda diseminada" . Diagnóstico por imágenes . Caso del mes. 31 (12): 10. Archivado desde el original el 24 de febrero de 2011.
- ^ a b Manikanta AK, Pradeep GV, Pydi R, Chanumolu AR, Joy LA, Kancherla N (14 de junio de 2021). "Encefalomielitis aguda diseminada en COVID 19- Revisión sistemática" . Anales de la Sociedad Rumana de Biología Celular . 25 (6): 11443–50.
- ^ Novi G, Rossi T, Pedemonte E, Saitta L, Rolla C, Roccatagliata L, et al. (Septiembre de 2020). "Encefalomielitis diseminada aguda después de la infección por SARS-CoV-2" . Neurología . 7 (5): e797. doi : 10.1212 / NXI.0000000000000797 . PMC 7286650 . PMID 32482781 .
- ^ Reindl M, Di Pauli F, Rostásy K, Berger T (agosto de 2013). "El espectro de enfermedades desmielinizantes asociadas a autoanticuerpos MOG". Reseñas de la naturaleza. Neurología . 9 (8): 455–61. doi : 10.1038 / nrneurol.2013.118 . PMID 23797245 . S2CID 7219279 .
- ↑ a b Weber MS, Derfuss T, Brück W (agosto de 2018). "Anti-mielina oligodendrocitos glicoproteína Anticuerpo asociado sistema nervioso central desmielinización-una entidad nueva enfermedad?". Neurología JAMA . 75 (8): 909–10. doi : 10.1001 / jamaneurol.2018.1055 . PMID 29913011 .
- ^ Kamel MG, Nam NT, Han NH, El-Shabouny AE, Makram AM, Abd-Elhay FA, et al. (Junio de 2017). "Encefalomielitis diseminada aguda post-dengue: reporte de un caso y metanálisis" . PLOS Enfermedades tropicales desatendidas . 11 (6): e0005715. doi : 10.1371 / journal.pntd.0005715 . PMC 5509372 . PMID 28665957 .
- ^ Fisher DL, Defres S, Solomon T (marzo de 2015). "Encefalitis inducida por sarampión" . QJM . 108 (3): 177–82. doi : 10.1093 / qjmed / hcu113 . PMID 24865261 .
- ^ Muestra I (8 de julio de 2020). "Advertencia de trastornos cerebrales graves en personas con síntomas leves de coronavirus" . The Guardian . ISSN 0261-3077 . Consultado el 8 de julio de 2020 .
- ↑ a b c Tenembaum S, Chitnis T, Ness J, Hahn JS (abril de 2007). Grupo de estudio internacional de EM pediátrica. "Encefalomielitis aguda diseminada". Neurología . 68 (16 Suppl 2): S23–36. doi : 10.1212 / 01.wnl.0000259404.51352.7f . PMID 17438235 . S2CID 19893165 .
- ↑ a b Hemachudha T, Griffin DE, Giffels JJ, Johnson RT, Moser AB, Phanuphak P (febrero de 1987). "Proteína básica de mielina como encefalitógeno en encefalomielitis y polineuritis después de la vacunación contra la rabia". La Revista de Medicina de Nueva Inglaterra . 316 (7): 369–74. doi : 10.1056 / NEJM198702123160703 . PMID 2433582 .
- ^ Hemachudha T, Griffin DE, Johnson RT, Giffels JJ (enero de 1988). "Estudios inmunológicos de pacientes con encefalitis crónica inducida por la vacuna antirrábica de Semple post-exposición". Neurología . 38 (1): 42–44. doi : 10.1212 / WNL.38.1.42 . PMID 2447520 . S2CID 21992894 .
- ^ Murthy JM (septiembre de 2002). "Encefalomielitis aguda diseminada" . Neurology India . 50 (3): 238–43. PMID 12391446 .
- ↑ a b Fenichel GM (agosto de 1982). "Complicaciones neurológicas de la inmunización". Annals of Neurology . 12 (2): 119-28. doi : 10.1002 / ana.410120202 . PMID 6751212 . S2CID 2352985 .
- ^ Takahashi H, Pool V, Tsai TF, Chen RT (julio de 2000). "Eventos adversos después de la vacunación contra la encefalitis japonesa: revisión de los datos de vigilancia poscomercialización de Japón y Estados Unidos. El grupo de trabajo VAERS" . Vacuna . 18 (26): 2963–69. doi : 10.1016 / S0264-410X (00) 00111-0 . PMID 10825597 .
- ^ Tourbah A, Gout O, Liblau R, Lyon-Caen O, Bougniot C, Iba-Zizen MT, Cabanis EA (julio de 1999). "Encefalitis después de la vacunación contra la hepatitis B: ¿encefalitis diseminada recurrente o EM?". Neurología . 53 (2): 396–401. doi : 10.1212 / WNL.53.2.396 . PMID 10430433 . S2CID 25061061 .
- ^ Karaali-Savrun F, Altintaş A, Saip S, Siva A (noviembre de 2001). "¿Vacuna contra la hepatitis B relacionada con la mielitis?". Revista europea de neurología . 8 (6): 711-15. doi : 10.1046 / j.1468-1331.2001.00290.x . PMID 11784358 . S2CID 30784630 .
- ^ Sejvar JJ, Labutta RJ, Chapman LE, Grabenstein JD, Iskander J, Lane JM (diciembre de 2005). "Eventos adversos neurológicos asociados con la vacunación contra la viruela en los Estados Unidos, 2002-2004" . JAMA . 294 (21): 2744–50. doi : 10.1001 / jama.294.21.2744 . PMID 16333010 .
- ^ Ozawa H, Noma S, Yoshida Y, Sekine H, Hashimoto T (agosto de 2000). "Encefalomielitis aguda diseminada asociada a vacuna antipoliomielítica". Neurología pediátrica . 23 (2): 177–79. doi : 10.1016 / S0887-8994 (00) 00167-3 . PMID 11020647 .
- ^ Stratton KR, Howe CJ, Johnston Jr RB, et al. (Comité de Seguridad de Vacunas del Instituto de Medicina (EE. UU.)) (1994). Eventos adversos asociados con las vacunas infantiles: evidencia sobre la causalidad . Prensa de las Academias Nacionales. págs. 125–26. doi : 10.17226 / 2138 . ISBN 978-0-309-07496-4. PMID 25144097 . Consultado el 6 de diciembre de 2015 .
- ^ Gibbons JL, Miller HG, Stanton JB (octubre de 1956). "Encefalomielitis parainfecciosa y síndromes relacionados; una revisión crítica de las complicaciones neurológicas de ciertas fiebres específicas". The Quarterly Journal of Medicine . 25 (100): 427–505. PMID 13379602 .
- ^ Cole J, Evans E, Mwangi M, Mar S (noviembre de 2019). "Encefalomielitis aguda diseminada en niños: una revisión actualizada basada en criterios diagnósticos actuales". Neurología pediátrica . 100 : 26–34. doi : 10.1016 / j.pediatrneurol.2019.06.017 . PMID 31371120 .
- ^ Tenembaum S, Chitnis T, Ness J, Hahn JS (abril de 2007). "Encefalomielitis aguda diseminada". Neurología . 68 (16 Suppl 2): S23–36. doi : 10.1212 / 01.wnl.0000259404.51352.7f . PMID 17438235 . S2CID 19893165 .
- ^ Wingerchuk DM, Lucchinetti CF (junio de 2007). "Inmunopatogénesis comparativa de encefalomielitis diseminada aguda, neuromielitis óptica y esclerosis múltiple". Opinión actual en neurología . 20 (3): 343–50. doi : 10.1097 / WCO.0b013e3280be58d8 . PMID 17495631 . S2CID 17386506 .
- ^ Weinshenker B, Miller D (1999). "Esclerosis múltiple: ¿una enfermedad o muchas?". En Siva A, Kesselring J, Thompson A (eds.). Fronteras en la esclerosis múltiple . Londres: Dunitz. págs. 37–46. ISBN 978-1-85317-506-0.
- ^ Hartung HP, Grossman RI (mayo de 2001). "ADEM: ¿enfermedad distinta o parte del espectro de la EM?". Neurología . 56 (10): 1257–60. doi : 10.1212 / WNL.56.10.1257 . PMID 11376169 .
- ^ Krupp LB, Banwell B, Tenembaum S, et al. (International Pediatric MS Study Group) (abril de 2007). "Definiciones de consenso propuestas para la esclerosis múltiple pediátrica y trastornos relacionados". Neurología . 68 (16 Suppl 2): S7-12. doi : 10.1212 / 01.wnl.0000259422.44235.a8 . PMID 17438241 . S2CID 26001350 .
- ^ a b Lassmann H (febrero de 2010). "Encefalomielitis aguda diseminada y esclerosis múltiple" . Cerebro . 133 (Parte 2): 317-19. doi : 10.1093 / cerebro / awp342 . PMID 20129937 .
- ^ McDonald WI , Compston A , Edan G, Goodkin D, Hartung HP, Lublin FD, et al. (Julio de 2001). "Criterios de diagnóstico recomendados para la esclerosis múltiple: directrices del Panel internacional sobre el diagnóstico de esclerosis múltiple". Annals of Neurology . 50 (1): 121-27. CiteSeerX 10.1.1.466.5368 . doi : 10.1002 / ana.1032 . PMID 11456302 . S2CID 13870943 .
- ^ a b Young NP, Weinshenker BG, Parisi JE, Scheithauer B, Giannini C, Roemer SF, et al. (Febrero de 2010). "Desmielinización perivenosa: asociación con encefalomielitis diseminada aguda clínicamente definida y comparación con esclerosis múltiple confirmada patológicamente" . Cerebro . 133 (Parte 2): 333–48. doi : 10.1093 / cerebro / awp321 . PMC 2822631 . PMID 20129932 .
- ^ Young NP, Weinshenker BG, Lucchinetti CF (febrero de 2008). "Encefalomielitis aguda diseminada: comprensión actual y controversias" . Seminarios de Neurología . 28 (1): 84–94. doi : 10.1055 / s-2007-1019130 . PMID 18256989 .
- ↑ a b Guenther AD, Muñoz DG (2013). "Desmielinización tipo placa en encefalomielitis diseminada aguda (ADEM) - informe de un caso de autopsia". Neuropatología clínica . 32 (6): 486–91. doi : 10.5414 / NP300634 . PMID 23863345 .
- ^ Lu Z, Zhang B, Qiu W, Kang Z, Shen L, Long Y, et al. (2011). "Lesiones comparativas del tronco encefálico en resonancia magnética de encefalomielitis diseminada aguda, neuromielitis óptica y esclerosis múltiple" . PLOS ONE . 6 (8): e22766. Código bibliográfico : 2011PLoSO ... 622766L . doi : 10.1371 / journal.pone.0022766 . PMC 3154259 . PMID 21853047 .
- ^ Baumann M, Hennes EM, Schanda K, Karenfort M, Bajer-Kornek B, Diepold K, et al. (Mayo de 2015). "OP65-3006: características clínicas y hallazgos neurorradiológicos en niños con encefalomielitis desmielinizante multifásica y anticuerpos MOG". Revista europea de neurología pediátrica . Resúmenes del XI Congreso de EPNS. 19 (suplemento 1): S21. doi : 10.1016 / S1090-3798 (15) 30066-0 .
- ^ Baumann M, Hennes EM, Schanda K, Karenfort M, Kornek B, Seidl R, et al. (Diciembre de 2016). "Niños con encefalomielitis diseminada multifásica y anticuerpos contra la glicoproteína de oligodendrocitos de mielina (MOG): ampliación del espectro de enfermedades positivas a anticuerpos MOG". Esclerosis múltiple . 22 (14): 1821–29. doi : 10.1177 / 1352458516631038 . PMID 26869530 . S2CID 30428892 .
- ↑ a b Davies NW, Sharief MK, Howard RS (julio de 2006). "Encefalopatías asociadas a infecciones: su investigación, diagnóstico y tratamiento". Revista de Neurología . 253 (7): 833–45. doi : 10.1007 / s00415-006-0092-4 . PMID 16715200 . S2CID 26350300 .
- ↑ a b Stone MJ, Hawkins CP (2007). "Una descripción médica de la encefalitis". Rehabilitación neuropsicológica . 17 (4–5): 429–49. doi : 10.1080 / 09602010601069430 . PMID 17676529 . S2CID 24249705 .
- ↑ a b Archer H, Wall R (febrero de 2003). "Leucoencefalopatía hemorrágica aguda: informes de dos casos y revisión de la literatura". El diario de la infección . 46 (2): 133–37. doi : 10.1053 / jinf.2002.1096 . PMID 12634076 .
- ^ Venugopal V, Haider M (2013). "Informe del primer caso de leucoencefalitis hemorrágica aguda tras infección por Plasmodium vivax" . Revista India de Microbiología Médica . 31 (1): 79–81. doi : 10.4103 / 0255-0857.108736 . PMID 23508437 .
- ^ Yildiz Ö, Pul R, Raab P, Hartmann C, Skripuletz T, Stangel M (septiembre de 2015). "Leucoencefalitis hemorrágica aguda (síndrome de Weston-Hurst) en un paciente con esclerosis múltiple remitente de recaída" . Revista de neuroinflamación . 12 (1): 175. doi : 10.1186 / s12974-015-0398-1 . PMC 4574135 . PMID 26376717 .
- ^ Mondia MW, Reyes NG, Espiritu AI, Pascual V JL (septiembre de 2019). "Leucoencefalitis hemorrágica aguda de Weston Hurst secundaria a encefalitis herpética que se presenta como estado epiléptico: reporte de un caso y revisión de la literatura". Revista de neurociencia clínica . 67 : 265–70. doi : 10.1016 / j.jocn.2019.06.020 . PMID 31239199 . S2CID 195261409 .
- ↑ a b c Shahar E, Andraus J, Savitzki D, Pilar G, Zelnik N (noviembre de 2002). "Resultado de encefalomielitis grave en niños: efecto de metilprednisolona e inmunoglobulinas en dosis altas". Revista de neurología infantil . 17 (11): 810-14. doi : 10.1177 / 08830738020170111001 . PMID 12585719 . S2CID 25519230 .
- ^ a b Ravaglia S, Piccolo G, Ceroni M, Franciotta D, Pichiecchio A, Bastianello S, et al. (Noviembre de 2007). "Encefalomielitis posinfecciosa resistente a esteroides severa: características generales y efectos de la IgIV". Revista de Neurología . 254 (11): 1518–23. doi : 10.1007 / s00415-007-0561-4 . PMID 17965959 . S2CID 21922460 .
- ^ Straussberg R, Schonfeld T, Weitz R, Karmazyn B, Harel L (febrero de 2001). "Mejora de la encefalomielitis diseminada aguda atípica con esteroides e inmunoglobulinas intravenosas". Neurología pediátrica . 24 (2): 139–43. doi : 10.1016 / S0887-8994 (00) 00229-0 . PMID 11275464 .
- ^ Feasby T, Banwell B, Benstead T, Bril V, Brouwers M, Freedman M, et al. (Abril de 2007). "Directrices sobre el uso de inmunoglobulina intravenosa para afecciones neurológicas". Reseñas de Medicina de Transfusión . 21 (2 Suppl 1): S57–107. doi : 10.1016 / j.tmrv.2007.01.002 . PMID 17397768 .
- ^ Kamel MG, Nam NT, Han NH, El-Shabouny AE, Makram AM, Abd-Elhay FA, et al. (Junio de 2017). "Encefalomielitis diseminada aguda post-dengue: reporte de un caso y metanálisis" . PLOS Enfermedades tropicales desatendidas . 11 (6): e0005715. doi : 10.1371 / journal.pntd.0005715 . PMC 5509372 . PMID 28665957 .
- ^ Lin CH, Jeng JS, Hsieh ST, Yip PK, Wu RM (febrero de 2007). "Encefalomielitis diseminada aguda: un estudio de seguimiento en Taiwán" . Revista de neurología, neurocirugía y psiquiatría . 78 (2): 162–67. doi : 10.1136 / jnnp.2005.084194 . PMC 2077670 . PMID 17028121 .
- ^ Malo-Pion C, Lambert R, Décarie JC, Turpin S (febrero de 2018). "Imagen del síndrome desmielinizante adquirido con 18F-FDG PET / CT". Medicina nuclear clínica . 43 (2): 103–05. doi : 10.1097 / RLU.0000000000001916 . PMID 29215409 .
- ^ Foong J, Rozewicz L, Quaghebeur G, Davie CA, Kartsounis LD, Thompson AJ, et al. (Enero de 1997). "Función ejecutiva en la esclerosis múltiple. El papel de la patología del lóbulo frontal" . Cerebro . 120 (1): 15-26. doi : 10.1093 / cerebro / 120.1.15 . PMID 9055794 .
- ^ CD de Hahn, Miles BS, MacGregor DL, Blaser SI, Banwell BL, Hetherington CR (agosto de 2003). "Resultado neurocognitivo después de encefalomielitis diseminada aguda". Neurología pediátrica . 29 (2): 117–23. doi : 10.1016 / S0887-8994 (03) 00143-7 . PMID 14580654 .
- ^ Banwell BL, Anderson PE (marzo de 2005). "La carga cognitiva de la esclerosis múltiple en niños". Neurología . 64 (5): 891–94. doi : 10.1212 / 01.WNL.0000152896.35341.51 . PMID 15753431 . S2CID 6532050 .
- ^ Jacobs RK, Anderson VA, Neale JL, Shield LK, Kornberg AJ (septiembre de 2004). "Resultado neuropsicológico después de encefalomielitis diseminada aguda: impacto de la edad al inicio de la enfermedad". Neurología pediátrica . 31 (3): 191–97. doi : 10.1016 / j.pediatrneurol.2004.03.008 . PMID 15351018 .
- ^ Douglas JW (agosto de 1975). "Ingresos hospitalarios tempranos y posteriores alteraciones del comportamiento y el aprendizaje". Medicina del desarrollo y neurología infantil . 17 (4): 456–80. doi : 10.1111 / j.1469-8749.1975.tb03497.x . PMID 1158052 . S2CID 19270009 .
- ^ Daviss WB, Racusin R, Fleischer A, Mooney D, Ford JD, McHugo GJ (mayo de 2000). "Sintomatología del trastorno de estrés agudo durante la hospitalización por lesión pediátrica". Revista de la Academia Estadounidense de Psiquiatría Infantil y Adolescente . 39 (5): 569–75. doi : 10.1097 / 00004583-200005000-00010 . PMID 10802974 .
- ^ Misu T, Fujihara K (febrero de 2019). "Espectro de neuromielitis óptica y encefalomielitis diseminada relacionada con anticuerpos de glucoproteína de oligodendrocitos de mielina". Neuroinmunología clínica y experimental . 10 (1): 9-17. doi : 10.1111 / cen3.12491 . S2CID 59566930 .
- ^ Rivers TM, Schwentker FF (abril de 1935). "Encefalomielitis acompañada de destrucción de mielina producida experimentalmente en monos" . La Revista de Medicina Experimental . 61 (5): 689–702. doi : 10.1084 / jem.61.5.689 . PMC 2133246 . PMID 19870385 .
- ^ Sriram S, Steiner I (diciembre de 2005). "Encefalomielitis alérgica experimental: un modelo engañoso de esclerosis múltiple". Annals of Neurology . 58 (6): 939–45. doi : 10.1002 / ana.20743 . PMID 16315280 . S2CID 12141651 .
enlaces externos
- Encefalomielitis aguda diseminada en la Oficina de Enfermedades Raras de los NIH
- Página de información sobre encefalomielitis diseminada aguda en NINDS
- Información para padres sobre encefalomielitis diseminada aguda
| Clasificación | D
|
|---|---|
| Recursos externos |
|
- Esclerosis múltiple
- Enfermedades autoinmunes
- Trastornos del sistema nervioso central
- Enfermedades asociadas a enterovirus
- Sarampión