Adipocito
| Adipocito | |
|---|---|
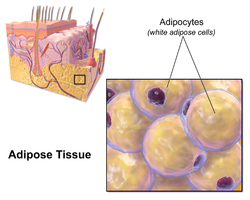 Ilustración que muestra los glóbulos blancos. | |
| Detalles | |
| Identificadores | |
| latín | adipocito |
| Malla | D017667 |
| TH | H2.00.03.0.01005 |
| FMA | 63880 |
| Términos anatómicos de microanatomía | |
Los adipocitos , también conocidos como lipocitos y células grasas , son las células que componen principalmente el tejido adiposo , especializadas en almacenar energía en forma de grasa . [1] Los adipocitos se derivan de células madre mesenquimales que dan lugar a adipocitos a través de la adipogénesis . En el cultivo celular , los adipocitos también pueden formar osteoblastos, miocitos y otros tipos de células.
Hay dos tipos de tejido adiposo, tejido adiposo blanco (WAT) y tejido adiposo marrón (BAT), que también se conocen como grasa blanca y marrón, respectivamente, y comprenden dos tipos de células grasas.
Estructura
Glóbulos blancos
Los glóbulos blancos contienen una sola gota de lípidos grande rodeada por una capa de citoplasma y se conocen como uniloculares. El núcleo se aplana y empuja hacia la periferia. Una célula de grasa típica tiene 0,1 mm de diámetro, algunas tienen el doble de tamaño y otras la mitad. La grasa almacenada se encuentra en un estado semilíquido y está compuesta principalmente de triglicéridos y éster de colesterilo . Los glóbulos blancos secretan muchas proteínas que actúan como adipocinas como resistina , adiponectina , leptina y apelina.. Un adulto humano promedio tiene 30 mil millones de células grasas con un peso de 30 libras o 13,5 kg. Si se gana un exceso de peso en la edad adulta, las células grasas aumentan de tamaño aproximadamente cuatro veces antes de dividirse y aumentar el número absoluto de células grasas presentes. [2]
Células de grasa marrón
Las células de grasa pardas tienen forma poliédrica . A diferencia de los glóbulos blancos, estas células tienen un citoplasma considerable, con varias gotas de lípidos esparcidas por todas partes, y se conocen como células multiloculares. El núcleo es redondo y, aunque está situado de forma excéntrica, no se encuentra en la periferia de la célula. El color marrón proviene de la gran cantidad de mitocondrias . La grasa parda, también conocida como "grasa de bebé", se utiliza para generar calor.
Células de grasa de la médula ósea
Los adipocitos de la médula ósea son uniloculares como los glóbulos blancos, sin embargo, tanto los adipocitos marrones como los blancos se derivan de las células madre mesenquimales . El depósito de tejido adiposo de la médula ósea es poco conocido en términos de su función fisiológica y su relevancia para la salud ósea. El tejido adiposo de la médula ósea se expande en estados de baja densidad ósea, pero también se expande en el contexto de la obesidad. [3] La respuesta del tejido adiposo de la médula ósea al ejercicio se aproxima a la del tejido adiposo blanco . [3] [4] [5] [6] El ejercicio reduce tanto el tamaño de los adipocitos como el volumen del tejido adiposo de la médula ósea, según se cuantifica mediante imágenes de resonancia magnética o TC de hueso teñido con el captador de lípidososmio .
Desarrollo
Los preadipocitos son fibroblastos indiferenciados que pueden estimularse para formar adipocitos. Los estudios han arrojado luz sobre los posibles mecanismos moleculares en la determinación del destino de los preadipocitos, aunque el linaje exacto de los adipocitos aún no está claro. [7] [8] La variación de la distribución de la grasa corporal resultante del crecimiento normal está influenciada por el estado nutricional y hormonal que depende de las diferencias intrínsecas en las células que se encuentran en cada depósito adiposo. [9]
Las células madre mesenquimales pueden diferenciarse en adipocitos, tejido conectivo , músculo o hueso . [1]
El precursor de la célula adulta se denomina lipoblasto y un tumor de este tipo de célula se conoce como lipoblastoma . [10]
Función
Renovación celular
Se ha demostrado que las células grasas en algunos ratones disminuyen debido al ayuno y se observaron otras propiedades cuando se exponen al frío. [11]
Si los adipocitos del cuerpo alcanzan su capacidad máxima de grasa, pueden replicarse para permitir un almacenamiento adicional de grasa.
Las ratas adultas de diversas razas se volvieron obesas cuando se les alimentó con una dieta muy apetecible durante varios meses. El análisis de la morfología de su tejido adiposo reveló aumentos tanto en el tamaño como en el número de adipocitos en la mayoría de los depósitos. La reintroducción de una dieta de pienso ordinario [12] en estos animales precipitó un período de pérdida de peso durante el cual sólo el tamaño medio de los adipocitos volvió a la normalidad. El número de adipocitos se mantuvo en el nivel elevado alcanzado durante el período de aumento de peso. [13]
Según algunos informes y libros de texto, la cantidad de adipocitos puede aumentar en la infancia y la adolescencia, aunque la cantidad suele ser constante en los adultos. Las personas que se vuelven obesas en la edad adulta, en lugar de en la adolescencia, no tienen más adipocitos que antes. [14]
Las personas que han sido gordas desde la infancia generalmente tienen un número inflado de células grasas. Las personas que engordan en la edad adulta pueden no tener más células grasas que sus compañeros delgados, pero sus células grasas son más grandes. En general, a las personas con un exceso de células grasas les resulta más difícil perder peso y no recuperarlo que a las personas obesas que simplemente tienen células grasas agrandadas. [2]
Las células de grasa corporal tienen respuestas regionales a la sobrealimentación que se estudió en sujetos adultos. En la parte superior del cuerpo, un aumento del tamaño de los adipocitos se correlacionó con el aumento de grasa en la parte superior del cuerpo; sin embargo, el número de células grasas no se modificó significativamente. En contraste con la respuesta de las células grasas de la parte superior del cuerpo, el número de adipocitos de la parte inferior del cuerpo aumentó significativamente durante el curso del experimento. En particular, no hubo cambios en el tamaño de los adipocitos de la parte inferior del cuerpo. [15]
Aproximadamente el 10% de las células grasas se renuevan anualmente en todas las edades adultas y niveles de índice de masa corporal sin un aumento significativo en el número total de adipocitos en la edad adulta. [14]
Adaptación
La obesidad se caracteriza por la expansión de la masa grasa, a través del aumento del tamaño de los adipocitos ( hipertrofia ) y, en menor medida, la proliferación celular ( hiperplasia ). [16] En las células grasas de las personas obesas, hay una mayor producción de moduladores del metabolismo, como glicerol, hormonas, quimiocinas estimulantes de macrófagos y citocinas proinflamatorias, lo que conduce al desarrollo de resistencia a la insulina . [17]
La insulina estimula fuertemente la producción de grasa en los adipocitos. Al controlar la actividad de la piruvato deshidrogenasa y las enzimas acetil-CoA carboxilasa , la insulina promueve la síntesis de ácidos grasos insaturados . También promueve la captación de glucosa e induce SREBF1 , que activa la transcripción de genes que estimulan la lipogénesis. [18]
SREBF1 (factor de transcripción de unión a elementos reguladores de esterol 1) es un factor de transcripción sintetizado como una proteína precursora inactiva insertada en la membrana del retículo endoplásmico (ER) por dos hélices que atraviesan la membrana. También anclado en la membrana del RE se encuentra SCAP (proteína activadora de escisión de SREBF), que se une a SREBF1. El complejo SREBF1-SCAP es retenido en la membrana del RE por INSIG1 (proteína del gen 1 inducida por insulina). Cuando se agotan los niveles de esteroles, INSIG1 libera SCAP y el complejo SREBF1-SCAP se puede clasificar en vesículas de transporte recubiertas de COPII que se exportan al Golgi. En el Golgi, SREBF1 se escinde y se libera como una proteína madura transcripcionalmente activa. Entonces es libre de trasladarse al núcleo y activar la expresión de sus genes diana.
[19]
Los estudios clínicos han demostrado en repetidas ocasiones que, aunque la resistencia a la insulina suele estar asociada con la obesidad, los fosfolípidos de membrana de los adipocitos de los pacientes obesos, por lo general, todavía muestran un mayor grado de insaturación de ácidos grasos. [20] Esto parece apuntar a un mecanismo adaptativo que permite que el adipocito mantenga su funcionalidad, a pesar de las mayores demandas de almacenamiento asociadas con la obesidad y la resistencia a la insulina.
Un estudio realizado en 2013 [20] encontró que, mientras que la expresión de ARNm de INSIG1 y SREBF1 disminuyó en el tejido adiposo de ratones y humanos obesos, la cantidad de SREBF1 activo aumentó en comparación con ratones normales y pacientes no obesos. Esta regulación a la baja de la expresión de INSIG1 combinada con el aumento de SREBF1 maduro también se correlacionó con el mantenimiento de la expresión del gen diana de SREBF1. Por lo tanto, parece que, al regular a la baja INSIG1, hay un restablecimiento del bucle INSIG1 / SREBF1, lo que permite el mantenimiento de los niveles SREBF1 activos. Esto parece ayudar a compensar los efectos anti-lipogénicos de la resistencia a la insulina y así preservar la capacidad de almacenamiento de grasa de los adipocitos y la disponibilidad de niveles apropiados de insaturación de ácidos grasos frente a las presiones nutricionales de la obesidad.
Papel endocrino
Los adipocitos pueden sintetizar estrógenos a partir de andrógenos , [21] siendo potencialmente la razón por la que el bajo peso o el sobrepeso son factores de riesgo de infertilidad . [22] Además, los adipocitos son responsables de la producción de la hormona leptina . La leptina es importante en la regulación del apetito y actúa como factor de saciedad. [23]
Ver también
- Lista de tipos de células humanas derivadas de las capas germinales
Referencias
- ↑ a b Birbrair A, Zhang T, Wang ZM, Messi ML, Enikolopov GN, Mintz A, Delbono O (agosto de 2013). "Papel de los pericitos en la regeneración del músculo esquelético y la acumulación de grasa" . Células madre y desarrollo . 22 (16): 2298–314. doi : 10.1089 / scd.2012.0647 . PMC 3730538 . PMID 23517218 .
- ↑ a b Robert P (2001). Grasa: lucha contra la epidemia de obesidad . Oxford [Oxfordshire]: Oxford University Press. pp. 68 . ISBN 978-0-19-511853-7.
- ^ a b Styner M, Pagnotti GM, McGrath C, Wu X, Sen B, Uzer G, Xie Z, Zong X, Styner MA, Rubin CT, Rubin J (agosto de 2019). "El ejercicio disminuye el tejido adiposo de la médula a través de la β-oxidación en ratones obesos" . Revista de investigación ósea y mineral . 34 (18): 1692-1702. doi : 10.1002 / jbmr.3159 . PMC 5550355 . PMID 28436105 .
- ^ Pagnotti GM, Styner M (2016). "Regulación del ejercicio del tejido adiposo de la médula" . Fronteras en endocrinología . 7 : 94. doi : 10.3389 / fendo.2016.00094 . PMC 4943947 . PMID 27471493 .
- ^ Styner M, Pagnotti GM, Galior K, Wu X, Thompson WR, Uzer G, Sen B, Xie Z, Horowitz MC, Styner MA, Rubin C, Rubin J (agosto de 2015). "Regulación del ejercicio de la grasa de la médula ósea en el contexto del tratamiento con agonista de PPARγ en ratones hembra C57BL / 6" . Endocrinología . 156 (8): 2753–61. doi : 10.1210 / es.2015-1213 . PMC 4511140 . PMID 26052898 .
- ^ Styner M, Thompson WR, Galior K, Uzer G, Wu X, Kadari S, Case N, Xie Z, Sen B, Romaine A, Pagnotti GM, Rubin CT, Styner MA, Horowitz MC, Rubin J (julio de 2014). "La acumulación de grasa en la médula ósea acelerada por una dieta alta en grasas se suprime con el ejercicio" . Hueso . 64 : 39–46. doi : 10.1016 / j.bone.2014.03.044 . PMC 4041821 . PMID 24709686 .
- ^ Coskun H, Summerfield TL, Kniss DA, Friedman A (2010). "Modelado matemático de la determinación del destino de los preadipocitos". Revista de Biología Teórica . 265 (1): 87–94. Código Bibliográfico : 2010JThBi.265 ... 87C . doi : 10.1016 / j.jtbi.2010.03.047 . PMID 20385145 . Resumen de Lay - ScienceDaily .
- ^ Coskun H, Summerfield TL, Kniss DA, Friedman A (julio de 2010). "Modelado matemático de la determinación del destino de los preadipocitos". Revista de Biología Teórica . 265 (1): 87–94. Código Bibliográfico : 2010JThBi.265 ... 87C . doi : 10.1016 / j.jtbi.2010.03.047 . PMID 20385145 .
- ^ Fried SK, Lee MJ, Karastergiou K (julio de 2015). "Dar forma a la distribución de la grasa: nuevos conocimientos sobre los determinantes moleculares de la biología adiposa dependiente del sexo y el depósito" . Obesidad (revisión). 23 (7): 1345–52. doi : 10.1002 / oby.21133 . PMC 4687449 . PMID 26054752 .
- ^ Hong R, Choi DY, Do NY, Lim SC (julio de 2008). "Citología por aspiración con aguja fina de un lipoblastoma: reporte de un caso". Citopatología diagnóstica . 36 (7): 508-11. doi : 10.1002 / dc.20826 . PMID 18528880 . S2CID 22668394 .
- ^ Ding H, Zheng S, García-Ruiz D, Hou D, Wei Z, Liao Z, et al. (Mayo de 2016). "El ayuno induce un cambio de grasa subcutáneo a visceral mediado por microRNA-149-3p y supresión de PRDM16" . Comunicaciones de la naturaleza . 7 : 11533. Bibcode : 2016NatCo ... 711533D . doi : 10.1038 / ncomms11533 . PMC 4895052 . PMID 27240637 .
- ^ Warden CH, Fisler JS (abril de 2008). "Comparaciones de dietas utilizadas en modelos animales de alimentación rica en grasas" . Metabolismo celular . 7 (4): 277. doi : 10.1016 / j.cmet.2008.03.014 . PMC 2394560 . PMID 18396128 .
La comida regular se compone de subproductos agrícolas, como trigo molido, maíz o avena, alfalfa y harinas de soja, una fuente de proteínas como el pescado y aceite vegetal y se complementa con minerales y vitaminas. Por lo tanto, la comida es una dieta rica en fibra que contiene carbohidratos complejos, con grasas de una variedad de fuentes vegetales. Chow es económico de fabricar y es apetecible para los roedores.
- ^ Faust IM, Johnson PR, Stern JS, Hirsch J (septiembre de 1978). "Aumento del número de adipocitos inducido por la dieta en ratas adultas: un nuevo modelo de obesidad". La Revista Estadounidense de Fisiología . 235 (3): E279–86. doi : 10.1152 / ajpendo.1978.235.3.E279 . PMID 696822 .
- ^ a b Spalding KL, Arner E, Westermark PO, Bernard S, Buchholz BA, Bergmann O, Blomqvist L, Hoffstedt J, Näslund E, Britton T, Concha H, Hassan M, Rydén M, Frisén J, Arner P (junio de 2008 ). "Dinámica del recambio de células grasas en humanos". Naturaleza . 453 (7196): 783–7. Código Bibliográfico : 2008Natur.453..783S . doi : 10.1038 / nature06902 . PMID 18454136 . S2CID 4431237 .
- ^ Tchoukalova YD, Votruba SB, Tchkonia T, Giorgadze N, Kirkland JL, Jensen MD (octubre de 2010). "Diferencias regionales en los mecanismos celulares de ganancia de tejido adiposo con sobrealimentación" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (42): 18226–31. doi : 10.1073 / pnas.1005259107 . PMC 2964201 . PMID 20921416 .
- ^ Blüher M (junio de 2009). "Disfunción del tejido adiposo en la obesidad". Endocrinología clínica y experimental y diabetes . 117 (6): 241–50. doi : 10.1055 / s-0029-1192044 . PMID 19358089 .
- ^ Kahn SE, Hull RL, Utzschneider KM (diciembre de 2006). "Mecanismos que vinculan la obesidad a la resistencia a la insulina y la diabetes tipo 2". Naturaleza . 444 (7121): 840–6. Código Bibliográfico : 2006Natur.444..840K . doi : 10.1038 / nature05482 . PMID 17167471 . S2CID 120626 .
- ^ Kahn BB, Flier JS (agosto de 2000). "Obesidad y resistencia a la insulina" . La Revista de Investigación Clínica . 106 (4): 473–81. doi : 10.1172 / JCI10842 . PMC 380258 . PMID 10953022 .
- ^ Rawson RB (agosto de 2003). "La vía de SREBP - conocimientos de Insigs e insectos". Nature Reviews Biología celular molecular . 4 (8): 631–40. doi : 10.1038 / nrm1174 . PMID 12923525 . S2CID 20818196 .
- ^ a b Carobbio S, Hagen RM, Lelliott CJ, Slawik M, Medina-Gomez G, Tan CY, et al. (Noviembre de 2013). "Los cambios adaptativos del punto de ajuste Insig1 / SREBP1 / SCD1 ayudan al tejido adiposo a hacer frente al aumento de las demandas de almacenamiento de la obesidad" . Diabetes . 62 (11): 3697–708. doi : 10.2337 / db12-1748 . PMC 3806615 . PMID 23919961 .
- ^ Nelson LR, Bulun SE (septiembre de 2001). "Producción y acción de estrógenos". Revista de la Academia Estadounidense de Dermatología . 45 (Supl. 3): S116–24. doi : 10.1067 / mjd.2001.117432 . PMID 11511861 .
- ^ "HECHO DE FERTILIDAD: Riesgos femeninos" . Sociedad Estadounidense de Medicina Reproductiva (ASRM). Archivado desde el original el 22 de septiembre de 2007.
- ^ Klok MD, Jakobsdottir S, Drent ML (enero de 2007). "El papel de la leptina y la grelina en la regulación de la ingesta de alimentos y el peso corporal en humanos: una revisión". Reseñas de obesidad . 8 (1): 21–34. doi : 10.1111 / j.1467-789X.2006.00270.x . PMID 17212793 . S2CID 24266123 .
enlaces externos
| Wikimedia Commons tiene medios relacionados con los adipocitos . |
- Imagen de histología: 08201loa - Sistema de aprendizaje de histología en la Universidad de Boston - "Tejido conectivo: adipocitos uniloculares (blancos)"
- Imagen de histología: 04901lob - Sistema de aprendizaje de histología en la Universidad de Boston - "Tejido conectivo: adipocitos multiloculares (marrones)"
- Secuestrar células
- Células humanas
- Células del tejido conectivo

