Oxidación de Babler
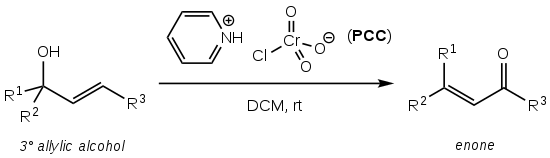
La oxidación de Babler , también conocida como oxidación de Babler-Dauben , es una reacción orgánica para la transposición oxidativa de alcoholes alílicos terciarios a enonas utilizando clorocromato de piridinio (PCC): [1]
Lleva el nombre de James Babler, quien informó por primera vez la reacción en 1976 [1] [2] y William Dauben, quien extendió el alcance a los sistemas cíclicos en 1977, aumentando así significativamente la utilidad sintética: [1] [3]
La reacción produce el producto enona deseado con un alto rendimiento (típicamente> 75%), es operativamente simple y no requiere técnicas sin aire ni calentamiento. [1] Sin embargo, sufre de la muy alta toxicidad y peligro ambiental que presenta el reactivo oxidante de cromo hexavalente PCC.
El disolvente de elección suele ser diclorometano seco (DCM) o cloroformo (CHCl 3 ). [1] [2]
La reacción se ha utilizado como un paso en la síntesis total de varios compuestos, por ejemplo , de morfina . [1] [4]
Mecanismo
La reacción procede a través de la formación de un éster de cromato ( 1 ) a partir del ataque nucleofílico del clorocromato por el alcohol alílico. A continuación, el éster sufre un desplazamiento [3,3] -sigmatrópico para crear el éster de cromato isomérico ( 2 ). Finalmente, la oxidación de este intermedio produce el producto cetona o aldehído α, β-insaturado ( 3 ). [1]
Reactivos alternativos
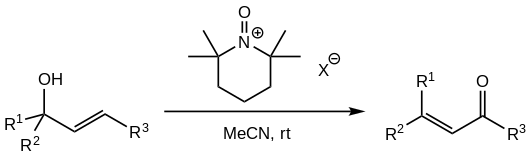
Las preocupaciones sobre la alta toxicidad y carcinogenicidad del oxidante PCC, así como el papel de las especies de cromo (VI) como contaminantes ambientales en las aguas subterráneas, han llevado a investigaciones para el reemplazo del PCC en la reacción. Una alternativa exitosa reportada por múltiples fuentes involucra el uso de sales de N -oxoamonio derivadas de TMP : [1] [5]
Se utilizan las sales de oxoamonio con aniones no coordinantes (tales como tetrafluoroborato , perclorato , hexafluorofosfato o hexafluoroantimoniato ). [5] El oxidante se añade en cantidades estequiométricas, normalmente 1,5 eq de alcohol.
Un enfoque diferente para minimizar el uso tóxico de cromo (VI) implica realizar la reacción con solo una cantidad catalítica de PCC y un exceso de otro oxidante, para volver a oxidar las especies de cromo como parte del ciclo catalítico . Comúnmente reportados reactivos estequiométricos para este propósito incluyen di- terc -butil peróxido , ácido 2-yodoxibenzoico o peryodatos . [1]
Alcoholes secundarios
La oxidación de Babler-Dauben de alcoholes alílicos secundarios resulta más difícil de controlar que la de análogos terciarios, ya que junto con el producto deseado ( a ) se obtiene una mezcla con alta proporción de subproductos ( b ) y ( c ): [1 ]
El rendimiento de una se encuentra para ser maximizada cuando PCC no se utiliza en cantidades estequiométricas, sino como un co-oxidante; el mejor efecto (50-70% de rendimiento de a ) se logra con el ácido ortoperiódico como oxidante principal con un PCC molar del 5%. [1] Como disolvente se utiliza acetonitrilo (MeCN) sobre el DCM habitual.
En particular, en contraste con la oxidación general de los alcoholes terciarios, el caso del alcohol secundario solo funciona con sustratos aromáticos (Ar-: un grupo arilo ). Esto, junto con las condiciones fuertemente ácidas debido a la cantidad estequiométrica de ácido peryódico, sugiere que el éster de cromato formado inicialmente se isomeriza a través de una ruta carbocatiónica en lugar de una reacción sigmatotrópica como para los alcoholes terciarios. [1]
Ver también
- Oxidación con complejos de cromo (VI)
- Oxidación catalizada por oxoamonio
- Otras reacciones de PCC
Referencias
- ^ a b c d e f g h i j k l Killoran, Patrick M .; Rossington, Steven B .; Wilkinson, James A .; Hadfield, John A. (31 de agosto de 2016). "Ampliación del alcance de la oxidación de Babler-Dauben: transposición 1,3-oxidativa de alcoholes alílicos secundarios" . Letras de tetraedro . 57 (35): 3954–3957. doi : 10.1016 / j.tetlet.2016.07.076 . ISSN 0040-4039 .
- ^ a b Babler, James H .; Coghlan, Michael J. (1 de enero de 1976). "Un método fácil para la bishomologación de cetonas a aldehídos α, β-insaturados: aplicación a la síntesis de los componentes ciclohexanoides del atrayente sexual del picudo del algodonero" . Comunicaciones sintéticas . 6 (7): 469–474. doi : 10.1080 / 00397917608082626 . ISSN 0039-7911 .
- ^ Dauben, William G .; Michno, Drake M. (1 de marzo de 1977). "Oxidación directa de alcoholes alílicos terciarios. Un método simple y eficaz para la transposición de carbonilo alquilativo" . La Revista de Química Orgánica . 42 (4): 682–685. doi : 10.1021 / jo00424a023 . ISSN 0022-3263 .
- ^ Nagata, Hiroshi; Miyazawa, Norio; Ogasawara, Kunio (1 de enero de 2001). "Una ruta concisa a (-) - morfina" . Comunicaciones químicas (12): 1094–1095. doi : 10.1039 / B101668G . ISSN 1364-548X .
- ^ a b Shibuya, Masatoshi; Tomizawa, Masaki; Iwabuchi, Yoshiharu (1 de junio de 2008). "Reordenamiento oxidativo de alcoholes alílicos terciarios que emplean sales de oxoamonio" . La Revista de Química Orgánica . 73 (12): 4750–4752. doi : 10.1021 / jo800634r . ISSN 0022-3263 .
- Reacciones de oxidación orgánica
- Reacciones de nombres
- Reacciones redox orgánicas