Fimbrias acompañante-ujier
Las fimbrias acompañantes (CU) son pili lineales , no ramificados, de la membrana externa secretados por bacterias gramnegativas a través del sistema acompañante-acompañante en lugar de a través de secreción tipo IV o sistemas de nucleación extracelular. Estas fimbrias se forman a partir de subunidades modulares de pilus, que se transportan al periplasma de forma dependiente de Sec . Las fimbrias secretadas por acompañantes son importantes factores de patogenicidad que facilitan la colonización del huésped , la localización y la formación de biopelículas en especies clínicamente importantes como Escherichia coli uropatógena.y Pseudomonas aeruginosa .
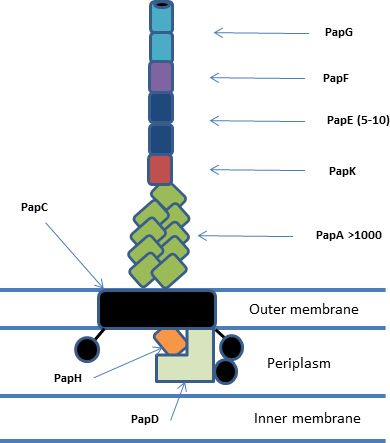
Todos los sistemas de acompañante / acomodador se encuentran dentro de grupos de genes que consisten en al menos un acomodador , un acompañante y una o más subunidades de fimbrias. [1] En general, el sistema incluye chaperonas periplásmicas , subunidades de pilus periplásmicas y extracelulares , poros de la membrana externa del ujier dimérico y maquinaria Sec asociada. Las subunidades de Pilus se polimerizan a través de una interacción no covalente para formar el pilus maduro que consta de una punta adhesiva , un cuerpo helicoidal y una base unida al acomodador. El sistema P-pilus (pap) es uno de los mejor caracterizados y se muestra a continuación. [2]
El acomodador forma el poro de la membrana externa y funciona in vivo como un dímero , aunque solo uno de los acomodadores está activo a la vez. [3] El poro usher (PapC) está formado por un barril beta de 24 hebras con 4 dominios adicionales: dominio N-terminal (NTD), dominio Plug y dos dominios C-terminales (CTD1 y CTD2 respectivamente). Los NTD y CTD funcionan para llevar los complejos de chaperona / subunidad al pilus en crecimiento y facilitar la translocación a través del poro. [4] El dominio del tapón actúa para detener la formación prematura de un pilus y puede estar ubicado dentro del poro o en el lado periplásmico de la membrana. En el acomodador dimérico activo, uno de los acomodadores tiene el tapón ubicado periplásmicamente y el otro lo tiene ubicado dentro del poro de translocación.[5]
La chaperona periplásmica (PapD) tiene una estructura de 'boomerang' formada por un pliegue similar a inmunoglobulina (Ig) con una extensión C-terminal esencial (G1). Este pliegue está formado por 13 hebras β (A1-G1) y 4 hélices α cortas. Los acompañantes pertenecen a una de las dos familias según la longitud del bucle que conecta las hebras beta F1 y G1. Los acompañantes de bucle largo son FGL y los acompañantes de bucle corto son FGS. La chaperona funciona para detener la agregación y degradación de las subunidades de pilus uniendo sus regiones de interfaz y facilitando el plegamiento correcto de proteínas antes de llevarlas al complejo usher / fimbrias. [6]
La estructura de la subunidad pilus también tiene un pliegue similar a Ig pero con una extensión N-terminal esencial en lugar de una extensión C-terminal. Debido a que esta extensión N-terminal es la misma hebra β que normalmente completa el pliegue de Ig, se forma una gran hendidura hidrófoba en la subunidad madura (P1-P5), esta hendidura es esencial para la biogénesis del pilus pero también necesita un acompañante para estabilizar el estructura. [7] Las subunidades particulares pueden tener dominios adicionales, por ejemplo, papG tiene un dominio de lectina adhesivo. Las subunidades de pilus in vivo funcionan para formar el cuerpo principal del pilus helicoidal (aproximadamente 3,28 subunidades por vuelta) y la cabeza adhesiva.
La biogénesis de pilus procede a través del mecanismo de complementación de la hebra, el mecanismo funciona como una consecuencia directa de las estructuras de las subunidades tanto de las chaperonas como de las de pilus. Tanto la extensión G1 de la chaperona como la extensión N-terminal de las subunidades del pilus pueden unirse a la hendidura hidrofóbica P1-P5. Cuando el G1 está unido, se une en una conformación paralela que estabiliza la estructura de la subunidad, pero no forma un verdadero pliegue de Ig (que es antiparalelo). También solo une la hendidura de los sitios P1-P4 dejando expuesta la bolsa P5. Cuando otra subunidad se une a la hendidura hidrófoba, se une de forma antiparalela P5-P2 creando la conformación más favorable desde el punto de vista energético de un pliegue de Ig verdadero. [1]