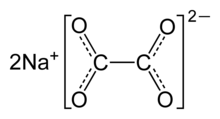
Oxalato de sodio
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Oxalato de disodio | |
| Otros nombres Ácido oxálico, sal disódica Etanodioato de sodio | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.000.501 |
| Número CE |
|
PubChem CID | |
| Número RTECS |
|
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| Na 2 C 2 O 4 | |
| Masa molar | 133,999 g mol -1 |
| Densidad | 2,34 g cm −3 |
| Punto de fusion | 260 ° C (500 ° F; 533 K) se descompone por encima de 290 ° C [2] |
| 2,69 g / 100 ml (0 ° C) 3,7 g / 100 ml (20 ° C) 6,25 g / 100 ml (100 ° C) | |
| Solubilidad | soluble en ácido fórmico insoluble en alcohol , éter |
| Estructura | |
| monoclínico | |
| Termoquímica | |
| -1318 kJ / mol | |
| Riesgos | |
| Ficha de datos de seguridad | Oxford MSDS [ fuente no confiable ] |
| NFPA 704 (diamante de fuego) |  1 0 0 |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 11160 mg / kg (oral, rata) [1] |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El oxalato de sodio , u oxalato de disodio , es la sal de sodio del ácido oxálico con la fórmula Na 2 C 2 O 4 . Es un blanco, cristalino, inodoro sólido, que se descompone por encima de 290 ° C . [2]
El oxalato de disodio puede actuar como un agente reductor y puede usarse como patrón primario para estandarizar las soluciones de permanganato de potasio (KMnO 4 ).
La forma mineral del oxalato de sodio es el natroxalato . Se encuentra muy raramente y se restringe a condiciones extremadamente sódicas de pegmatitas ultraalcalinas . [3]
Preparación
El oxalato de sodio se puede preparar mediante la neutralización de ácido oxálico con hidróxido de sodio (NaOH) en una relación molar de ácido a base de 1: 2. La evaporación produce el oxalato anhidro [4] que se puede secar completamente calentándolo entre 200 y 250 ° C. [2]
La semi-neutralización se puede lograr con NaOH en una proporción de 1: 1 que produce NaHC 2 O 4 , oxalato de sodio monobásico o hidrogenoxalato de sodio .
Alternativamente, se puede producir descomponiendo el formiato de sodio calentándolo a una temperatura superior a 360 ° C. [ cita requerida ]
Reacciones
El oxalato de sodio comienza a descomponerse por encima de 290 ° C en carbonato de sodio y monóxido de carbono : [2]
- N / A
2C
2O
4→ Na
2CO
3+ CO
Cuando se calienta entre 200 y 525 ° C con pentóxido de vanadio en una proporción molar de 1: 2, la reacción anterior se suprime, produciendo en su lugar un oxibronce de vanadio sódico con liberación de dióxido de carbono [5]
- x Na
2C
2O
4+ 2 V
2O
5→ 2 Na
XV
2O
5+ 2 x CO
2
con x aumentando hasta 1 a medida que aumenta la temperatura.
El oxalato de sodio se usa para estandarizar las soluciones de permanganato de potasio . Es deseable que la temperatura de la mezcla de titulación sea superior a 60 ° C para asegurar que todo el permanganato agregado reaccione rápidamente. La cinética de la reacción es compleja y los iones manganeso (II) formados catalizan la reacción adicional entre el permanganato y el ácido oxálico (formado in situ mediante la adición de un exceso de ácido sulfúrico). La ecuación final es la siguiente: [6]
- 5 Na 2 C 2 O 4 + 2 KMnO 4 + 8 H 2 SO 4 → K 2 SO 4 + 5 Na 2 SO 4 + 2 MnSO 4 + 10 CO 2 + 8 H 2 O
Actividad biológica
Como muchos otros oxalatos , el oxalato de sodio es tóxico para los humanos. Puede causar ardor en la boca, garganta y estómago, vómitos con sangre, dolor de cabeza, calambres musculares, calambres y convulsiones, caída de la presión arterial, insuficiencia cardíaca, shock, coma y posible muerte. La dosis letal media por ingestión de oxalatos es de 10 a 15 gramos / kilogramo de peso corporal (según MSDS ).
El oxalato de sodio, como los citratos , también se puede utilizar para eliminar los iones de calcio (Ca 2+ ) del plasma sanguíneo. También evita que la sangre se coagule. Tenga en cuenta que al eliminar los iones de calcio de la sangre, el oxalato de sodio puede afectar la función cerebral y depositar el oxalato de calcio en los riñones.
Referencias
- ^ a b "ChemIDplus - 62-76-0 - ZNCPFRVNHGOPAG-UHFFFAOYSA-L - Oxalato de disodio - Búsqueda de estructuras similares, sinónimos, fórmulas, enlaces de recursos y otra información química" . chem.nlm.nih.gov . NIH . Consultado el 7 de enero de 2019 .
- ^ a b c d Yoshimori T1, Asano Y, Toriumi Y, Shiota T. (1978) "Investigación sobre el secado y descomposición del oxalato de sodio". Talanta , volumen 25, número 10, páginas 603-605. doi : 10.1016 / 0039-9140 (78) 80158-1
- ^ "Natroxolate" (PDF) . RRUFF . Publicación de datos minerales . Consultado el 7 de enero de 2019 .
- ^ HW Foote y John E. Vance (1933), "El sistema; yodato de sodio, oxalato de sodio, agua". American Journal of Science , serie 5, volumen 26, número 151, páginas 16-18. doi : 10.2475 / ajs.s5-26.151.16
- ↑ D. Ballivet-Tkatchenko, J. Galy, -M. Savariault (1994): "Descomposición térmica del oxalato de sodio en presencia de V2O5: Enfoque mecanicista de la formación de oxibrones de sodio". Thermochimica Acta , volumen 232, número 2, páginas 215-223. doi : 10.1016 / 0040-6031 (94) 80061-8
- ^ Mcbride, RS (1912). "La estandarización de la solución de permanganato de potasio por oxalato de sodio" . Mermelada. Chem. Soc. 34 (4): 393–416. doi : 10.1021 / ja02205a009 .
- Oxalatos
- Compuestos de sodio