 | |
| Datos clinicos | |
|---|---|
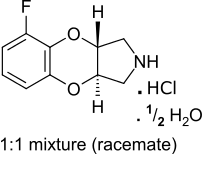
| Otros nombres | (+/-) - (trans) -5-fluoro-2,3,3a, 9a-tetrahidro-1H- [1,4] benzodioxino [2,3-c] pirrol hidrocloruro hemihidrato |
| Vías de administración | Oral |
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | 85% oral de formulación en tableta |
| Metabolismo | más del 90% excretado como (ácido sulfámico y conjugados de glucurónido carbamoyI) |
| Vida media de eliminación | 6 horas |
| Excreción | renal |
| Identificadores | |
| |
| Número CAS |
|
| UNII |
|
| Tablero CompTox ( EPA ) |
|
| Datos químicos y físicos | |
| Fórmula | C 10 H 12 Cl F N O 2,5 |
| Masa molar | 240,66 g · mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
Fluparoxan ( GR50360A ) es un potente antagonista del receptor adrenérgico α 2 (pK B = 7,9) con una excelente selectividad α 2 / α 1 (2630 veces), y es el único antagonista a 2 bien estudiado de su familia estructural que no antagoniza cualquier variante del receptor de imidazolina . [1] [2] Se demostró que posee actividad antagonista central de los receptores adrenérgicos α 2 después de dosis orales en el hombre y fue patentado como antidepresivo por Glaxoa principios de la década de 1980, pero su desarrollo se interrumpió cuando el compuesto no mostró una clara ventaja clínica sobre las terapias existentes. [1]
Mecanismo de acción [ editar ]
El fluparoxano es un bloqueador adrenérgico α 2 muy selectivo , [3] que atraviesa fácilmente la barrera hematoencefálica. El bloqueo de los receptores adrenérgicos α 2 , particularmente los autorreceptores presinápticos en neuronas noradrenérgicas por el fluparoxano, produce un aumento en las concentraciones sinápticas de noradrenalina, [4] al bloquear el mecanismo de retroalimentación autoinhibitoria. Esta liberación de noradrenalina tiene un valor potencial en el tratamiento de trastornos que están asociados con una deficiencia de noradrenalina en los receptores adrenérgicos postsinápticos , como la depresión, [5] las primeras características de Enfermedad de Alzheimer y esquizofrenia y otros trastornos del neurodesarrollo asociados con el deterioro cognitivo. [6] [7] Fluparoxan tampoco presenta efectos anticolinérgicos, antidopaminérgicos, alfa1-adrenérgicos, beta-adrenérgicos, muscarínicos o de bloqueo del receptor 5-HT1. [3]
Farmacología [ editar ]
Mecanismo de acción [ editar ]
Fluparoxan mostró actividad antagonista de los adrenoceptores α 2 in vivo en varias especies animales. [3] En el ratón consciente, fluparoxan fue eficaz por vía oral para prevenir la hipotermia y la antinocicepción inducidas por la clonidina . Mientras que en la rata, fluparoxan previno el marcado deterioro del rendimiento de la varilla giratoria de manera dependiente de la dosis. Fluparoxan, el agonista UK-14304 prevenido por vía oral indujo sedación y bradicardia de una manera relacionada con la dosis en el perro. Se ha demostrado que fluparoxano posee α 2 centrales-Actividad antagonista de los adrenoceptores después de dosis orales únicas y repetidas en el hombre, atenuando significativamente todas las respuestas al agonista clonidina (secreción de hormona del crecimiento, bradicardia, hipotensión , xerostomía ) aparte de las medidas de sedación. [8]
Fluparoxan ha mostrado efectos positivos en el tratamiento de la disfunción cognitiva en pacientes con esquizofrenia cuando se administra por vía oral fluparoxan, [1] y en el tratamiento de trastornos neurodegenerativos centrales en modelos de enfermedad de Alzheimer donde previno el deterioro relacionado con la edad en la memoria de trabajo espacial en ratones transgénicos. , aunque no tuvo ningún efecto en otras tareas de memoria, como el reconocimiento de objetos o el laberinto de agua de Morris, y se produjo en ausencia de un cambio concomitante obvio en la patología, como la carga de placa de β-amiloide y la astrocitosis . [9]
El individuo quiral isómeros 7 (+) 3a R , 9a R y 8 (-) 3a S , 9a S de fluparoxan ambos tenían niveles comparables de α 2 adrenorreceptores antagonista de potencia y α 2 / α 1 selectividad para racémica fluparoxan 6 ($ ± $) rel 3a R , 9a R in vitro y una potencia similar in vivo para revertir la hipotermia inducida en ratones por la clonidina. [3]
| Compuesto como HCl | Adrenoceptores α 2 Vas deferens UK14304 | α 1 -Adrenoceptores Músculo anococcígeo Fenilefrina | Ratones de hipotermia clonidina po | Rotación óptica | Punto de fusion |
|---|---|---|---|---|---|
| Medición | pK B | pK B | DE 50 mg / kg | [α] 20-23 D ° | pf ° C |
| 6 (+/-) rel 3a R , 9a R | 7,86 | 5,00 | 0,66 | 0 | 245 |
| 7 (+) 3a R , 9a R | 7.88 | 4.47 | 0,73 | +159,6 | 235-236 |
| 8 (-) 3a S , 9a S | 7,68 | 4,95 | 0,46 | -159,4 | 238-240 |
Farmacocinética [ editar ]
Fluparoxan tiene una unión a proteínas de rata y humana de 81-92% y 95% respectivamente. Fluparoxan muestra una alta permeabilidad in vitro en células MCDK (Papp nm / s = 2500) y Caco-2 (Papp nm / s = 2000) que se correlaciona bien con la alta absorción intestinal oral conocida (100%) en humanos. [10] El fluparoxano se absorbe bien después de la administración oral en todos los animales. El aclaramiento fue en gran parte metabólico, y las dosis tanto orales como intravenosas se excretaron principalmente a través de la orina (> 90% de la dosis administrada), principalmente como metabolitos de fase II ( conjugados de ácido sulfámico y glucurónido de carbamoilo ). [11] El fluparoxano tiene una alta biodisponibilidad oral (100%) y una acción de larga duración (2 h) en la rata, [1]lo que explica su potencia similar observada por las vías de administración oral e intravenosa en esta especie. [3] La excelente farmacocinética exhibida por fluparoxan en animales también se tradujo en el hombre [1] donde tiene una biodisponibilidad superior (97%) y una duración de acción más prolongada (6-7 horas).
Metabolismo [ editar ]
Fluparoxan no fue metabolizado por las enzimas CYP 1A y CYP 2A del citocromo P450 humano , y se encontró que no es un mutágeno en linfocitos periféricos humanos cultivados y no causa mutación genética cuando se administra a fibroblastos de hámster chino en cultivo. [11] No se identificó ningún potencial mutagénico en las pruebas de mutagenicidad microbiológica, incluida una prueba de fluctuación con activación de S9. No se identificaron metabolitos hidroxilados después de la incubación con microsomas de hígado de rata (S9) o en la orina de rata después de la dosificación oral. [1] El compuesto fue bien tolerado con la administración oral repetida a ratas (≤ 200 mg / kg / día) y perros (≤ 80 mg / kg / día) durante 12 meses.
Química [ editar ]
El (±) fluparoxan 6 racémico es un polvo cristalino blanco como el hidrocloruro hemihidrato, pf 245 ° C. [1] Es una mezcla de dos enantiómeros y es moderadamente lipofílica (log P = 1.2) con buena solubilidad de 80 mg / mL en agua a 25 ° C. El compuesto es muy estable en estado sólido y su biodisponibilidad a partir de la formulación de comprimidos es del 85% y la absorción es rápida. [1]
Síntesis [ editar ]
El (±) fluparoxano 6 racémico se sintetizó por primera vez mediante una ruta convergente, [1] [2] que implicó la conversión del éter bis-bencílico del cis-buteno-1,4-diol 1 en su epóxido 2 seguido de la apertura del anillo catalizada por ácido para un diol racémico que luego se convirtió en el trans bis-tosilato racémico 3 . El acoplamiento de 3-fluorocatecol 4 con el trans bis-tosilato 3 racémico en presencia de base dio por desprotección el benzodioxano diol 5 que se convirtió en 6 racémico mediante el acoplamiento de su bis-mesilato a bencilamina seguido de desprotección. [1] [2]
Los isómeros quirales individuales (+) 7 y (-) 8 de fluparoxano se prepararon originalmente a partir de los isómeros (+) y (-) del tartrato de dietilo a través de los correspondientes trans bis-tosilatos quirales en una ruta convergente similar a la que se muestra en la síntesis. de fluparoxano racémico. [1]
Historia [ editar ]
Aunque se ha demostrado que fluparoxán posee actividad antagonista central de los receptores adrenérgicos α 2 después de dosis orales únicas y repetidas en el hombre, la evaluación clínica en la depresión y su desarrollo para el tratamiento de la disfunción sexual masculina se interrumpió a principios de la década de 1990 cuando el compuesto no mostró una clara ventaja clínica sobre las terapias existentes. Lo mismo es cierto para otros antagonistas de los receptores adrenérgicos α 2 en la depresión y ahora se acepta en general que la hipótesis original de que el bloqueo de los receptores adrenérgicos α 2 presinápticos para aumentar los niveles cerebrales de noradrenalina es insuficiente como base neurobiológica para los trastornos depresivos, con la imagen real Probablemente sea mucho más complejo y heterogéneo, involucrando tanto monoaminérgicosy jugadores no monoaminérgicos. [12] Sin embargo, en contraste, el interés reciente en fluparoxan ha aumentado con sus efectos positivos en el tratamiento de la disfunción cognitiva en enfermedades neurodegenerativas centrales . [1]
Ver también [ editar ]
- Efaroxan
- Idazoxan
Referencias [ editar ]
- ↑ a b c d e f g h i j k l m Borthwick AD (2017). "Fluparoxan: una revisión completa de su descubrimiento, actividad adrenérgica y del SNC y tratamiento de la disfunción cognitiva en enfermedades neurodegenerativas centrales". Mini revisiones en química medicinal . 17 (7): 572–582. doi : 10.2174 / 1389557516666160321115041 . PMID 26996616 .
- ^ a b c Kitchin J, Borthwick AD, Brodie AC, Cherry PC, Crame AJ, Pipe AJ, Procopiou PA, Seaman MA, Turnbull JP (diciembre de 1995). "Síntesis de benzodioxinopirrol como antagonistas selectivos de los receptores adrenérgicos α 2 ". Química bioorgánica y medicinal . 3 (12): 1595–1603. doi : 10.1016 / 0968-0896 (95) 00143-3 . PMID 8770384 .
- ^ a b c d e Halliday CA, Jones BJ, Skingle M, Walsh DM, Wise H, Tyers MB (abril de 1991). "La farmacología de fluparoxan: un antagonista selectivo de los receptores adrenérgicos α 2 " . Revista británica de farmacología . 102 (4): 887–895. doi : 10.1111 / j.1476-5381.1991.tb12272.x . PMC 1917968 . PMID 1677298 .
- ^ Fernández-Pastor B, Meana JJ (mayo de 2002). "Modulación tónica in vivo de la liberación de noradrenalina en la corteza de la rata por receptores adrenérgicos α2 somatodendríticos del locus coeruleus". Revista europea de farmacología . 442 (3): 225–229. doi : 10.1016 / S0014-2999 (02) 01543-1 . PMID 12065075 .
- ^ Cottingham C, Wang Q (noviembre de 2012). "Desregulación del receptor adrenérgico α2 en los trastornos depresivos: implicaciones para la neurobiología de la depresión y la terapia antidepresiva" . Revisiones de neurociencia y bioconducta . 36 (10): 2214–2225. doi : 10.1016 / j.neubiorev.2012.07.011 . PMC 3508310 . PMID 22910678 .
- ^ Marien MR, Colpaert FC, Rosenquist AC (abril de 2004). "Mecanismos noradrenérgicos en enfermedades neurodegenerativas: una teoría". Reseñas de Brain Research . 45 (1): 38–78. doi : 10.1016 / j.brainresrev.2004.02.002 . PMID 15063099 . S2CID 20549357 .
- ^ Gibbs AA, Naudts KH, Azevedo RT, David AS (abril de 2010). "La variante de deleción del gen del receptor adrenérgico α2b modera el efecto del polimorfismo COMT val 158 met en el rendimiento de la memoria episódica". Neuropsicofarmacología europea . 20 (4): 272-275. doi : 10.1016 / j.euroneuro.2009.12.007 . PMID 20110158 . S2CID 32471274 .
- ^ Johnson MA, Blackwell CP, Smith J (mayo de 1995). "Antagonismo de los efectos de la clonidina por el antagonista de los receptores adrenérgicos alfa 2, fluparoxan" . Revista británica de farmacología clínica . 39 (5): 477–483. doi : 10.1111 / j.1365-2125.1995.tb04483.x . PMC 1365053 . PMID 7669482 .
- ^ Scullion GA, Kendall DA, Marsden CA, Sunter D, Pardon MC (marzo de 2011). "El tratamiento crónico con el antagonista de los receptores adrenérgicos α 2 fluparoxan previene los déficits relacionados con la edad en la memoria de trabajo espacial en ratones transgénicos APP × PS1 sin alterar la carga de la placa β-amiloide o la astrocitosis". Neurofarmacología . 60 (2): 223–234. doi : 10.1016 / j.neuropharm.2010.09.002 . PMID 20850464 . S2CID 32320290 .
- ^ Gristwood WE (diciembre de 1990). "Determinación de fluparoxano (GR50360) en plasma por cromatografía de gases". Journal of Chromatography B . 527 (2): 436–440. doi : 10.1016 / S0378-4347 (00) 82128-3 . PMID 2387889 .
- ^ a b Beresford AP, Ellis WJ, Ayrton J, Johnson MA, Lewis DF (enero de 1997). "Inducción del citocromo P4501A (CYP1A) en rata y hombre por el derivado benzodioxino, fluparoxano". Xenobiotica . 27 (2): 159-173. doi : 10.1080 / 004982597240668 . PMID 9058530 .
- ^ Belmaker RH, Agam G (enero de 2008). "Trastorno depresivo mayor". Revista de Medicina de Nueva Inglaterra . 358 (1): 55–68. doi : 10.1056 / NEJMra073096 . PMID 18172175 .
Enlaces externos [ editar ]
- Medios relacionados con Fluparoxan en Wikimedia Commons