En química orgánica , una imida es un grupo funcional que consta de dos grupos acilo unidos al nitrógeno . [1] Los compuestos están relacionados estructuralmente con los anhídridos de ácido , aunque las imidas son más resistentes a la hidrólisis. En términos de aplicaciones comerciales, las imidas se conocen mejor como componentes de polímeros de alta resistencia, llamados poliimidas . Las imidas inorgánicas también se conocen como compuestos en estado sólido o gaseosos, y el grupo imido (= NH) también puede actuar como ligando .
Nomenclatura [ editar ]
La mayoría de las imidas son compuestos cíclicos derivados de ácidos dicarboxílicos y sus nombres reflejan el ácido original. [2] Son ejemplos la succinimida , derivada del ácido succínico , y la ftalimida , derivada del ácido ftálico . Para las imidas derivadas de aminas (a diferencia del amoníaco), el sustituyente N se indica con un prefijo. Por ejemplo, la N-etilsuccinimida se deriva del ácido succínico y la etilamina . Las isoimidas son isoméricas con imidas normales y tienen la fórmula RC (O) OC (NR ') R ”. A menudo son intermedios que se convierten en imidas más simétricas. Compuestos orgánicos llamadoslas carbodiimidas tienen la fórmula RN = C = NR. No están relacionados con las imidas.
Imidas de ácidos dicarboxílicos [ editar ]
Los enlaces de PubChem dan acceso a más información sobre los compuestos, incluidos otros nombres, identificadores, toxicidad y seguridad.
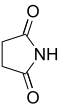
norte Nombre común Nombre sistemático Estructura PubChem ácido padre estructura 2 Succinimida Pirrolidina-2,5-diona 
11439 Ácido succínico 
2, dobles enlaces cis carbono-carbono insaturados Maleimida Pirrol-2,5-diona 
10935 Ácido maleico 
3 Glutarimida Piperidina-2,6-diona 
70726 Ácido glutárico 
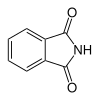
6 Ftalimida Isoindol-1,3-diona 
6809 Ácido ftálico
Propiedades [ editar ]
Al ser altamente polares, las imidas exhiben buena solubilidad en medios polares. El centro N – H de las imidas derivadas del amoníaco es ácido y puede participar en la formación de puentes de hidrógeno . A diferencia de los anhídridos de ácido estructuralmente relacionados, resisten la hidrólisis y algunos incluso pueden recristalizarse en agua hirviendo.
Ocurrencia y aplicaciones [ editar ]
Muchos polímeros de alta resistencia o conductores de electricidad contienen subunidades de imida, es decir, las poliimidas . Un ejemplo es Kapton, donde la unidad de repetición consta de dos grupos imida derivados de ácidos tetracarboxílicos aromáticos. [3] Otro ejemplo de poliimidas es la poliglutarimida hecha típicamente de polimetilmetacrilato (PMMA) y amoníaco o una amina primaria por aminólisis y ciclación del PMMA a alta temperatura y presión, típicamente en una extrusora. Esta técnica se llama extrusión reactiva. La empresa Rohm and Haas produjo un producto comercial de poliglutarimida basado en el derivado de metilamina de PMMA, llamado Kamax. La tenacidad de estos materiales refleja la rigidez del grupo funcional imida.
El interés en la bioactividad de los compuestos que contienen imidas se despertó por el descubrimiento temprano de la alta bioactividad de la cicloheximida como inhibidor de la biosíntesis de proteínas en ciertos organismos. La talidomida , famosa por sus efectos adversos, es uno de los resultados de esta investigación. Varios fungicidas y herbicidas contienen la funcionalidad imida. Los ejemplos incluyen Captan , que se considera cancerígeno en algunas condiciones, y Procymidone . [4]
En el siglo XXI surgió un nuevo interés en los efectos inmunomoduladores de la talidomida, lo que dio lugar a la clase de inmunomoduladores conocidos como fármacos imida inmunomoduladores (IMiD).
Preparación [ editar ]
Las imidas más comunes se preparan calentando ácidos dicarboxílicos o sus anhídridos y amoníaco o aminas primarias . El resultado es una reacción de condensación : [5]
- (RCO) 2 O + R′NH 2 → (RCO) 2 NR ′ + H 2 O
Estas reacciones proceden mediante la intermediación de amidas . La reacción intramolecular de un ácido carboxílico con una amida es mucho más rápida que la reacción intermolecular, que rara vez se observa.
También se pueden producir mediante la oxidación de amidas , particularmente cuando se parte de lactamas . [6]
- R (CO) NHCH 2 R '+ 2 [O] → R (CO) N (CO) R' + H 2 O
También se pueden preparar ciertas imidas en la transposición de Mumm de isoimida a imida .
Reacciones [ editar ]
Para las imidas derivadas del amoníaco, el centro N – H es débilmente ácido. Por tanto, las sales de imidas de metales alcalinos se pueden preparar mediante bases convencionales tales como hidróxido de potasio. La base conjugada de la ftalimida es la ftalimida de potasio . Estos aniones pueden alquilarse para dar N -alquilimidas, que a su vez pueden degradarse para liberar la amina primaria. En la etapa de liberación se utilizan nucleófilos fuertes, como hidróxido de potasio o hidracina .
El tratamiento de imidas con halógenos y bases da lugar a los N -haloderivados. Los ejemplos que son útiles en la síntesis orgánica son N -clorosuccinimida y N - bromosuccinimida , que sirven respectivamente como fuentes de "Cl + " y "Br + " en la síntesis orgánica .
Imidas en química de coordinación [ editar ]
En química de coordinación, los complejos imido de metales de transición presentan el ligando NR 2 . Son similares a los oxo ligandos en algunos aspectos. En algunos, el ángulo MNC es de 180º, pero a menudo el ángulo se dobla decididamente. La imida original (NH 2- ) es un intermedio en la fijación de nitrógeno por catalizadores sintéticos. [7]
Referencias [ editar ]
- ^ "Imidas" . Compendio de terminología química de la IUPAC . 2009. doi : 10.1351 / goldbook.I02948 . ISBN 978-0-9678550-9-7.
- ↑ Martynov, AV (6 de diciembre de 2005). "Nuevo enfoque para la síntesis de imidas de ácido trans-Aconítico". ChemInform . 36 (49): núm. doi : 10.1002 / chin.200549068 . ISSN 1522-2667 .
- ^ Walter W. Wright y Michael Hallden-Abberton "Polyimides" en Enciclopedia de química industrial de Ullmann , 2002, Wiley-VCH, Weinheim. doi : 10.1002 / 14356007.a21_253
- ^ Peter Ackermann, Paul Margot, Franz Müller "Fungicidas agrícolas" en Enciclopedia de química industrial de Ullmann , 2002, Wiley-VCH, Weinheim. doi : 10.1002 / 14356007.a12_085
- ^ Vincent Rodeschini, Nigel S. Simpkins y Fengzhi Zhangi (2009). "Formación ilustrativa de imida a partir de amina y anhídrido" . Síntesis orgánicas .CS1 maint: varios nombres: lista de autores ( enlace ); Volumen colectivo , 11 , p. 1028
- ^ Sperry, Jonathan (27 de septiembre de 2011). "La oxidación de amidas a imidas: una poderosa transformación sintética". Síntesis . 2011 (22): 3569–3580. doi : 10.1055 / s-0030-1260237 .
- ^ Nugent, WA; Mayer, JM, "Metal-Ligand Multiple Bond", J. Wiley: Nueva York, 1988.
- ↑ Hazari, N .; Mountford, P., "Reacciones y aplicaciones de complejos de imido de titanio", Acc. Chem. Res. 2005, 38, 839-849. doi : 10.1021 / ar030244z
Enlaces externos [ editar ]
- IUPAC: imidas