Sulfato de mercurio (I)
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Sulfato de mercurio (I) | |
| Otros nombres Sulfato mercurioso | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.029.084 |
| Número CE |
|
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| Hg 2 SO 4 | |
| Masa molar | 497,24 g / mol |
| Apariencia | cristales de color amarillo blanquecino |
| Densidad | 7,56 g / cm 3 |
| 0,051 g / 100 ml (25 ° C) 0,09 g / 100 ml (100 ° C) | |
| Solubilidad | soluble en ácido nítrico diluido , insoluble en agua , soluble en ácido sulfúrico caliente . |
| −123,0 · 10 −6 cm 3 / mol | |
| Estructura | |
| monoclínico | |
| Termoquímica | |
Capacidad calorífica ( C ) | 132 J · mol −1 · K −1 [1] |
Entropía molar estándar ( S | 200,7 J · mol −1 · K −1 |
| -743,1 kJ · mol −1 | |
| Compuestos relacionados | |
Otros aniones | Fluoruro de mercurio (I) Cloruro de mercurio (I) Bromuro de mercurio (I) Yoduro de mercurio (I) |
Otros cationes | Sulfato de mercurio (II) Sulfato de cadmio Sulfato de talio (I) |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El sulfato de mercurio (I) , comúnmente llamado sulfato mercurioso ( Reino Unido ) o sulfato mercurioso ( EE . UU. ) Es el compuesto químico Hg 2 SO 4 . [2] El sulfato de mercurio (I) es un compuesto metálico que es un polvo blanco, amarillo pálido o beige. [3] Es una sal metálica de ácido sulfúrico formada al reemplazar ambos átomos de hidrógeno con mercurio (I). Es muy tóxico; podría ser fatal si se inhala, ingiere o absorbe por la piel.
Estructura
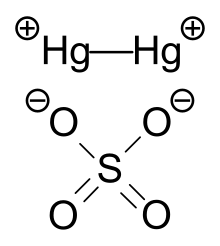
La estructura cristalina del sulfato mercurioso está formada por pesas Hg 2 2+ [ aclaración necesaria ] y aniones SO 4 2− como unidades de construcción principales. La mancuerna Hg 2 2+ está rodeada por cuatro átomos de oxígeno, con una distancia de Hg-O que varía de 2,23 a 2,93 Å, mientras que la distancia Hg-Hg es de aproximadamente 2,50 Å. [4]
Los estudios han demostrado que el sulfato de mercurio (I) tiene los átomos de mercurio dispuestos en dobletes con una distancia de enlace de 2.500 Å. Los dobletes de los átomos de metal están orientados paralelos al eje a [ aclaración necesaria ] en una celda unitaria. Los dobletes de mercurio forman parte de una cadena infinita: SO 4 - Hg - Hg - SO 4 - Hg - Hg - ... El ángulo de enlace Hg - Hg - O es de 165 ° ± 1 °. La cadena cruza la celda unitaria en diagonal. La estructura del sulfato de mercurio se mantiene unida por interacciones débiles de Hg-O. El SO 4 no actúa como un solo anión, sino que está coordinado con el metal mercurio. [5]
Preparación
Una forma de preparar sulfato de mercurio (I) es mezclar la solución ácida de nitrato de mercurio (I) con 1 a 6 solución de ácido sulfúrico :, [6] [7]
- Hg 2 (NO 3 ) 2 + H 2 SO 4 → Hg 2 SO 4 + 2 HNO 3
También se puede preparar haciendo reaccionar un exceso de mercurio con ácido sulfúrico concentrado : [6]
- 2 Hg + 2 H 2 SO 4 → Hg 2 SO 4 + 2 H 2 O + SO 2
Uso en celdas electroquímicas
El sulfato de mercurio (I) se usa a menudo en celdas electroquímicas . [8] [9] [10] Fue introducido por primera vez en celdas electroquímicas por Latimer Clark en 1872, [11] Luego fue alternativamente [ aclaración necesaria ] utilizado en celdas Weston fabricadas por George Augustus Hulett en 1911. [11] Tiene se ha encontrado que es un buen electrodo a altas temperaturas por encima de los 100 ° C junto con el sulfato de plata. [12]
Se ha descubierto que el sulfato de mercurio (I) se descompone a altas temperaturas. El proceso de descomposición es endotérmico y ocurre entre 335 ° C y 500 ° C.
El sulfato de mercurio (I) tiene propiedades únicas que hacen posible las celdas estándar. Tiene una solubilidad bastante baja (alrededor de un gramo por litro); la difusión del sistema de cátodo no es excesiva; y es suficiente para dar un gran potencial en un electrodo de mercurio. [13]
Referencias
- ^ Lide, David R. (1998), Manual de química y física (87 ed.), Boca Raton, FL: CRC Press, págs. 5-19, ISBN 0-8493-0594-2
- ^ Química inorgánica intermedia por JW Mellor, publicado por Longmans, Green and Company, Londres, 1941, página 388
- ^ http://www.chemicalbook.com/ChemicalProductProperty_EN_CB0259783.htm
- ^ Preparación y caracterización de dimercurio (I) monofluorofosfato (V), Hg 2 PO 3 F: estructura cristalina, comportamiento térmico, espectros vibratorios y espectros de RMN de estado sólido 31 P y 19 F por Matthias Weil, Michael Puchberger y Enrique J Baran, publicado por Inorg. Chem. 2004, 43. páginas 8330–8335
- ^ Dormitorio, E. 1969. Estudios estructurales sobre compuestos de mercurio (I). VI. Estructura cristalina de sulfato de mercurio (I) y selenato. Acta Chemica Scandinavica (1947-1973) 23: 1607-15.
- ^ a b Resultado de Google Books , consultado el 11 de diciembre de 2010
- ^ Sulfato mercurioso, sulfato de cadmio y la celda de cadmio. por Hulett GA La revisión física 1907. p.19.
- ^ "Influencia de la microestructura en las propiedades de almacenamiento de carga del dióxido de manganeso sintetizado químicamente" por Mathieu Toupin, Thiery Brousse y Daniel Belanger. Chem. Mater. 2002, 14, 3945–3952
- ^ "Estudios de la fuerza electromotriz de la célula, Cd x Hg y | CdSO 4 , (m) I Hg 2 SO 4 , Hg, en medios de dioxano-agua" por Somesh Chakrabarti y Sukumar Aditya. Journal of Chemical and Engineering Data , Vol.17, No. 1, 1972
- ^ "Caracterización del sulfato de litio como un puente de sal de valencia asimétrica para la minimización de los potenciales de unión de líquidos en mezclas de disolventes acuosos - orgánicos" por Cristiana L. Faverio, Patrizia R. Mussini y Torquato Mussini. Anal. Chem. 1998, 70, 2589–2595
- ^ a b "George Augustus Hulett: de cristales líquidos a celda estándar" por John T. Stock. Toro. Hist. Chem. Volumen 25, Número 2, 2000, p.91-98
- ^ Lietzke, MH; Stoughton, RW (noviembre de 1953). "El comportamiento de los electrodos de plata, sulfato de plata y mercurio, sulfato mercurioso a altas temperaturas 1". Revista de la Sociedad Química Estadounidense . 75 (21): 5226–5227. doi : 10.1021 / ja01117a024 .(requiere suscripción)
- ^ "Sulfatos de mercurio y células estándar". por Elliott, RB y Hulett, GA The Journal of Physical Chemistry 36.7 (1932): 2083-2086.
- Sulfatos
- Compuestos de mercurio (I)