Quimiosmosis
La quimiosmosis es el movimiento de iones a través de una estructura unida a una membrana semipermeable , a lo largo de su gradiente electroquímico . Un ejemplo de esto sería la formación de trifosfato de adenosina (ATP) por el movimiento de iones de hidrógeno (H + ) a través de una membrana durante la respiración celular o la fotosíntesis .
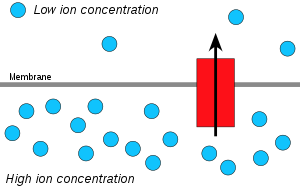
Los iones de hidrógeno, o protones , se difundirán desde un área de alta concentración de protones a un área de menor concentración de protones, y se puede aprovechar un gradiente de concentración electroquímica de protones a través de una membrana para producir ATP. Este proceso está relacionado con la ósmosis , la difusión de agua a través de una membrana, por lo que se le llama "quimiosmosis".
La ATP sintasa es la enzima que produce ATP por quimiosmosis. Permite que los protones pasen a través de la membrana y utiliza la diferencia de energía libre para fosforilar el difosfato de adenosina (ADP), produciendo ATP. La generación de ATP por quimiosmosis ocurre en mitocondrias y cloroplastos , así como en la mayoría de las bacterias y arqueas , una cadena de transporte de electrones bombea iones H + (protones) en los espacios tilacoides a través de las membranas tilacoides al estroma (líquido).. La energía del movimiento de electrones a través de las cadenas de transporte de electrones atraviesa la ATP sintasa, lo que permite que el protón pase a través de ellas y utilice esta diferencia de energía libre para fotofosforilar el ADP y producir ATP.
La teoría quimiosmótica
Peter D. Mitchell propuso la hipótesis quimiosmótica en 1961. [1] La teoría sugiere esencialmente que la mayor parte de la síntesis de trifosfato de adenosina (ATP) en las células que respiran proviene del gradiente electroquímico a través de las membranas internas de las mitocondrias mediante el uso de la energía de NADH y FADH 2 formada a partir de la descomposición de moléculas ricas en energía como glucosa .
Moléculas como la glucosa se metabolizan para producir acetil CoA como intermedio rico en energía. La oxidación de la acetil coenzima A (acetil-CoA) en la matriz mitocondrial está acoplada a la reducción de una molécula portadora como el dinucleótido de nicotinamida y adenina (NAD) y el dinucleótido de flavina y adenina (FAD). [2] Los portadores pasan electrones a la cadena de transporte de electrones (ETC) en la membrana mitocondrial interna , que a su vez los pasa a otras proteínas en el ETC. La energía disponible en los electrones se utiliza para bombearprotones de la matriz a través del estroma, almacenando energía en forma de gradiente electroquímico transmembrana . Los protones regresan a través de la membrana interna a través de la enzima ATP sintasa . El flujo de protones de regreso a la matriz de la mitocondria a través de la ATP sintasa proporciona suficiente energía para que el ADP se combine con el fosfato inorgánico para formar ATP. Los electrones y protones de la última bomba del ETC son absorbidos por el oxígeno para formar agua .
Esta fue una propuesta radical en ese momento y no fue bien aceptada. La opinión predominante era que la energía de la transferencia de electrones se almacenaba como un intermedio estable de alto potencial, un concepto químicamente más conservador. El problema con el paradigma más antiguo es que nunca se encontró ningún intermedio de alta energía, y la evidencia del bombeo de protones por los complejos de la cadena de transferencia de electrones creció demasiado para ser ignorada. Finalmente, el peso de la evidencia comenzó a favorecer la hipótesis quimiosmótica, y en 1978 Peter Mitchell recibió el Premio Nobel de Química . [3]
El acoplamiento quimiosmótico es importante para la producción de ATP en mitocondrias , cloroplastos [4] y muchas bacterias y arqueas . [5]
Fuerza motriz de protones
El movimiento de iones a través de la membrana depende de una combinación de dos factores:
- Fuerza de difusión causada por un gradiente de concentración: todas las partículas tienden a difundirse de una concentración más alta a otra más baja.
- Fuerza electrostática causada por gradiente de potencial eléctrico : los cationes como los protones H + tienden a difundirse hacia abajo del potencial eléctrico, desde el lado positivo (P) de la membrana hacia el lado negativo (N). Los aniones se difunden espontáneamente en la dirección opuesta.
Estos dos gradientes tomados en conjunto se pueden expresar como gradiente electroquímico .
Sin embargo, las bicapas lipídicas de las membranas biológicas son barreras para los iones. Es por eso que la energía se puede almacenar como una combinación de estos dos gradientes a través de la membrana. Solo las proteínas de membrana especiales, como los canales iónicos, a veces pueden permitir que los iones se muevan a través de la membrana (ver también: Transporte de membrana ). En la teoría quimiosmótica, las ATP sintasas transmembrana son muy importantes. Convierten la energía del flujo espontáneo de protones a través de ellos en energía química de enlaces ATP.
Por lo tanto, los investigadores crearon el término fuerza motriz de protones (PMF), derivado del gradiente electroquímico mencionado anteriormente. Puede describirse como la medida de la energía potencial almacenada como una combinación de gradientes de protones y voltaje (potencial eléctrico) a través de una membrana. El gradiente eléctrico es una consecuencia de la separación de carga a través de la membrana (cuando los protones H + se mueven sin un contraión , como el cloruro Cl - ).
En la mayoría de los casos, la fuerza motriz del protón es generada por una cadena de transporte de electrones que actúa como una bomba de protones, utilizando la energía libre de Gibbs de las reacciones redox para bombear protones (iones de hidrógeno) a través de la membrana, separando la carga a través de la membrana. En las mitocondrias, la energía liberada por la cadena de transporte de electrones se utiliza para mover protones desde la matriz mitocondrial (lado N) al espacio intermembrana (lado P). Mover los protones fuera de la mitocondria crea una concentración más baja de protones cargados positivamente en su interior, lo que resulta en un exceso de carga negativa en el interior de la membrana. El gradiente de potencial eléctrico es de aproximadamente -170 mV [6], interior negativo (N). Estos gradientes: la diferencia de carga y la diferencia de concentración de protones crean un gradiente electroquímico combinado a través de la membrana, a menudo expresado como la fuerza motriz del protón (PMF). En las mitocondrias, la PMF está formada casi en su totalidad por el componente eléctrico, pero en los cloroplastos la PMF está formada principalmente por el gradiente de pH porque la carga de los protones H + es neutralizada por el movimiento de Cl - y otros aniones. En cualquier caso, el PMF debe ser superior a aproximadamente 460 mV (45 kJ / mol) para que la ATP sintasa pueda producir ATP.
Ecuaciones
La fuerza motriz del protón se deriva de la energía libre de Gibbs . Sea N el interior de una celda y P el exterior. Entonces [6]
donde
- es el cambio de energía libre de Gibbs por unidad de cantidad de cationes transferidos de P a N;
- es el número de carga del catión ;
- es el potencial eléctrico de N en relación con P;
- y son las concentraciones de cationes en P y N, respectivamente;
- es la constante de Faraday ;
- es la constante del gas ; y
- es la temperatura .
El cambio de energía libre de Gibbs molar se interpreta con frecuencia como un potencial iónico electroquímico molar .
Para un gradiente de protones electroquímico y como consecuencia:
donde
- .
Mitchell definió la fuerza motriz del protón (PMF) como
- .
Por ejemplo, implica . En esta ecuación toma la forma:
.
Tenga en cuenta que para la importación espontánea de protones desde el lado P (relativamente más positivo y ácido) al lado N (relativamente más negativo y alcalino), es negativo (similar a ) mientras que PMF es positivo (similar al potencial celular redox ).
Vale la pena señalar que, como con cualquier proceso de transporte transmembrana, el PMF es direccional. El signo de la diferencia de potencial eléctrico transmembrana se elige para representar el cambio en la energía potencial por unidad de carga que fluye hacia la celda como se indicó anteriormente. Además, debido al bombeo de protones impulsado por redox por los sitios de acoplamiento, el gradiente de protones es siempre alcalino en el interior. Por ambas razones, los protones fluyen espontáneamente desde el lado P al lado N; la energía libre disponible se utiliza para sintetizar ATP (ver más abajo). Por esta razón, PMF se define para la importación de protones, que es espontánea. PMF para la exportación de protones, es decir, bombeo de protones catalizado por los sitios de acoplamiento, es simplemente el negativo de PMF (importación).
La espontaneidad de la importación de protones (del lado P al N) es universal en todas las membranas bioenergéticas. [8] Este hecho no se reconoció antes de la década de 1990, porque la luz tilacoide del cloroplasto se interpretó como una fase interior, pero de hecho es topológicamente equivalente al exterior del cloroplasto. Azzone y col. destacó que la fase interna (lado N de la membrana) es el citoplasma bacteriano, la matriz mitocondrial o el estroma del cloroplasto; el lado exterior (P) es el espacio periplásmico bacteriano, el espacio intermembrana mitocondrial o la luz del cloroplasto. Además, la tomografía 3D de la membrana interna mitocondrial muestra que sus extensas invaginaciones están apiladas, de forma similar a los discos tilacoides; por lo tanto, el espacio intermembrana mitocondrial es topológicamente bastante similar al lumen del cloroplasto:[9]
La energía expresada aquí como energía libre de Gibbs, gradiente de protones electroquímico o fuerza motriz de protones (PMF), es una combinación de dos gradientes a través de la membrana:
- el gradiente de concentración (vía ) y
- gradiente de potencial eléctrico .
Cuando un sistema alcanza el equilibrio ,; sin embargo, no es necesario que las concentraciones a ambos lados de la membrana sean iguales. El movimiento espontáneo a través de la membrana de potencial está determinado tanto por la concentración como por los gradientes de potencial eléctrico.
La energía libre de Gibbs molar de la síntesis de ATP
también se llama potencial de fosforilación. La relación de concentración de equilibrio se puede calcular comparando y , por ejemplo, en el caso de la mitocondria de mamífero: [9]
H + / ATP = ΔG p / (Δp / 10,4 kJ · mol -1 / mV) = 40,2 kJ · mol -1 / (173,5 mV / 10,4 kJ · mol -1 / mV) = 40,2 / 16,7 = 2,4. La relación real de la subunidad c de unión de protones a los números de copia de la subunidad beta que sintetiza ATP es 8/3 = 2,67, lo que muestra que en estas condiciones, la mitocondria funciona al 90% (2,4 / 2,67) de eficiencia. [9]
De hecho, la eficiencia termodinámica es mayormente menor en las células eucariotas porque el ATP debe exportarse desde la matriz al citoplasma y el ADP y el fosfato deben importarse del citoplasma. Esto "cuesta" una importación de protones "extra" por ATP, [6] [7] por lo que la eficiencia real es sólo del 65% (= 2,4 / 3,67).
En las mitocondrias
La descomposición completa de la glucosa en presencia de oxígeno se denomina respiración celular . Los últimos pasos de este proceso ocurren en las mitocondrias. Las moléculas reducidas NADH y FADH 2 son generadas por el ciclo de Krebs , la glucólisis y el procesamiento del piruvato . Estas moléculas pasan electrones a una cadena de transporte de electrones , que utiliza la energía liberada para crear un gradiente de protones a través de la membrana mitocondrial interna . La ATP sintasa luego usa la energía almacenada en este gradiente para producir ATP. Este proceso se llamafosforilación oxidativa porque utiliza la energía liberada por la oxidación de NADH y FADH2 para fosforilar el ADP en ATP .
En plantas
Las reacciones lumínicas de la fotosíntesis generan ATP por acción de la quimiosmosis. Los fotones de la luz solar son recibidos por el complejo de antenas del Fotosistema II , que excita los electrones a un nivel de energía más alto . Estos electrones viajan por una cadena de transporte de electrones , lo que hace que los protones se bombeen activamente a través de la membrana tilacoide hacia la luz tilacoide . Estos protones luego fluyen por su gradiente de potencial electroquímico a través de una enzima llamada ATP-sintasa, creando ATP mediante la fosforilación de ADP a ATP. Los electrones de la inicialLa reacción de luz alcanza el Fotosistema I , luego se eleva a un nivel de energía más alto por la energía de la luz y luego es recibida por un aceptor de electrones y reduce NADP + a NADPH . Los electrones perdidos del Fotosistema II son reemplazados por la oxidación del agua, que es "dividida" en protones y oxígeno por el complejo que genera oxígeno (OEC, también conocido como WOC, o el complejo oxidante del agua). Para generar una molécula de oxígeno diatómico, los fotosistemas I y II deben absorber 10 fotones, cuatro electrones deben moverse a través de los dos fotosistemas y se generan 2 NADPH (luego utilizados para la fijación de dióxido de carbono en el ciclo de Calvin).
En procariotas
Las bacterias y arqueas también pueden utilizar la quimiosmosis para generar ATP. Las cianobacterias , las bacterias verdes del azufre y las bacterias violetas sintetizan ATP mediante un proceso llamado fotofosforilación . Estas bacterias utilizan la energía de la luz para crear un gradiente de protones utilizando una cadena de transporte de electrones fotosintéticos . Las bacterias no fotosintéticas como E. coli también contienen ATP sintasa . De hecho, las mitocondrias y los cloroplastos son el producto de la endosimbiosis y se remontan a los procariotas incorporados. Este proceso se describe en la teoría endosimbiótica.. El origen de la mitocondria desencadenó el origen de los eucariotas, y el origen del plástido el origen de Archaeplastida, uno de los principales supergrupos eucariotas.
La fosforilación quimiosmótica es la tercera vía que produce ATP a partir de fosfato inorgánico y una molécula de ADP. Este proceso es parte de la fosforilación oxidativa.
Ver también
- Bacteriorrodopsina
- Respiración celular
- Ciclo del ácido cítrico
- Gradiente electroquímico
- Glucólisis
- Fosforilación oxidativa
Referencias
- ^ Peter Mitchell (1961). "Acoplamiento de la fosforilación a la transferencia de electrones e hidrógeno mediante un mecanismo de tipo quimiosmótico". Naturaleza . 191 (4784): 144-148. Código Bibliográfico : 1961Natur.191..144M . doi : 10.1038 / 191144a0 . PMID 13771349 . S2CID 1784050 .
- ^ Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter (2002). "Los gradientes de protones producen la mayor parte del ATP de la célula" . Biología molecular de la célula . Guirnalda. ISBN 0-8153-4072-9.
- ^ El Premio Nobel de Química 1978.
- ^ Cooper, Geoffrey M. (2000). "Figura 10.22: Transporte de electrones y síntesis de ATP durante la fotosíntesis" . La célula: un enfoque molecular (2ª ed.). Sinauer Associates, Inc. ISBN 0-87893-119-8.
- ^ Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter (2002). "Figura 14-32: La importancia del transporte impulsado por H + en bacterias" . Biología molecular de la célula . Guirnalda. ISBN 0-8153-4072-9.
- ^ a b c d e f Nicholls DG ; Ferguson SJ (1992). Bioenergética 2 (2ª ed.). San Diego: Prensa académica. ISBN 9780125181242.
- ↑ a b c Stryer, Lubert (1995). Bioquímica (cuarta ed.). Nueva York - Basingstoke: WH Freeman and Company. ISBN 978-0716720096.
- ^ Azzone, Giovanni; et al. (1993). "Mediciones transmembrana a través de membranas bioenergéticas". Biochimica et Biophysica Acta (BBA) - Bioenergética . 1183 (1): 1-3. doi : 10.1016 / 0005-2728 (93) 90002-W .
- ↑ a b c Silverstein, Todd (2014). "Una exploración de cómo varía la eficiencia termodinámica de los sistemas de membranas bioenergéticas con la estequiometría de la subunidad c de las sintasas de ATP F 1 F 0 ". Revista de Bioenergética y Biomembranas . 46 (3): 229–241. doi : 10.1007 / s10863-014-9547-y . PMID 24706236 . S2CID 1840860 .
Otras lecturas
- Referencia del libro de texto de bioquímica, de la estantería del NCBI : Jeremy M. Berg; John L. Tymoczko; Lubert Stryer (eds.). "18.4. Un gradiente de protones potencia la síntesis de ATP". Bioquímica (5ª ed.). WH Freeman.
- Referencia técnica que relaciona un conjunto de experimentos con el objetivo de probar algunos principios de la teoría quimiosmótica : Seiji Ogawa y Tso Ming Lee (1984). "La relación entre el potencial de fosforilación interna y la fuerza motriz del protón en las mitocondrias durante la síntesis y la hidrólisis de ATP". Revista de Química Biológica . 259 (16): 10004–10011. PMID 6469951 .
enlaces externos
- Quimiosmosis (Universidad de Wisconsin)
- Biología Celular
- Respiración celular
![{\ Displaystyle \ Delta \! G = zF \ Delta \! \ psi + RT \ ln {\ frac {[\ mathrm {X} ^ {z +}] _ {\ text {N}}} {[\ mathrm {X } ^ {z +}] _ {\ text {P}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e49984fb465bfe70fdf147d5c94b4691fde30b93)




![{\ Displaystyle [\ mathrm {X} ^ {z +}] _ {\ text {P}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b04667620cf542631c6a2a692aefd89310230ddd)
![{\ Displaystyle [\ mathrm {X} ^ {z +}] _ {\ text {N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4da81b44fd243b0610ca90f2a571ffe2891ad71)





![{\ Displaystyle \ Delta \! \ mu _ {\ mathrm {H} ^ {+}} = F \ Delta \! \ psi + RT \ ln {\ frac {[\ mathrm {H} ^ {+}] _ { \ text {N}}} {[\ mathrm {H} ^ {+}] _ {\ text {P}}}} = F \ Delta \! \ psi - (\ ln 10) RT \ Delta \ mathrm {pH }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9401e1568170355be3a960a583f16f2d93c5a842)













![{\ Displaystyle [\ mathrm {H} ^ {+}] / [\ mathrm {ATP}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e253bb9b194bd7dd88012ff9e7acd912dbf6931)
