Las quinuclidonas son una clase de compuestos orgánicos bicíclicos con fórmula química C 7 H 11 NO con dos isómeros estructurales para el esqueleto básico 3-quinuclidona y 2-quinuclidona .
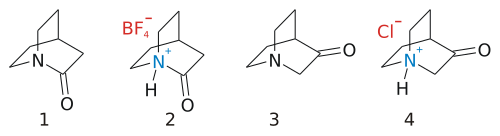
La 3-quinuclidona (1-azabiciclo [2.2.2] octan-3-ona) es una molécula sin incidentes que se puede sintetizar como sal de ácido clorhídrico en una condensación Dieckman : [1]

La reducción orgánica de este compuesto da el compuesto quinuclidina , estructuralmente relacionado con DABCO , que tiene un átomo de nitrógeno de cabeza de puente adicional.
El otro isómero, 2-quinuclidona, parece igualmente tranquilo, pero de hecho ha desafiado la síntesis hasta 2006. [2] [3] [4] [5] La razón es que esta molécula es muy inestable porque su grupo amida tiene la amina un par solitario y el grupo carbonilo no están correctamente alineados, como puede esperarse de una amida, como resultado de la deformación estérica . Este comportamiento está predicho por la regla de Bredt , y el grupo amida formal se asemeja de hecho a una amina , como lo demuestra la facilidad de formación de sal.
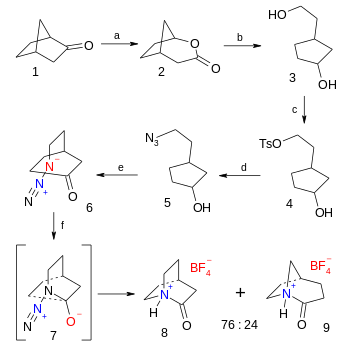
La síntesis orgánica de la sal de tetrafluoroborato de 2-quinuclidona es un asunto de seis pasos a partir de norcamphor, el paso final es una reacción de Schmidt azida - cetona (38% de rendimiento): [6]
Este compuesto reacciona rápidamente con el agua al aminoácido correspondiente con una vida media química de 15 segundos. La difracción de rayos X muestra piramidalización en el átomo de nitrógeno (59 ° en comparación con 0 para la dimetilformamida de referencia ) y torsión alrededor del enlace carbono-nitrógeno en una extensión de 91 °. Los intentos de preparar la base libre conducen a una polimerización incontrolada .
No obstante, es posible estimar su basicidad en un experimento en el que se introducen pares de amina (la sal de quinuclidonio y una amina de referencia como dietilamina o indolina ) en un espectrómetro de masas . La basicidad relativa se revela luego por la disociación del heterodímero inducida por colisión. Un análisis adicional a través del método cinético extendido permite la determinación de la afinidad protónica y la basicidad de la fase gaseosa del 2-quinuclidonio. Este método ha determinado que la quinuclidona se encuentra entre las aminas secundarias y terciarias en términos de afinidad protónica. [7] Se presume que esta alta basicidad se debe a la pérdida de la deslocalización de los electrones cuando se tuerce el enlace amida; esto provoca una desalineación de los orbitales pi, lo que da como resultado la pérdida de resonancia electrónica.
Referencias
- ^ Síntesis orgánica , Coll. Vol. 5, p. 989 (1973); Vol. 44, p. 86 (1964) Artículo
- ^ Síntesis y análisis estructural de tetrafluoroborato de 2-quinuclidonio Kousuke Tani y Brian M. Stoltz Nature 441, 731-734 (8 de junio de 2006 ) | doi : 10.1038 / nature04842
- ^ Blogueo en www.totallysynthetic.com Enlace el 11 de junio
- ^ Bethany Halford Amide con una novedad química e ingeniería Twist 12 de junio de 2006 Volumen 84, número 24 p. Artículo
- ^ Clayden, Jonathan; Moran, Wesley J. (2006). "La amida torcida 2-quinuclidona: 60 años en la fabricación". Angewandte Chemie International Edition . 45 (43): 7118–7120. doi : 10.1002 / anie.200603016 . ISSN 1433-7851 .
- ^ Secuencia de reacción: El primer paso es una oxidación de Baeyer-Villiger de norcanfor 1 con ácido metacloroperoxibenzoico a lactona bicíclica 2 , seguida de reducción orgánica con hidruro de litio y aluminio en éter dietílico a diol 3 . Elgrupo alcohol primariose reemplaza por ungrupo tosilato en 4 con cloruro de tosilo y trietilamina y, a su vez, se desplaza por ungrupo azida en 5 por acción de azida de sodio en dimetilformamida . La oxidación del alcohol a la cetona 6 tiene lugar con periodinano de Dess-Martin en diclorometano . El paso final para el tetrafluoroborato 8 de 2-quinuclidonio es una reacción de Schmidt a través del intermedio 7 con ácido fluorobórico en éter dietílico .
- ^ Síntesis de 2-quinuclidonio mediante la eliminación de agua: cuantificación experimental de la alta basicidad de amidas extremadamente retorcidas Tony Ly, Michael Krout, Don K. Pham, Kousuke Tani, Brian M. Stoltz y Ryan R. Julian J. Am. Chem. Soc. ; 2007 ; 129 (7) págs. 1864 - 1865; (Comunicación) doi : 10.1021 / ja067703m