Receptor de VLDL
El receptor de lipoproteínas de muy baja densidad ( VLDLR ) es un receptor de lipoproteínas transmembrana de la familia de receptores de lipoproteínas de baja densidad (LDL) . VLDLR muestra una homología considerable con los miembros de este linaje. Descubierto en 1992 por T. Yamamoto, el VLDLR se distribuye ampliamente por los tejidos del cuerpo, incluidos el corazón, el músculo esquelético , el tejido adiposo y el cerebro, pero está ausente en el hígado. [5] Este receptor tiene un papel importante en la captación de colesterol, el metabolismo de las lipoproteínas ricas en triacilglicerol que contienen apolipoproteína E , ymigración neuronal en el cerebro en desarrollo. En los seres humanos, VLDLR está codificado por el gen VLDLR . Las mutaciones de este gen pueden provocar una variedad de síntomas y enfermedades, que incluyen lisencefalia tipo I , hipoplasia cerebelosa y aterosclerosis .
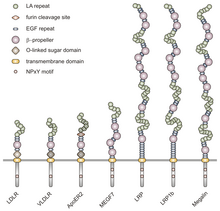
VLDLR es un miembro de la familia de receptores de lipoproteínas de baja densidad (LDL) , que está compuesta en su totalidad por receptores de lipoproteínas transmembrana tipo I.
Todos los miembros de esta familia comparten cinco dominios estructurales altamente conservados: un dominio extracelular de unión al ligando N-terminal con repeticiones ricas en cisteína (también llamadas repeticiones de unión al ligando), un factor de crecimiento epidérmico (EGF), un dominio de azúcar de glicosilación ligado a O , una única secuencia transmembrana y un dominio citoplásmico que contiene una secuencia NPxY. El motivo NPxY funciona en la transducción de señales y el direccionamiento de receptores a fosas recubiertas y consiste en la secuencia Asparagina-Prolina-X-Tirosina, donde X puede ser cualquier aminoácido. [6] Imitando esta estructura general, VLDLR tiene ocho repeticiones ricas en cisteína de 40 aminoácidos de longitud en su dominio extracelular de unión al ligando N-terminal. [6]Esta es la principal diferencia con el miembro principal de la familia de receptores de LDL, LDLR , que tiene solo siete repeticiones ricas en cisteína que también tienen una longitud de 40 aminoácidos. [7] Cada una de estas repeticiones ricas en cisteína, tanto en VLDLR como en LDLR, tiene tres enlaces disulfuro y un ion Ca 2+ coordinado . El extremo N también consta de un residuo de glicina seguido de 27 residuos hidrófobos que constituyen el péptido señal . [6] A continuación de esta región hay una repetición de EGF, un segmento de hélice β que desempeña un papel en la disociación dependiente del pH del complejo ligando-receptor, [8] y dos repeticiones de EGF más. [9]El dominio de glicosilación ligado a VLDLR O, que sigue en la secuencia, tiene muchos residuos de treonina y serina y totaliza 46 aminoácidos. El dominio transmembrana, que funciona para anclar los receptores a la membrana, tiene una longitud de 22 aminoácidos. [6] Al final de la secuencia está el dominio citoplásmico de 54 aminoácidos, que contiene el motivo NPxY. [8]
El genoma de VLDLR humano de longitud completa se encuentra en el locus 9p24 en el cromosoma 9. Consiste en un segmento de 40 kb que incluye 19 secuencias codificantes de exón , que es un exón más que el codificado por LDLR . Este exón adicional en el gen VLDLR explica la repetición adicional de unión a cisteína que no se encuentra en LDLR. [7] Juntos, los exones que forman el gen VLDLR codifican una proteína que tiene 873 residuos de aminoácidos de longitud. Se sabe que VLDLR existe como cuatro isoformas de proteínas diferentes : tipo I, II, III y IV. Estas diferentes isoformas son el resultado de variaciones en el empalme alternativo.. La transcripción de VLDLR tipo I (VLDLR-I) está compuesta por los 19 exones. VLDLR-II, por otro lado, carece del exón 16, que codifica el dominio de O-glicosilación entre las regiones de azúcar. VLDLR-III carece del exón 4 que codifica la tercera repetición de unión al ligando . Finalmente, las transcripciones de VLDLR-IV carecen tanto del exón 16 como del exón 4. Se ha demostrado que el 75% de las transcripciones de VLDLR existen como isoforma tipo II en modelos de cerebro de ratón . Esto muestra que la mayoría de los VLDLR en el cerebro no están glicosilados, ya que el tipo II carece del exón 16 que codifica el dominio de O-glicosilación. Se sabe que la isoforma tipo IV es la segunda más prominente. [6]