(Redirigido de 4-hidroxinorefedrina )
Saltar a navegación Saltar a búsqueda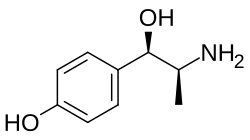 | |
| Datos clinicos | |
|---|---|
| Otros nombres | 4-Hydroxynorephedrine para -Hydroxynorephedrine |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| ChemSpider | |
| Datos químicos y físicos | |
| Fórmula | C 9 H 13 N O 2 |
| Masa molar | 167,208 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
p -Hydroxynorephedrine ( PHN ), o 4-hydroxynorephedrine , es el párrafo hidroxi análogo de norefedrina y un activo simpaticomimético metabolito de la anfetamina en los seres humanos. [1] [2] Cuando se presenta como un metabolito de la anfetamina, se produce a partir de p -hidroxianfetamina y norefedrina. [2] [3] [4]
Metabolismo de las anfetaminas [ editar ]
Vías metabólicas de la anfetamina en humanos [fuentes 1] |
Notas [ editar ]
- ^ 4-hydroxyamphetamine se ha demostrado para ser metabolizado en 4-hydroxynorephedrine por la dopamina beta-hidroxilasa (DBH) in vitro y se presume que son metabolizados de manera similar in vivo . [6] [11] La evidencia de estudios que midieron el efecto de las concentraciones séricas de DAP sobre elmetabolismo de la 4-hidroxianfetamina en humanos sugiere que una enzima diferente puede mediar la conversión de 4-hidroxianfetamina en 4-hidroxinorrefedrina ; [11] [13] sin embargo, otra evidencia de estudios en animales sugiere que esta reacción es catalizada por DAP en vesículas sinápticasdentro de las neuronas noradrenérgicas del cerebro. [14] [15]
Ver también [ editar ]
- Hidroxinorefedrina
Referencias [ editar ]
- ^ [5] [6] [7] [8] [9] [10] [11] [12]
Referencias [ editar ]
- ^ "p-hidroxinorefedrina" . NCBI . Compuesto PubChem . Consultado el 25 de octubre de 2013 .
- ^ a b "Información de prescripción de Adderall XR" (PDF) . Guía de medicación . Administración de Drogas y Alimentos de los Estados Unidos . Consultado el 7 de octubre de 2013 .
- ^ "Anfetamina: efectos biomédicos y toxicidad" . NCBI . Compuesto Pubchem . Consultado el 12 de octubre de 2013 .
- ^ Santagati NA, Ferrara G, Marrazzo A, Ronsisvalle G (septiembre de 2002). "Determinación simultánea de anfetamina y uno de sus metabolitos por HPLC con detección electroquímica". J. Pharm. Biomed. Anal . 30 (2): 247–55. doi : 10.1016 / S0731-7085 (02) 00330-8 . PMID 12191709 .
- ^ "Información de prescripción de Adderall XR" (PDF) . Administración de Drogas y Alimentos de los Estados Unidos . Shire US Inc. Diciembre de 2013. págs. 12–13 . Consultado el 30 de diciembre de 2013 .
- ↑ a b Glennon RA (2013). "Estimulantes de fenilisopropilamina: agentes relacionados con las anfetaminas" . En Lemke TL, Williams DA, Roche VF, Zito W (eds.). Principios de química medicinal de Foye (7ª ed.). Filadelfia, Estados Unidos: Wolters Kluwer Health / Lippincott Williams & Wilkins. págs. 646–648. ISBN 9781609133450.
La fenilisopropilamina no sustituida más simple, el 1-fenil-2-aminopropano o anfetamina, sirve como plantilla estructural común para los alucinógenos y psicoestimulantes. La anfetamina produce acciones estimulantes centrales, anoréxicas y simpaticomiméticas, y es el miembro prototipo de esta clase (39). ... El metabolismo de fase 1 de los análogos de anfetaminas está catalizado por dos sistemas: el citocromo P450 y la flavina monooxigenasa. ... La anfetamina también puede sufrir hidroxilación aromática a p -hidroxianfetamina. ... La oxidación posterior en la posición bencílica por DA β-hidroxilasa produce p -hidroxinorefedrina. Alternativamente, la oxidación directa de anfetamina por DA β-hidroxilasa puede producir norefedrina.
- ^ Taylor KB (enero de 1974). "Dopamina-beta-hidroxilasa. Curso estereoquímico de la reacción" (PDF) . Revista de Química Biológica . 249 (2): 454–458. PMID 4809526 . Consultado el 6 de noviembre de 2014 .
La dopamina-β-hidroxilasa catalizó la eliminación del átomo de hidrógeno pro-R y la producción de 1-norefedrina, (2
S
, 1
R
) -2-amino-1-hidroxil-1-fenilpropano, a partir de d-anfetamina.
- ^ Krueger SK, Williams DE (junio de 2005). "Monooxigenasas que contienen flavina de mamíferos: estructura / función, polimorfismos genéticos y papel en el metabolismo de fármacos" . Farmacología y terapéutica . 106 (3): 357–387. doi : 10.1016 / j.pharmthera.2005.01.001 . PMC 1828602 . PMID 15922018 .
Tabla 5: Fármacos que contienen N y xenobióticos oxigenados por FMO - ^ Cashman JR, Xiong YN, Xu L, Janowsky A (marzo de 1999). "N-oxigenación de anfetamina y metanfetamina por la monooxigenasa que contiene flavina humana (forma 3): papel en la bioactivación y desintoxicación". Revista de Farmacología y Terapéutica Experimental . 288 (3): 1251-1260. PMID 10027866 .
- ^ Santagati NA, Ferrara G, Marrazzo A, Ronsisvalle G (septiembre de 2002). "Determinación simultánea de anfetamina y uno de sus metabolitos por HPLC con detección electroquímica". Revista de análisis farmacéutico y biomédico . 30 (2): 247-255. doi : 10.1016 / S0731-7085 (02) 00330-8 . PMID 12191709 .
- ↑ a b c Sjoerdsma A, von Studnitz W (abril de 1963). "Actividad de la dopamina-beta-oxidasa en el hombre, utilizando hidroxianfetamina como sustrato" . Revista británica de farmacología y quimioterapia . 20 : 278-284. doi : 10.1111 / j.1476-5381.1963.tb01467.x . PMC 1703637 . PMID 13977820 .
Se administró hidroxianfetamina por vía oral a cinco sujetos humanos ... Dado que la conversión de hidroxianfetamina en hidroxinorefedrina se produce in vitro por la acción de la dopamina-β-oxidasa, se sugiere un método simple para medir la actividad de esta enzima y el efecto de sus inhibidores en el hombre . ... La falta de efecto de la administración de neomicina a un paciente indica que la hidroxilación se produce en los tejidos corporales. ... una parte importante de la β-hidroxilación de la hidroxianfetamina se produce en el tejido no suprarrenal. Desafortunadamente, en la actualidad no se puede estar completamente seguro de que la hidroxilación de la hidroxianfetamina in vivo se lleve a cabo mediante la misma enzima que convierte la dopamina en noradrenalina.
- ^ Badenhorst CP, van der Sluis R, Erasmus E, van Dijk AA (septiembre de 2013). "Conjugación de glicina: importancia en el metabolismo, el papel de la glicina N-aciltransferasa y factores que influyen en la variación interindividual". Opinión de expertos sobre metabolismo y toxicología de fármacos . 9 (9): 1139-1153. doi : 10.1517 / 17425255.2013.796929 . PMID 23650932 .
Figura 1. Conjugación de glicina del ácido benzoico. La vía de conjugación de glicina consta de dos pasos. El primer benzoato se liga a CoASH para formar el tioéster de benzoil-CoA de alta energía. Esta reacción es catalizada por el ácido de cadena media HXM-A y HXM-B: CoA ligasas y requiere energía en forma de ATP. ... El benzoil-CoA luego se conjuga con glicina por GLYAT para formar ácido hipúrico, liberando CoASH. Además de los factores enumerados en los recuadros, los niveles de ATP, CoASH y glicina pueden influir en la velocidad general de la vía de conjugación de glicina.
- ^ Horwitz D, Alexander RW, Lovenberg W, Keizer HR (mayo de 1973). "Dopamina-β-hidroxilasa de suero humano. Relación con la hipertensión y la actividad simpática". Investigación de circulación . 32 (5): 594–599. doi : 10.1161 / 01.RES.32.5.594 . PMID 4713201 .
La importancia biológica de los diferentes niveles de actividad de DβH en suero se estudió de dos formas. En primer lugar, se comparó la capacidad in vivo para β-hidroxilar el sustrato sintético hidroxianfetamina en dos sujetos con baja actividad de DβH en suero y dos sujetos con actividad media. ... En un estudio, se administró hidroxianfetamina (Paredrine), un sustrato sintético para DβH, a sujetos con niveles bajos o medios de actividad de DβH en suero. El porcentaje de fármaco hidroxilado a hidroxinorefedrina fue comparable en todos los sujetos (6,5-9,62) (Tabla 3).
- ^ Freeman JJ, Sulser F (diciembre de 1974). "Formación de p-hidroxinorefedrina en el cerebro después de la administración intraventricular de p-hidroxianfetamina". Neurofarmacología . 13 (12): 1187-1190. doi : 10.1016 / 0028-3908 (74) 90069-0 . PMID 4457764 .
En especies en las que la hidroxilación aromática de la anfetamina es la principal vía metabólica, la
p
-hidroxianfetamina (POH) y la
p
-hidroxinorrefedrina (PHN) pueden contribuir al perfil farmacológico del fármaco original. ... La ubicación de la
p
Las reacciones de -hidroxilación y β-hidroxilación son importantes en especies donde la hidroxilación aromática de anfetamina es la vía predominante de metabolismo. Después de la administración sistémica de anfetamina a ratas, se ha encontrado POH en orina y plasma.
La falta observada de una acumulación significativa de PHN en el cerebro después de la administración intraventricular de (+) - anfetamina y la formación de cantidades apreciables de PHN a partir de (+) - POH en tejido cerebral in vivo respalda la opinión de que la hidroxilación aromática de anfetamina después de su administración sistémica ocurre predominantemente en la periferia, y entonces la POH es transportada a través de la barrera hematoencefálica, captada por neuronas noradrenérgicas en el cerebro, donde la (+) - POH se convierte en las vesículas de almacenamiento por la dopamina β-hidroxilasa en PHN. - ^ Matsuda LA, Hanson GR, Gibb JW (diciembre de 1989). "Efectos neuroquímicos de los metabolitos de las anfetaminas en los sistemas central dopaminérgico y serotoninérgico". Revista de Farmacología y Terapéutica Experimental . 251 (3): 901–908. PMID 2600821 .
El metabolismo de
p
-OHA en
p
-OHNor está bien documentado y la dopamina-β hidroxilasa presente en las neuronas noradrenérgicas podría convertir fácilmente
p
-OHA en
p
-OHN o después de la administración intraventricular.
Enlaces externos [ editar ]
- p-hidroxinorefedrina en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
