Los antioxidantes son compuestos que inhiben la oxidación , una reacción química que puede producir radicales libres y reacciones en cadena que pueden dañar las células de los organismos. Los antioxidantes como los tioles o el ácido ascórbico (vitamina C) pueden actuar para inhibir estas reacciones. Para equilibrar el estrés oxidativo , las plantas y los animales mantienen complejos sistemas de antioxidantes superpuestos, como el glutatión .
Las única dietéticos antioxidantes son las vitaminas A , C y E . El término antioxidante también se utiliza para los productos químicos industriales que se agregan durante la fabricación para prevenir la oxidación en caucho sintético , plásticos y combustibles, o como conservantes en alimentos y cosméticos . [1]
No se ha demostrado que los suplementos dietéticos comercializados como antioxidantes mejoren la salud o prevengan enfermedades en los seres humanos. [2] Los suplementos de betacaroteno , vitamina A y vitamina E no tienen un efecto positivo sobre la tasa de mortalidad [3] [4] o el riesgo de cáncer . [5] [ necesita actualización ] [6] Además, la suplementación con selenio o vitamina E no reduce el riesgo de enfermedad cardiovascular . [7] [8]
Investigación en salud [ editar ]
Relación con la dieta [ editar ]
Aunque se requieren ciertos niveles de vitaminas antioxidantes en la dieta para una buena salud, todavía existe un debate considerable sobre si los alimentos o suplementos ricos en antioxidantes tienen actividad contra las enfermedades. Además, si son realmente beneficiosos, se desconoce qué antioxidantes promueven la salud en la dieta y en qué cantidades más allá de la ingesta dietética típica. [9] [10] [11] Algunos autores cuestionan la hipótesis de que las vitaminas antioxidantes podrían prevenir enfermedades crónicas, [9] [12] y algunos declaran que la hipótesis no está probada y está equivocada. [13] Los polifenoles , que tienen propiedades antioxidantes in vitro , tienen una actividad antioxidante desconocida in vivo.debido al extenso metabolismo después de la digestión y poca evidencia clínica de eficacia. [14]
Interacciones [ editar ]
Los productos farmacéuticos (y suplementos) comunes con propiedades antioxidantes pueden interferir con la eficacia de ciertos medicamentos contra el cáncer y la radioterapia . [15]
Efectos adversos [ editar ]
Los ácidos reductores relativamente fuertes pueden tener efectos antinutrientes al unirse a los minerales de la dieta como el hierro y el zinc en el tracto gastrointestinal y evitar que sean absorbidos. [16] Algunos ejemplos son el ácido oxálico , los taninos y el ácido fítico , que son altos en las dietas a base de plantas. [17] Las deficiencias de calcio y hierro no son infrecuentes en las dietas de los países en desarrollo donde se come menos carne y hay un alto consumo de ácido fítico de los frijoles y cereales integrales sin levadura.un pan. Sin embargo, la germinación, el remojo o la fermentación microbiana son estrategias domésticas que reducen el contenido de fitatos y polifenoles de los cereales sin refinar. Se han informado aumentos en la absorción de Fe, Zn y Ca en adultos alimentados con cereales desfitinizados en comparación con cereales que contienen su fitato nativo. [18]
| Alimentos | Reducir la presencia de ácido |
|---|---|
| Cacao en grano y chocolate, espinacas , nabos y ruibarbo [19] | Ácido oxálico |
| Granos integrales , maíz, legumbres [20] | Ácido fítico |
| Té, frijoles , col [19] [21] | Taninos |
Las dosis altas de algunos antioxidantes pueden tener efectos dañinos a largo plazo. El estudio de prueba de eficacia de betacaroteno y retinol (CARET) de pacientes con cáncer de pulmón encontró que los fumadores que recibieron suplementos que contenían betacaroteno y vitamina A tenían mayores tasas de cáncer de pulmón. [22] Estudios posteriores confirmaron estos efectos adversos. [23] Estos efectos nocivos también se pueden observar en los no fumadores, ya que un metanálisis que incluyó datos de aproximadamente 230.000 pacientes mostró que la suplementación con β-caroteno, vitamina A o vitamina E se asocia con un aumento de la mortalidad, pero no se observó ningún efecto significativo de vitamina C. [24]No se observó ningún riesgo para la salud cuando todos los estudios controlados aleatorios se examinaron juntos, pero se detectó un aumento en la mortalidad cuando solo se examinaron por separado los ensayos de alta calidad y de bajo riesgo de sesgo. [25] Como la mayoría de estos ensayos de bajo sesgo se ocuparon de personas de edad avanzada o con enfermedades, es posible que estos resultados no se apliquen a la población general. [26] Este metanálisis fue posteriormente repetido y ampliado por los mismos autores, confirmando los resultados anteriores. [25] Estas dos publicaciones son consistentes con algunos metanálisis previos que también sugirieron que la suplementación con vitamina E aumentaba la mortalidad, [27] y que los suplementos antioxidantes aumentaban el riesgo de cáncer de colon.. [28] El betacaroteno también puede aumentar el cáncer de pulmón . [28] [29] En general, la gran cantidad de ensayos clínicos llevados a cabo sobre suplementos antioxidantes sugiere que estos productos no tienen ningún efecto sobre la salud o que causan un pequeño aumento en la mortalidad en poblaciones ancianas o vulnerables. [9] [10] [24]
Desafío oxidativo en biología [ editar ]
Una paradoja en el metabolismo es que, mientras que la gran mayoría de la vida compleja en la Tierra requiere oxígeno para su existencia, el oxígeno es un elemento altamente reactivo que daña a los organismos vivos al producir especies reactivas de oxígeno . [30] En consecuencia, los organismos contienen una red compleja de enzimas y metabolitos antioxidantes que trabajan juntos para prevenir el daño oxidativo a los componentes celulares como el ADN , las proteínas y los lípidos . [31] [32]En general, los sistemas antioxidantes evitan que se formen estas especies reactivas o las eliminan antes de que puedan dañar componentes vitales de la célula. [30] [31] Sin embargo, las especies reactivas de oxígeno también tienen funciones celulares útiles, como la señalización redox . Por lo tanto, la función de los sistemas antioxidantes no es eliminar los oxidantes por completo, sino mantenerlos en un nivel óptimo. [33]
Las especies reactivas de oxígeno producidas en las células incluyen peróxido de hidrógeno (H 2 O 2 ), ácido hipocloroso (HClO) y radicales libres como el radical hidroxilo (· OH) y el anión superóxido (O 2 - ). [34] El radical hidroxilo es particularmente inestable y reaccionará rápida y no específicamente con la mayoría de las moléculas biológicas. Esta especie se produce a partir del peróxido de hidrógeno en reacciones redox catalizadas por metales como la reacción de Fenton . [35] Estos oxidantes pueden dañar las células al iniciar reacciones químicas en cadena comoperoxidación lipídica , o oxidando ADN o proteínas. [31] El daño al ADN puede causar mutaciones y posiblemente cáncer, si no se revierte mediante mecanismos de reparación del ADN , [36] [37] mientras que el daño a las proteínas causa inhibición enzimática, desnaturalización y degradación de proteínas . [38]
El uso de oxígeno como parte del proceso de generación de energía metabólica produce especies reactivas de oxígeno. [39] En este proceso, el anión superóxido se produce como un subproducto de varios pasos en la cadena de transporte de electrones . [40] Es particularmente importante la reducción de la coenzima Q en el complejo III , ya que se forma un radical libre altamente reactivo como intermedio (Q · - ). Este intermedio inestable puede provocar una "fuga" de electrones, cuando los electrones saltan directamente al oxígeno y forman el anión superóxido, en lugar de moverse a través de la serie normal de reacciones bien controladas de la cadena de transporte de electrones. [41]Peróxido también se produce a partir de la oxidación de la reducción de flavoproteínas , tales como el complejo I . [42] Sin embargo, aunque estas enzimas pueden producir oxidantes, no está clara la importancia relativa de la cadena de transferencia de electrones para otros procesos que generan peróxido. [43] [44] En plantas, algas y cianobacterias , también se producen especies reactivas de oxígeno durante la fotosíntesis , [45] particularmente en condiciones de alta intensidad de luz . [46] Este efecto se compensa en parte por la participación de los carotenoides en la fotoinhibición.y en algas y cianobacterias, por una gran cantidad de yoduro y selenio , [47] lo que implica que estos antioxidantes reaccionan con formas sobrereducidas de los centros de reacción fotosintética para prevenir la producción de especies reactivas de oxígeno. [48] [49]
Ejemplos de compuestos antioxidantes bioactivos [ editar ]
Los antioxidantes se clasifican en dos grandes divisiones, dependiendo de si son solubles en agua ( hidrófilos ) o en lípidos ( lipófilos ). En general, los antioxidantes solubles en agua reaccionan con oxidantes en el citosol celular y el plasma sanguíneo , mientras que los antioxidantes solubles en lípidos protegen las membranas celulares de la peroxidación de lípidos . [31] Estos compuestos pueden sintetizarse en el cuerpo u obtenerse de la dieta. [32] Los diferentes antioxidantes están presentes en una amplia gama de concentraciones en los fluidos y tejidos corporales , con algunos como el glutatión o la ubiquinona.principalmente presente dentro de las células, mientras que otros, como el ácido úrico, se distribuyen de manera más uniforme (ver tabla a continuación). Algunos antioxidantes solo se encuentran en unos pocos organismos y estos compuestos pueden ser importantes en patógenos y pueden ser factores de virulencia . [50]
La importancia relativa y las interacciones entre estos diferentes antioxidantes es una cuestión muy compleja, y los diversos compuestos antioxidantes y sistemas de enzimas antioxidantes tienen efectos sinérgicos e interdependientes entre sí. [51] [52] Por lo tanto, la acción de un antioxidante puede depender de la función adecuada de otros miembros del sistema antioxidante. [32] La cantidad de protección proporcionada por cualquier antioxidante dependerá también de su concentración, su reactividad hacia la especie de oxígeno reactivo particular que se esté considerando y el estado de los antioxidantes con los que interactúa. [32]
Algunos compuestos contribuyen a la defensa antioxidante al quelar los metales de transición y evitar que catalicen la producción de radicales libres en la célula. De particular importancia es la capacidad de secuestrar hierro, que es la función de las proteínas de unión al hierro como la transferrina y la ferritina . [44] El selenio y el zinc se conocen comúnmente como minerales antioxidantes , pero estos elementos químicos no tienen acción antioxidante por sí mismos y, en cambio, son necesarios para la actividad de las enzimas antioxidantes.
| Antioxidante | Solubilidad | Concentración en suero humano ( μM ) | Concentración en tejido hepático ( μmol / kg ) |
|---|---|---|---|
| Ácido ascórbico ( vitamina C ) | Agua | 50–60 [53] | 260 (humano) [54] |
| Glutatión | Agua | 4 [55] | 6.400 (humanos) [54] |
| Ácido lipoico | Agua | 0,1-0,7 [56] | 4-5 (rata) [57] |
| Ácido úrico | Agua | 200–400 [58] | 1.600 (humanos) [54] |
| Carotenos | Lípido | β-caroteno : 0,5-1 [59] retinol (vitamina A): 1-3 [60] | 5 (humanos, carotenoides totales) [61] |
| α-tocoferol (vitamina E) | Lípido | 10–40 [60] | 50 (humano) [54] |
| Ubiquinol (coenzima Q) | Lípido | 5 [62] | 200 (humano) [63] |
Ácido úrico [ editar ]
El ácido úrico es, con mucho, el antioxidante de mayor concentración en la sangre humana. El ácido úrico (UA) es una oxipurina antioxidante producida a partir de la xantina por la enzima xantina oxidasa y es un producto intermedio del metabolismo de las purinas . [64] En casi todos los animales terrestres, la urato oxidasa cataliza aún más la oxidación del ácido úrico a alantoína , [65] pero en los seres humanos y la mayoría de los primates superiores, el gen de la urato oxidasa no es funcional, por lo que la AU no se degrada más. [65] [66] Las razones evolutivas de esta pérdida de conversión de urato en alantoína siguen siendo el tema de la especulación activa. [67] [68]Los efectos antioxidantes del ácido úrico han llevado a los investigadores a sugerir que esta mutación fue beneficiosa para los primeros primates y humanos. [68] [69] Los estudios de aclimatación a gran altitud apoyan la hipótesis de que el urato actúa como un antioxidante al mitigar el estrés oxidativo causado por la hipoxia a gran altitud. [70]
El ácido úrico tiene la concentración más alta de cualquier antioxidante en sangre [58] y proporciona más de la mitad de la capacidad antioxidante total del suero humano. [71] Las actividades antioxidantes del ácido úrico también son complejas, dado que no reacciona con algunos oxidantes, como el superóxido , pero actúa contra peroxinitrito , [72] peróxidos y ácido hipocloroso . [64] Las preocupaciones sobre la contribución elevada de la AU a la gota deben considerarse como uno de los muchos factores de riesgo. [73] Por sí mismo, el riesgo de gota relacionado con la AU en niveles altos (415 a 530 μmol / L) es solo del 0,5% por año con un aumento del 4,5% por año en la AUniveles de sobresaturación (535+ μmol / L). [74] Muchos de estos estudios antes mencionados determinaron las acciones antioxidantes de la AU dentro de los niveles fisiológicos normales, [70] [72] y algunos encontraron actividad antioxidante en niveles tan altos como 285 μmol / L. [75]
Vitamina C [ editar ]
El ácido ascórbico o vitamina C es un catalizador de oxidación-reducción ( redox ) de monosacárido que se encuentra tanto en animales como en plantas. [76] Como una de las enzimas necesarias para producir ácido ascórbico se ha perdido por mutación durante la evolución de los primates , los humanos deben obtenerla de su dieta; por tanto, es una vitamina dietética. [76] [77] La mayoría de los otros animales pueden producir este compuesto en sus cuerpos y no lo requieren en sus dietas. [78] Se requiere ácido ascórbico para la conversión del procolágeno en colágeno por oxidación residuos de prolina a hidroxiprolina . [76] En otras células, se mantiene en su forma reducida por reacción con glutatión, que puede ser catalizado por la proteína disulfuro isomerasa y glutaredoxinas . [79] [80] El ácido ascórbico es un catalizador redox que puede reducir, y por lo tanto neutralizar, especies reactivas de oxígeno como el peróxido de hidrógeno. [76] [81] Además de sus efectos antioxidantes directos, el ácido ascórbico también es un sustrato para la enzima redox ascorbato peroxidasa , una función que se utiliza en la resistencia al estrés en las plantas. [82]El ácido ascórbico está presente en niveles elevados en todas las partes de las plantas y puede alcanzar concentraciones de 20 milimolar en los cloroplastos . [83]
Glutatión [ editar ]
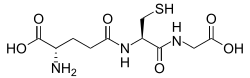
El glutatión es un péptido que contiene cisteína y se encuentra en la mayoría de las formas de vida aeróbica. [84] No se requiere en la dieta y, en cambio, se sintetiza en las células a partir de sus aminoácidos constituyentes . [85] El glutatión tiene propiedades antioxidantes ya que el grupo tiol en su resto cisteína es un agente reductor y puede oxidarse y reducirse de manera reversible. En las células, el glutatión se mantiene en forma reducida por la enzima glutatión reductasa y, a su vez, reduce otros metabolitos y sistemas enzimáticos, como el ascorbato en el ciclo glutatión-ascorbato , glutatión peroxidasas. y glutaredoxinas , además de reaccionar directamente con oxidantes. [79] Debido a su alta concentración y su papel central en el mantenimiento del estado redox de la célula, el glutatión es uno de los antioxidantes celulares más importantes. [84] En algunos organismos, el glutatión es reemplazado por otros tioles, como por el micotiol en los actinomicetos , el bacilitiol en algunas bacterias grampositivas , [86] [87] o por el tripanotiona en los cinetoplástidos . [88] [89]
Vitamina E [ editar ]
La vitamina E es el nombre colectivo de un conjunto de ocho tocoferoles y tocotrienoles relacionados , que son vitaminas liposolubles con propiedades antioxidantes. [90] [91] De estos, el α-tocoferol ha sido el más estudiado ya que tiene la mayor biodisponibilidad , y el cuerpo absorbe y metaboliza preferentemente esta forma. [92]
Se ha afirmado que la forma de α-tocoferol es el antioxidante liposoluble más importante y que protege las membranas de la oxidación al reaccionar con los radicales lipídicos producidos en la reacción en cadena de peroxidación lipídica. [90] [93] Esto elimina los radicales libres intermedios y evita que continúe la reacción de propagación. Esta reacción produce radicales α-tocoferoxilo oxidados que pueden reciclarse de nuevo a la forma activa reducida mediante la reducción por otros antioxidantes, como ascorbato, retinol o ubiquinol. [94] Esto concuerda con los hallazgos que muestran que el α-tocoferol, pero no los antioxidantes solubles en agua, protege de manera eficiente a las células deficientes en glutatión peroxidasa 4 ( GPX4 ) de la muerte celular. [95] GPx4 es la única enzima conocida que reduce eficazmente los hidroperóxidos de lípidos dentro de las membranas biológicas.
Sin embargo, las funciones y la importancia de las diversas formas de vitamina E no están claras en la actualidad, [96] [97] e incluso se ha sugerido que la función más importante del α-tocoferol es como molécula de señalización , y esta molécula no tiene importancia papel en el metabolismo antioxidante. [98] [99] Las funciones de las otras formas de vitamina E son aún menos conocidas, aunque el γ-tocoferol es un nucleófilo que puede reaccionar con mutágenos electrofílicos , [92] y los tocotrienoles pueden ser importantes para proteger las neuronas del daño. [100]
Actividades prooxidantes [ editar ]
Los antioxidantes que son agentes reductores también pueden actuar como prooxidantes. Por ejemplo, la vitamina C tiene actividad antioxidante cuando reduce sustancias oxidantes como el peróxido de hidrógeno; [101] sin embargo, también reducirá los iones metálicos que generan radicales libres a través de la reacción de Fenton . [35] [102]
- 2 Fe 3+ + Ascorbato → 2 Fe 2+ + Dehidroascorbato
- 2 Fe 2+ + 2 H 2 O 2 → 2 Fe 3+ + 2 OH · + 2 OH -
La importancia relativa de las actividades antioxidantes y prooxidantes de los antioxidantes es un área de investigación actual, pero la vitamina C, que ejerce sus efectos como vitamina oxidando polipéptidos, parece tener una acción principalmente antioxidante en el cuerpo humano. [102] Sin embargo, hay menos datos disponibles para otros antioxidantes dietéticos, como la vitamina E, [103] o los polifenoles . [104] [105] Asimismo, la patogenia de las enfermedades que involucran hiperuricemia probablemente involucre las propiedades prooxidantes directas e indirectas del ácido úrico. [ cita requerida ]
Es decir, paradójicamente, los agentes que normalmente se consideran antioxidantes pueden actuar como prooxidantes condicionales y, de hecho, aumentar el estrés oxidativo. Además del ascorbato, los prooxidantes condicionales de importancia médica incluyen el ácido úrico y los aminoácidos sulfhidrilo como la homocisteína . Normalmente, esto implica algún metal de la serie de transición, como el cobre o el hierro, como catalizador. El papel potencial del papel pro-oxidante del ácido úrico en (p. Ej.) La aterosclerosis y el accidente cerebrovascular isquémico se considera anteriormente. Otro ejemplo es el papel postulado de la homocisteína en la aterosclerosis. [ cita requerida ]
Sistemas enzimáticos [ editar ]
Al igual que con los antioxidantes químicos, las células están protegidas contra el estrés oxidativo por una red interactiva de enzimas antioxidantes. [30] [31] Aquí, el superóxido liberado por procesos como la fosforilación oxidativa se convierte primero en peróxido de hidrógeno y luego se reduce aún más para dar agua. Esta vía de desintoxicación es el resultado de múltiples enzimas, con superóxido dismutasas catalizando el primer paso y luego catalasas y varias peroxidasas que eliminan el peróxido de hidrógeno. Al igual que con los metabolitos antioxidantes, las contribuciones de estas enzimas a las defensas antioxidantes pueden ser difíciles de separar unas de otras, pero la generación de ratones transgénicos que carecen de una sola enzima antioxidante puede ser informativa. [106]
Superóxido dismutasa, catalasa y peroxiredoxinas [ editar ]
Las superóxido dismutasas (SOD) son una clase de enzimas estrechamente relacionadas que catalizan la descomposición del anión superóxido en oxígeno y peróxido de hidrógeno. [107] [108] Las enzimas SOD están presentes en casi todas las células aeróbicas y en los líquidos extracelulares. [109] Las enzimas superóxido dismutasa contienen cofactores de iones metálicos que, dependiendo de la isoenzima, pueden ser cobre, zinc, manganeso o hierro. En los seres humanos, la SOD de cobre / zinc está presente en el citosol , mientras que la SOD de manganeso está presente en la mitocondria . [108] También existe una tercera forma de SOD en los fluidos extracelulares , que contiene cobre y zinc en sus sitios activos. [110]La isoenzima mitocondrial parece ser la más importante biológicamente de estas tres, ya que los ratones que carecen de esta enzima mueren poco después del nacimiento. [111] En contraste, los ratones que carecen de SOD de cobre / zinc (Sod1) son viables pero tienen numerosas patologías y una vida útil reducida (ver artículo sobre superóxido ), mientras que los ratones sin SOD extracelular tienen defectos mínimos (sensibles a la hiperoxia ). [106] [112] En las plantas, las isoenzimas SOD están presentes en el citosol y las mitocondrias, con una SOD de hierro que se encuentra en los cloroplastos que está ausente en los vertebrados y las levaduras . [113]
Las catalasas son enzimas que catalizan la conversión de peróxido de hidrógeno en agua y oxígeno, utilizando un cofactor de hierro o manganeso. [114] [115] Esta proteína se localiza en los peroxisomas en la mayoría de las células eucariotas . [116] La catalasa es una enzima inusual ya que, aunque el peróxido de hidrógeno es su único sustrato, sigue un mecanismo de ping-pong . Aquí, su cofactor se oxida por una molécula de peróxido de hidrógeno y luego se regenera transfiriendo el oxígeno unido a una segunda molécula de sustrato. [117] A pesar de su aparente importancia en la eliminación del peróxido de hidrógeno, los seres humanos con deficiencia genética de catalasa (" acatalasemia ") o ratonesmodificados genéticamente para carecer completamente de catalasa, sufren pocos efectos nocivos. [118] [119]
Las peroxiredoxinas son peroxidasas que catalizan la reducción de peróxido de hidrógeno, hidroperóxidos orgánicos y peroxinitrito . [121] Se dividen en tres clases: peroxiredoxinas de 2-cisteína típicas; peroxiredoxinas de 2-cisteína atípicas; y peroxiredoxinas de 1-cisteína. [122] Estas enzimas comparten el mismo mecanismo catalítico básico, en el que una cisteína con actividad redox (la cisteína peroxidatica) en el sitio activo se oxida a un ácido sulfénico por el sustrato de peróxido. [123] La sobreoxidación de este residuo de cisteína en las peroxiredoxinas inactiva estas enzimas, pero esto puede revertirse mediante la acción de la sulfiredoxina .[124] Las peroxiredoxinas parecen ser importantes en el metabolismo antioxidante, ya que los ratones que carecen de peroxiredoxina 1 o 2 tienen una vida útil más corta y sufren de anemia hemolítica , mientras que las plantas usan peroxiredoxinas para eliminar el peróxido de hidrógeno generado en los cloroplastos. [125] [126] [127]
Sistemas de tiorredoxina y glutatión [ editar ]
El sistema de tiorredoxina contiene la proteína tiorredoxina de 12 k Da y su compañera tiorredoxina reductasa . [128] Las proteínas relacionadas con la tiorredoxina están presentes en todos los organismos secuenciados. Las plantas, como Arabidopsis thaliana , tienen una diversidad de isoformas particularmente grande. [129] El sitio activo de la tiorredoxina consta de dos cisteínas vecinas , como parte de un motivo CXXC altamente conservado , que pueden alternar entre una forma de ditiol activo (reducido) y un disulfuro oxidado.formulario. En su estado activo, la tiorredoxina actúa como un agente reductor eficaz, eliminando especies reactivas de oxígeno y manteniendo otras proteínas en su estado reducido. [130] Después de oxidarse, la tiorredoxina activa se regenera por la acción de la tiorredoxina reductasa, utilizando NADPH como donante de electrones . [131]
El sistema del glutatión incluye glutatión, glutatión reductasa , glutatión peroxidasas y glutatión S- transferasas . [84] Este sistema se encuentra en animales, plantas y microorganismos. [84] [132] El glutatión peroxidasa es una enzima que contiene cuatro selenio - cofactores que cataliza la descomposición de peróxido de hidrógeno e hidroperóxidos orgánicos. Hay al menos cuatro isoenzimas diferentes de glutatión peroxidasa en animales. [133]La glutatión peroxidasa 1 es la más abundante y es un eliminador muy eficaz de peróxido de hidrógeno, mientras que la glutatión peroxidasa 4 es más activa con los hidroperóxidos lipídicos. Sorprendentemente, la glutatión peroxidasa 1 es prescindible, ya que los ratones que carecen de esta enzima tienen una esperanza de vida normal [134], pero son hipersensibles al estrés oxidativo inducido. [135] Además, las glutatión S- transferasas muestran una alta actividad con los peróxidos de lípidos. [136] Estas enzimas se encuentran en niveles particularmente altos en el hígado y también sirven en el metabolismo de desintoxicación . [137]
Usos en tecnología [ editar ]
Conservantes de alimentos [ editar ]
Los antioxidantes se utilizan como aditivos alimentarios para ayudar a proteger contra el deterioro de los alimentos . La exposición al oxígeno y la luz solar son los dos factores principales en la oxidación de los alimentos, por lo que los alimentos se conservan manteniéndolos en la oscuridad y sellándolos en recipientes o incluso recubriéndolos con cera, como ocurre con los pepinos. Sin embargo, como el oxígeno también es importante para la respiración de las plantas , el almacenamiento de materiales vegetales en condiciones anaeróbicas produce sabores y colores desagradables. [138] En consecuencia, el envasado de frutas y verduras frescas contiene una atmósfera de oxígeno de ~ 8%. Los antioxidantes son una clase de conservantes especialmente importante ya que, a diferencia de las bacterias o los hongosdeterioro, las reacciones de oxidación todavía ocurren con relativa rapidez en los alimentos congelados o refrigerados. [139] Estos conservantes incluyen antioxidantes naturales como el ácido ascórbico (AA, E300) y tocoferoles (E306), así como antioxidantes sintéticos como el galato de propilo (PG, E310), butilhidroquinona terciaria (TBHQ), hidroxianisol butilado (BHA, E320). ) e hidroxitolueno butilado (BHT, E321). [140] [141]
Las moléculas más comúnmente atacadas por oxidación son las grasas insaturadas; la oxidación hace que se vuelvan rancios . [142] Dado que los lípidos oxidados a menudo se decoloran y suelen tener sabores desagradables, como sabores metálicos o sulfurosos , es importante evitar la oxidación en los alimentos ricos en grasas. Por lo tanto, estos alimentos rara vez se conservan mediante secado; en cambio, se conservan ahumados , salando o fermentando . Incluso los alimentos menos grasos, como las frutas, se rocían con antioxidantes sulfurosos antes de secarlos al aire. La oxidación a menudo es catalizada por metales, por lo que las grasas como la mantequilla nunca deben envolverse en papel de aluminio.o guardado en recipientes metálicos. Algunos alimentos grasos como el aceite de oliva están parcialmente protegidos de la oxidación por su contenido natural de antioxidantes, pero siguen siendo sensibles a la fotooxidación. [143] También se añaden conservantes antioxidantes a los cosméticos a base de grasas, como el lápiz labial y los humectantes, para prevenir la rancidez. [ cita requerida ]
Usos industriales [ editar ]
Los antioxidantes se agregan con frecuencia a los productos industriales. Un uso común es como estabilizadores en combustibles y lubricantes para prevenir la oxidación, y en gasolinas para prevenir la polimerización que conduce a la formación de residuos que ensucian el motor. [144] En 2014, el mercado mundial de antioxidantes naturales y sintéticos era de 2.250 millones de dólares EE.UU. con una previsión de crecimiento a 3.250 millones de dólares para 2020. [145]
Los estabilizadores de polímeros antioxidantes se utilizan ampliamente para prevenir la degradación de polímeros como cauchos, plásticos y adhesivos que provoca una pérdida de resistencia y flexibilidad en estos materiales. [146] Los polímeros que contienen dobles enlaces en sus cadenas principales, como el caucho natural y el polibutadieno , son especialmente susceptibles a la oxidación y la ozonólisis . Pueden protegerse con antiozonantes . Los productos de polímero sólido comienzan a agrietarse en las superficies expuestas a medida que el material se degrada y las cadenas se rompen. El modo de craqueo varía entre el oxígeno y el ozono.el ataque, el primero que produce un efecto de "pavimento loco", mientras que el ataque de ozono produce grietas más profundas alineadas en ángulo recto con la tensión de tracción en el producto. La oxidación y la degradación UV también están frecuentemente relacionadas, principalmente porque la radiación UV crea radicales libres por rotura de enlaces. Los radicales libres luego reaccionan con el oxígeno para producir radicales peroxi que causan aún más daño, a menudo en una reacción en cadena . Otros polímeros susceptibles a la oxidación incluyen polipropileno y polietileno . El primero es más sensible debido a la presencia de átomos de carbono secundarios.presente en cada unidad de repetición. El ataque ocurre en este punto porque el radical libre formado es más estable que el formado en un átomo de carbono primario . La oxidación del polietileno tiende a ocurrir en los eslabones débiles de la cadena, como los puntos de ramificación del polietileno de baja densidad . [ cita requerida ]
| Aditivo de combustible | Componentes [147] | Aplicaciones [147] |
|---|---|---|
| AO-22 | N, N'-di-2-butil-1,4-fenilendiamina | Aceites para turbinas, aceites para transformadores , fluidos hidráulicos , ceras y grasas |
| AO-24 | N, N'-di-2-butil-1,4-fenilendiamina | Aceites de baja temperatura |
| AO-29 | 2,6-di-terc-butil-4-metilfenol | Aceites para turbinas, aceites para transformadores, fluidos hidráulicos, ceras, grasas y gasolinas |
| AO-30 | 2,4-dimetil-6-terc-butilfenol | Combustibles de aviación y gasolinas, incluidas las gasolinas de aviación |
| AO-31 | 2,4-dimetil-6-terc-butilfenol | Combustibles de aviación y gasolinas, incluidas las gasolinas de aviación |
| AO-32 | 2,4-dimetil-6-terc-butilfenol y 2,6-di-terc-butil-4-metilfenol | Combustibles de aviación y gasolinas, incluidas las gasolinas de aviación |
| AO-37 | 2,6-di-terc-butilfenol | Combustibles y gasolinas para aviones , ampliamente aprobados para combustibles de aviación |
Niveles en la comida [ editar ]
Las vitaminas antioxidantes se encuentran en verduras, frutas, huevos, legumbres y frutos secos. Las vitaminas A, C y E pueden destruirse por almacenamiento prolongado o cocción prolongada. [148] Los efectos de la cocción y el procesamiento de alimentos son complejos, ya que estos procesos también pueden aumentar la biodisponibilidad de antioxidantes, como algunos carotenoides en las verduras. [149] Los alimentos procesados contienen menos vitaminas antioxidantes que los alimentos frescos y crudos, ya que la preparación los expone al calor y al oxígeno. [150]
| Vitaminas antioxidantes | Alimentos que contienen altos niveles de vitaminas antioxidantes [21] [151] [152] |
|---|---|
| Vitamina C (ácido ascórbico) | Frutas y verduras frescas o congeladas |
| Vitamina E (tocoferoles, tocotrienoles) | Aceites vegetales , nueces y semillas. |
| Carotenoides ( carotenos como provitamina A ) | Frutas, verduras y huevos |
Otros antioxidantes no se obtienen de la dieta, sino que se producen en el cuerpo. Por ejemplo, el ubiquinol (coenzima Q) se absorbe mal en el intestino y se produce a través de la vía del mevalonato . [63] Otro ejemplo es el glutatión , que está hecho de aminoácidos. Como cualquier glutatión en el intestino se descompone en cisteína libre, glicina y ácido glutámico antes de ser absorbido, incluso una gran ingesta oral tiene poco efecto sobre la concentración de glutatión en el cuerpo. [153] [154] Aunque grandes cantidades de aminoácidos que contienen azufre, como la acetilcisteína, pueden aumentar el glutatión, [155]no existe evidencia de que comer niveles altos de estos precursores de glutatión sea beneficioso para los adultos sanos. [156]
Medición e invalidación de ORAC [ editar ]
La medición del contenido de polifenoles y carotenoides en los alimentos no es un proceso sencillo, ya que los antioxidantes colectivamente son un grupo diverso de compuestos con diferentes reactividades a varias especies reactivas de oxígeno. En los análisis de ciencia alimentaria in vitro, la capacidad de absorbancia de radicales de oxígeno (ORAC) fue una vez un estándar de la industria para estimar la fuerza antioxidante de alimentos integrales, jugos y aditivos alimentarios, principalmente a partir de la presencia de polifenoles . [157] [158] En 2012 se retiraron las mediciones y calificaciones anteriores del Departamento de Agricultura de los Estados Unidos por considerarlas biológicamente irrelevantes para la salud humana, en referencia a la ausencia de pruebas fisiológicas de que los polifenoles tengan propiedades antioxidantes.in vivo . [159] En consecuencia, el método ORAC, derivado únicamente deexperimentos in vitro , ya no se considera pertinente para las dietas humanas o la biología , a partir de 2010. [159]
Las mediciones in vitro alternativas del contenido de antioxidantes en los alimentos, también basadas en la presencia de polifenoles, incluyen el reactivo de Folin-Ciocalteu y el ensayo de capacidad antioxidante equivalente Trolox . [160]
Historia [ editar ]
Como parte de su adaptación de la vida marina, las plantas terrestres comenzaron a producir antioxidantes no marinos como el ácido ascórbico ( vitamina C ), polifenoles y tocoferoles . La evolución de las plantas de angiospermas hace entre 50 y 200 millones de años resultó en el desarrollo de muchos pigmentos antioxidantes, particularmente durante el período Jurásico , como defensas químicas contra especies reactivas de oxígeno que son subproductos de la fotosíntesis . [161]Originalmente, el término antioxidante se refería específicamente a una sustancia química que impedía el consumo de oxígeno. A finales del siglo XIX y principios del XX, un extenso estudio se concentró en el uso de antioxidantes en importantes procesos industriales, como la prevención de la corrosión de metales , la vulcanización del caucho y la polimerización de combustibles en el ensuciamiento de motores de combustión interna . [162]
Las primeras investigaciones sobre el papel de los antioxidantes en biología se centraron en su uso para prevenir la oxidación de las grasas insaturadas , que es la causa de la rancidez . [163] La actividad antioxidante podría medirse simplemente colocando la grasa en un recipiente cerrado con oxígeno y midiendo la tasa de consumo de oxígeno. Sin embargo, fue la identificación de las vitaminas C y E como antioxidantes lo que revolucionó el campo y llevó a la comprensión de la importancia de los antioxidantes en la bioquímica de los organismos vivos . [164] [165] Los posibles mecanismos de acciónde los antioxidantes se exploraron por primera vez cuando se reconoció que es probable que una sustancia con actividad antioxidante sea una que se oxida fácilmente. [166] La investigación sobre cómo la vitamina E previene el proceso de peroxidación de lípidos llevó a la identificación de antioxidantes como agentes reductores que previenen reacciones oxidativas, a menudo eliminando especies reactivas de oxígeno antes de que puedan dañar las células. [167]
Referencias [ editar ]
- ^ Dabelstein W, Reglitzky A, Schütze A, Reders K (2007). "Combustibles de automoción". Enciclopedia de química industrial de Ullmann . doi : 10.1002 / 14356007.a16_719.pub2 . ISBN 978-3-527-30673-2.
- ^ "Antioxidantes: en profundidad" . NCCIH. Noviembre de 2013 . Consultado el 17 de abril de 2021 .
- ^ Bjelakovic G, Nikolova D, Gluud C (2013). "Análisis de metarregresión, metanálisis y análisis secuenciales de ensayos de los efectos de la suplementación con betacaroteno, vitamina A y vitamina E individualmente o en diferentes combinaciones sobre la mortalidad por todas las causas: ¿tenemos pruebas de la ausencia de daño? " . PLOS ONE . 8 (9): e74558. Código Bibliográfico : 2013PLoSO ... 874558B . doi : 10.1371 / journal.pone.0074558 . PMC 3765487 . PMID 24040282 .
- ^ Abner EL, Schmitt FA, Mendiondo MS, Marcum JL, Kryscio RJ (julio de 2011). "Vitamina E y mortalidad por todas las causas: un metanálisis" . Ciencia actual del envejecimiento . 4 (2): 158–70. doi : 10.2174 / 1874609811104020158 . PMC 4030744 . PMID 21235492 .
- ^ Cortés-Jofré M, Rueda JR, Corsini-Muñoz G, Fonseca-Cortés C, Caraballoso M, Bonfill Cosp X (2012). "Medicamentos para prevenir el cáncer de pulmón en personas sanas". La base de datos Cochrane de revisiones sistemáticas . 10 : CD002141. doi : 10.1002 / 14651858.CD002141.pub2 . PMID 23076895 .
- ^ Jiang L, Yang KH, Tian JH, Guan QL, Yao N, Cao N, Mi DH, Wu J, Ma B, Yang SH (2010). "Eficacia de las vitaminas antioxidantes y el suplemento de selenio en la prevención del cáncer de próstata: un metanálisis de ensayos controlados aleatorios". Nutrición y cáncer . 62 (6): 719–27. doi : 10.1080 / 01635581.2010.494335 . PMID 20661819 . S2CID 13611123 .
- ^ Rees K, Hartley L, Día C, Flores N, Clarke A, Stranges S (2013). "Suplementación de selenio para la prevención primaria de enfermedades cardiovasculares" (PDF) . La base de datos Cochrane de revisiones sistemáticas . 1 (1): CD009671. doi : 10.1002 / 14651858.CD009671.pub2 . PMC 7433291 . PMID 23440843 . Archivado desde el original (PDF) el 12 de agosto de 2017 . Consultado el 23 de julio de 2018 .
- ^ Shekelle PG, Morton SC, Jungvig LK, Udani J, Spar M, Tu W, J Suttorp M, Coulter I, Newberry SJ, Hardy M (abril de 2004). "Efecto de la vitamina E suplementaria para la prevención y el tratamiento de enfermedades cardiovasculares" . Revista de Medicina Interna General . 19 (4): 380–9. doi : 10.1111 / j.1525-1497.2004.30090.x . PMC 1492195 . PMID 15061748 .
- ^ a b c Stanner SA, Hughes J, Kelly CN, Buttriss J (mayo de 2004). "Una revisión de la evidencia epidemiológica de la 'hipótesis antioxidante ' " . Nutrición en Salud Pública . 7 (3): 407–22. doi : 10.1079 / PHN2003543 . PMID 15153272 .
- ↑ a b Shenkin A (febrero de 2006). "El papel clave de los micronutrientes". Nutrición clínica . 25 (1): 1–13. doi : 10.1016 / j.clnu.2005.11.006 . PMID 16376462 .
- ^ Woodside JV, McCall D, McGartland C, Young IS (noviembre de 2005). "Micronutrientes: ingesta dietética v. Uso de suplementos" . Las actas de la Sociedad de Nutrición . 64 (4): 543–53. doi : 10.1079 / PNS2005464 . PMID 16313697 .
- ^ Alimentación, nutrición, actividad física y prevención del cáncer: una perspectiva global . Fondo Mundial para la Investigación del Cáncer (2007). ISBN 978-0-9722522-2-5 .
- ^ Granizo N, Cortes M, Drake EN, Spallholz JE (julio de 2008). "Quimioprevención del cáncer: una perspectiva radical". Biología y Medicina de Radicales Libres . 45 (2): 97-110. doi : 10.1016 / j.freeradbiomed.2008.04.004 . PMID 18454943 .
- ^ "Flavonoides" . Instituto Linus Pauling, Universidad Estatal de Oregon, Corvallis. 2016 . Consultado el 24 de julio de 2016 .
- ^ Lemmo W (septiembre de 2014). "Interacciones potenciales de medicamentos recetados y de venta libre que tienen capacidades antioxidantes con radiación y quimioterapia" . Revista Internacional de Cáncer . 137 (11): 2525–33. doi : 10.1002 / ijc.29208 . PMID 25220632 . S2CID 205951215 .
- ^ Hurrell RF (septiembre de 2003). "Influencia de las fuentes de proteínas vegetales en la biodisponibilidad de oligoelementos y minerales" . La Revista de Nutrición . 133 (9): 2973S – 7S. doi : 10.1093 / jn / 133.9.2973S . PMID 12949395 .
- ^ Hunt JR (septiembre de 2003). "Biodisponibilidad de hierro, zinc y otros oligoelementos de dietas vegetarianas" . La Revista Estadounidense de Nutrición Clínica . 78 (3 supl.): 633S – 639S. doi : 10.1093 / ajcn / 78.3.633S . PMID 12936958 .
- ^ Gibson RS, Perlas L, Hotz C (mayo de 2006). "Mejora de la biodisponibilidad de nutrientes en alimentos vegetales a nivel doméstico" . Las actas de la Sociedad de Nutrición . 65 (2): 160–8. doi : 10.1079 / PNS2006489 . PMID 16672077 .
- ^ a b Mosha TC, Gaga HE, Pace RD, Laswai HS, Mtebe K (junio de 1995). "Efecto del escaldado sobre el contenido de factores antinutricionales en vegetales seleccionados". Alimentos vegetales para la nutrición humana . 47 (4): 361–7. doi : 10.1007 / BF01088275 . PMID 8577655 . S2CID 1118651 .
- ^ Sandberg AS (diciembre de 2002). "Biodisponibilidad de minerales en legumbres" . La Revista Británica de Nutrición . 88 Suppl 3 (Suppl 3): S281–5. doi : 10.1079 / BJN / 2002718 . PMID 12498628 .
- ^ a b Beecher GR (octubre de 2003). "Resumen de los flavonoides dietéticos: nomenclatura, ocurrencia e ingesta" . La Revista de Nutrición . 133 (10): 3248S – 3254S. doi : 10.1093 / jn / 133.10.3248S . PMID 14519822 .
- ^ Omenn GS, Goodman GE, Thornquist MD, Balmes J, Cullen MR, Glass A, Keogh JP, Meyskens FL, Valanis B, Williams JH, Barnhart S, Cherniack MG, Brodkin CA, Hammar S (noviembre de 1996). "Factores de riesgo para el cáncer de pulmón y efectos de la intervención en CARET, el ensayo de eficacia del betacaroteno y el retinol" (PDF) . Revista del Instituto Nacional del Cáncer . 88 (21): 1550–9. doi : 10.1093 / jnci / 88.21.1550 . PMID 8901853 .
- ^ Albanes D (junio de 1999). "Betacaroteno y cáncer de pulmón: un estudio de caso" . La Revista Estadounidense de Nutrición Clínica . 69 (6): 1345S – 50S. doi : 10.1093 / ajcn / 69.6.1345S . PMID 10359235 .
- ↑ a b Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C (febrero de 2007). "Mortalidad en ensayos aleatorizados de suplementos antioxidantes para prevención primaria y secundaria: revisión sistemática y metaanálisis". JAMA . 297 (8): 842–57. doi : 10.1001 / jama.297.8.842 . PMID 17327526 .
- ↑ a b Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C (14 de marzo de 2012). "Suplementos antioxidantes para la prevención de la mortalidad en participantes sanos y pacientes con diversas enfermedades". La base de datos Cochrane de revisiones sistemáticas . 3 (3): CD007176. doi : 10.1002 / 14651858.CD007176.pub2 . hdl : 10138/136201 . PMID 22419320 .
- ^ Estudio que cita los riesgos de las vitaminas antioxidantes basado en una metodología defectuosa, los expertos argumentan el comunicado de prensa de la Universidad Estatal de Oregón publicado en ScienceDaily. Consultado el 19 de abril de 2007.
- ^ Miller ER, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E (enero de 2005). "Metanálisis: la suplementación con vitamina E en dosis altas puede aumentar la mortalidad por todas las causas" . Annals of Internal Medicine . 142 (1): 37–46. doi : 10.7326 / 0003-4819-142-1-200501040-00110 . PMID 15537682 .
- ↑ a b Bjelakovic G, Nagorni A, Nikolova D, Simonetti RG, Bjelakovic M, Gluud C (julio de 2006). "Metanálisis: suplementos antioxidantes para la prevención primaria y secundaria del adenoma colorrectal". Farmacología y terapéutica alimentaria . 24 (2): 281–91. doi : 10.1111 / j.1365-2036.2006.02970.x . PMID 16842454 . S2CID 20452618 .
- ^ Cortés-Jofré, Marcela; Rueda, José-Ramón; Asenjo-Lobos, Claudia; Madrid, Eva; Bonfill Cosp, Xavier (4 de marzo de 2020). "Medicamentos para prevenir el cáncer de pulmón en personas sanas" . La base de datos Cochrane de revisiones sistemáticas . 3 : CD002141. doi : 10.1002 / 14651858.CD002141.pub3 . ISSN 1469-493X . PMC 7059884 . PMID 32130738 .
- ↑ a b c Davies KJ (1995). "Estrés oxidativo: la paradoja de la vida aeróbica". Simposio de la Sociedad de Bioquímica . 61 : 1–31. doi : 10.1042 / bss0610001 . PMID 8660387 .
- ↑ a b c d e Sies H (marzo de 1997). "Estrés oxidativo: oxidantes y antioxidantes" . Fisiología experimental . 82 (2): 291–5. doi : 10.1113 / expphysiol.1997.sp004024 . PMID 9129943 . S2CID 20240552 .
- ↑ a b c d Vertuani S, Angusti A, Manfredini S (2004). "La red de antioxidantes y pro-antioxidantes: una visión general". Diseño Farmacéutico Actual . 10 (14): 1677–94. doi : 10.2174 / 1381612043384655 . PMID 15134565 .
- ^ Rhee SG (junio de 2006). "Señalización celular. H2O2, un mal necesario para la señalización celular". Ciencia . 312 (5782): 1882–3. doi : 10.1126 / science.1130481 . PMID 16809515 . S2CID 83598498 .
- ^ Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J (2007). "Radicales libres y antioxidantes en funciones fisiológicas normales y enfermedades humanas". La Revista Internacional de Bioquímica y Biología Celular . 39 (1): 44–84. doi : 10.1016 / j.biocel.2006.07.001 . PMID 16978905 .
- ↑ a b Stohs SJ, Bagchi D (febrero de 1995). "Mecanismos oxidativos en la toxicidad de los iones metálicos" (PDF) . Free Radical Biology & Medicine (manuscrito enviado). 18 (2): 321–36. CiteSeerX 10.1.1.461.6417 . doi : 10.1016 / 0891-5849 (94) 00159-H . PMID 7744317 .
- ^ Nakabeppu Y, Sakumi K, Sakamoto K, Tsuchimoto D, Tsuzuki T, Nakatsu Y (abril de 2006). "Mutagénesis y carcinogénesis por oxidación de ácidos nucleicos". Química biológica . 387 (4): 373–9. doi : 10.1515 / BC.2006.050 . PMID 16606334 . S2CID 20217256 .
- ^ Valko M, Izakovic M, Mazur M, Rhodes CJ, Telser J (noviembre de 2004). "Papel de los radicales de oxígeno en el daño del ADN y la incidencia de cáncer". Bioquímica molecular y celular . 266 (1–2): 37–56. doi : 10.1023 / B: MCBI.0000049134.69131.89 . PMID 15646026 . S2CID 207547763 .
- ^ Stadtman ER (agosto de 1992). "Oxidación y envejecimiento de proteínas" . Ciencia . 257 (5074): 1220–4. Código Bibliográfico : 1992Sci ... 257.1220S . doi : 10.1126 / science.1355616 . PMID 1355616 .
- ^ Raha S, Robinson BH (octubre de 2000). "Mitocondrias, radicales libres de oxígeno, enfermedad y envejecimiento". Tendencias en Ciencias Bioquímicas . 25 (10): 502–8. doi : 10.1016 / S0968-0004 (00) 01674-1 . PMID 11050436 .
- ^ Lenaz G (2001). "La producción mitocondrial de especies reactivas de oxígeno: mecanismos e implicaciones en patología humana" . IUBMB Life . 52 (3-5): 159-64. doi : 10.1080 / 15216540152845957 . PMID 11798028 . S2CID 45366190 .
- ^ Finkel T, Holbrook NJ (noviembre de 2000). "Oxidantes, el estrés oxidativo y la biología del envejecimiento". Naturaleza . 408 (6809): 239–47. Código bibliográfico : 2000Natur.408..239F . doi : 10.1038 / 35041687 . PMID 11089981 . S2CID 2502238 .
- ^ Hirst J, King MS, Pryde KR (octubre de 2008). "La producción de especies reactivas de oxígeno por el complejo I". Transacciones de la sociedad bioquímica . 36 (Pt 5): 976–80. doi : 10.1042 / BST0360976 . PMID 18793173 .
- ^ Seaver LC, Imlay JA (noviembre de 2004). "¿Son las enzimas respiratorias las principales fuentes de peróxido de hidrógeno intracelular?" . La Revista de Química Biológica . 279 (47): 48742–50. doi : 10.1074 / jbc.M408754200 . PMID 15361522 .
- ↑ a b Imlay JA (2003). "Vías de daño oxidativo". Revisión anual de microbiología . 57 : 395–418. doi : 10.1146 / annurev.micro.57.030502.090938 . PMID 14527285 .
- ^ Demmig-Adams B, Adams WW (diciembre de 2002). "Antioxidantes en la fotosíntesis y la nutrición humana". Ciencia . 298 (5601): 2149–53. Código Bibliográfico : 2002Sci ... 298.2149D . doi : 10.1126 / science.1078002 . PMID 12481128 . S2CID 27486669 .
- ^ Krieger-Liszkay A (enero de 2005). "Producción de oxígeno singlete en la fotosíntesis". Revista de botánica experimental . 56 (411): 337–46. CiteSeerX 10.1.1.327.9651 . doi : 10.1093 / jxb / erh237 . PMID 15310815 .
- ^ Kupper FC, Carpenter LJ, McFiggans GB, Palmer CJ, Waite TJ, Boneberg EM, Woitsch S, Weiller M, Abela R, Grolimund D, Potin P, Butler A, Luther GW, Kroneck PMH, Meyer-Klaucke W, Feiters MC (2008). "La acumulación de yoduro proporciona a las algas marinas un antioxidante inorgánico que afecta la química atmosférica" . Actas de la Academia Nacional de Ciencias . 105 (19): 6954–6958. Código Bibliográfico : 2008PNAS..105.6954K . doi : 10.1073 / pnas.0709959105 . ISSN 0027-8424 . PMC 2383960 . PMID 18458346 .
- ^ Szabó I, Bergantino E, Giacometti GM (julio de 2005). "Fotosíntesis de luz y oxígeno: disipación de energía como mecanismo de protección frente a la fotooxidación" . Informes EMBO . 6 (7): 629–34. doi : 10.1038 / sj.embor.7400460 . PMC 1369118 . PMID 15995679 .
- ^ Kerfeld CA (octubre de 2004). "Proteínas carotenoides solubles en agua de cianobacterias" (PDF) . Archivos de Bioquímica y Biofísica (manuscrito enviado). 430 (1): 2–9. doi : 10.1016 / j.abb.2004.03.018 . PMID 15325905 .
- ^ Miller RA, Britigan BE (enero de 1997). "Papel de los oxidantes en la fisiopatología microbiana" . Revisiones de microbiología clínica . 10 (1): 1–18. doi : 10.1128 / CMR.10.1.1 . PMC 172912 . PMID 8993856 .
- ^ Chaudière J, Ferrari-Iliou R (1999). "Antioxidantes intracelulares: de los mecanismos químicos a los bioquímicos". Toxicología alimentaria y química . 37 (9-10): 949-62. doi : 10.1016 / S0278-6915 (99) 00090-3 . PMID 10541450 .
- ^ Sies H (julio de 1993). "Estrategias de defensa antioxidante". Revista Europea de Bioquímica / FEBS . 215 (2): 213–9. doi : 10.1111 / j.1432-1033.1993.tb18025.x . PMID 7688300 .
- ^ Khaw KT, Woodhouse P (junio de 1995). "Interrelación de vitamina C, infección, factores hemostáticos y enfermedad cardiovascular" . BMJ . 310 (6994): 1559–63. doi : 10.1136 / bmj.310.6994.1559 . PMC 2549940 . PMID 7787643 .
- ↑ a b c d Evelson P, Travacio M, Repetto M, Escobar J, Llesuy S, Lissi EA (abril de 2001). "Evaluación del potencial antioxidante reactivo total (TRAP) de homogeneizados de tejidos y sus citosoles". Archivos de Bioquímica y Biofísica . 388 (2): 261–6. doi : 10.1006 / abbi.2001.2292 . PMID 11368163 .
- ^ Morrison JA, Jacobsen DW, Sprecher DL, Robinson K, Khoury P, Daniels SR (noviembre de 1999). "El glutatión sérico en varones adolescentes predice la enfermedad coronaria de los padres" . Circulación . 100 (22): 2244–7. doi : 10.1161 / 01.CIR.100.22.2244 . PMID 10577998 .
- ^ Teichert J, Preiss R (noviembre de 1992). "Métodos de HPLC para la determinación de ácido lipoico y su forma reducida en plasma humano". Revista Internacional de Farmacología Clínica, Terapia y Toxicología . 30 (11): 511–2. PMID 1490813 .
- ^ Akiba S, Matsugo S, Packer L, Konishi T (mayo de 1998). "Ensayo de ácido lipoico unido a proteínas en tejidos mediante un nuevo método enzimático". Bioquímica analítica . 258 (2): 299-304. doi : 10.1006 / abio.1998.2615 . PMID 9570844 .
- ↑ a b Glantzounis GK, Tsimoyiannis EC, Kappas AM, Galaris DA (2005). "Ácido úrico y estrés oxidativo". Diseño Farmacéutico Actual . 11 (32): 4145–51. doi : 10.2174 / 138161205774913255 . PMID 16375736 .
- ^ El-Sohemy A, Baylin A, Kabagambe E, Ascherio A, Spiegelman D, Campos H (julio de 2002). "Concentraciones de carotenoides individuales en tejido adiposo y plasma como biomarcadores de la ingesta dietética" . La Revista Estadounidense de Nutrición Clínica . 76 (1): 172–9. doi : 10.1093 / ajcn / 76.1.172 . PMID 12081831 .
- ↑ a b Sowell AL, Huff DL, Yeager PR, Caudill SP, Gunter EW (marzo de 1994). "Retinol, alfa-tocoferol, luteína / zeaxantina, beta-criptoxantina, licopeno, alfa-caroteno, trans-beta-caroteno y cuatro ésteres de retinilo en suero determinados simultáneamente por HPLC de fase inversa con detección de longitud de onda múltiple". Química clínica . 40 (3): 411–6. doi : 10.1093 / clinchem / 40.3.411 . PMID 8131277 .
- ^ Stahl W, Schwarz W, Sundquist AR, Sies H (abril de 1992). "Isómeros cis-trans de licopeno y betacaroteno en suero y tejidos humanos". Archivos de Bioquímica y Biofísica . 294 (1): 173–7. doi : 10.1016 / 0003-9861 (92) 90153-N . PMID 1550343 .
- ^ Zita C, Overvad K, Mortensen SA, Sindberg CD, Moesgaard S, Hunter DA (2003). "Concentraciones séricas de coenzima Q10 en hombres sanos suplementadas con 30 mg o 100 mg de coenzima Q10 durante dos meses en un estudio controlado aleatorizado". BioFactors . 18 (1–4): 185–93. doi : 10.1002 / biof.5520180221 . PMID 14695934 . S2CID 19895215 .
- ↑ a b Turunen M, Olsson J, Dallner G (enero de 2004). "Metabolismo y función de la coenzima Q". Biochimica et Biophysica Acta (BBA) - Biomembranas . 1660 (1–2): 171–99. doi : 10.1016 / j.bbamem.2003.11.012 . PMID 14757233 .
- ↑ a b Enomoto A, Endou H (septiembre de 2005). "Funciones de los transportadores de aniones orgánicos (OAT) y un transportador de uratos (URAT1) en la fisiopatología de la enfermedad humana". Nefrología clínica y experimental . 9 (3): 195–205. doi : 10.1007 / s10157-005-0368-5 . PMID 16189627 . S2CID 6145651 .
- ^ a b Wu XW, Lee CC, Muzny DM, Caskey CT (diciembre de 1989). "Urato oxidasa: estructura primaria e implicaciones evolutivas" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 86 (23): 9412–6. Código Bibliográfico : 1989PNAS ... 86.9412W . doi : 10.1073 / pnas.86.23.9412 . PMC 298506 . PMID 2594778 .
- ^ Wu XW, Muzny DM, Lee CC, Caskey CT (enero de 1992). "Dos eventos mutacionales independientes en la pérdida de urato oxidasa durante la evolución de los hominoides". Revista de evolución molecular . 34 (1): 78–84. Código Bibliográfico : 1992JMolE..34 ... 78W . doi : 10.1007 / BF00163854 . PMID 1556746 . S2CID 33424555 .
- ^ Álvarez-Lario B, Macarrón-Vicente J (noviembre de 2010). "Ácido úrico y evolución" . Reumatología . 49 (11): 2010–5. doi : 10.1093 / reumatología / keq204 . PMID 20627967 .
- ↑ a b Watanabe S, Kang DH, Feng L, Nakagawa T, Kanellis J, Lan H, Mazzali M, Johnson RJ (septiembre de 2002). "Ácido úrico, evolución de hominoides y patogénesis de la sensibilidad a la sal" . La hipertensión . 40 (3): 355–60. doi : 10.1161 / 01.HYP.0000028589.66335.AA . PMID 12215479 .
- ^ Johnson RJ, Andrews P, Benner SA, Oliver W (2010). "Premio Theodore E. Woodward. La evolución de la obesidad: conocimientos desde el Mioceno medio" . Transacciones de la Asociación Estadounidense de Clínica y Climatología . 121 : 295-305, discusión 305-8. PMC 2917125 . PMID 20697570 .
- ^ a b Baillie JK, Bates MG, Thompson AA, Waring WS, Partridge RW, Schnopp MF, Simpson A, Gulliver-Sloan F, Maxwell SR, Webb DJ (mayo de 2007). "La producción de urato endógeno aumenta la capacidad antioxidante del plasma en sujetos sanos de tierras bajas expuestos a gran altitud". Pecho . 131 (5): 1473–8. doi : 10.1378 / cofre.06-2235 . PMID 17494796 .
- ^ Becker BF (junio de 1993). "Hacia la función fisiológica del ácido úrico". Biología y Medicina de Radicales Libres . 14 (6): 615–31. doi : 10.1016 / 0891-5849 (93) 90143-I . PMID 8325534 .
- ↑ a b Sautin YY, Johnson RJ (junio de 2008). "Ácido úrico: la paradoja oxidante-antioxidante" . Nucleósidos, nucleótidos y ácidos nucleicos . 27 (6): 608-19. doi : 10.1080 / 15257770802138558 . PMC 2895915 . PMID 18600514 .
- ^ Eggebeen AT (septiembre de 2007). "Gota: una actualización" . Médico de familia estadounidense . 76 (6): 801–8. PMID 17910294 .
- ^ Campion EW, Glynn RJ, DeLabry LO (marzo de 1987). "Hiperuricemia asintomática. Riesgos y consecuencias en el Estudio Normativo de Envejecimiento". La Revista Estadounidense de Medicina . 82 (3): 421–6. doi : 10.1016 / 0002-9343 (87) 90441-4 . PMID 3826098 .
- ^ Nazarewicz RR, Ziolkowski W, Vaccaro PS, Ghafourifar P (diciembre de 2007). "Efecto de la dieta cetogénica a corto plazo sobre el estado redox de la sangre humana". Investigación de rejuvenecimiento . 10 (4): 435–40. doi : 10.1089 / rej.2007.0540 . PMID 17663642 .
- ^ a b c d "Vitamina C" . Centro de información sobre micronutrientes, Instituto Linus Pauling, Universidad Estatal de Oregón, Corvallis, Oregón. 1 de julio de 2018 . Consultado el 19 de junio de 2019 .
- ^ Smirnoff N (2001). "Biosíntesis de ácido L-ascórbico". Biosíntesis de cofactores . Vitaminas y hormonas. 61 . págs. 241–66. doi : 10.1016 / S0083-6729 (01) 61008-2 . ISBN 978-0-12-709861-6. PMID 11153268 .
- ^ Linster CL, Van Schaftingen E (enero de 2007). "Vitamina C. Biosíntesis, reciclaje y degradación en mamíferos" . La revista FEBS . 274 (1): 1–22. doi : 10.1111 / j.1742-4658.2006.05607.x . PMID 17222174 . S2CID 21345196 .
- ↑ a b Meister A (abril de 1994). "Sistema antioxidante glutatión-ácido ascórbico en animales" . La Revista de Química Biológica . 269 (13): 9397–400. doi : 10.1016 / S0021-9258 (17) 36891-6 . PMID 8144521 .
- ^ Wells WW, Xu DP, Yang YF, Rocque PA (septiembre de 1990). "La tioltransferasa de mamíferos (glutaredoxina) y la proteína disulfuro isomerasa tienen actividad dehidroascorbato reductasa" . La Revista de Química Biológica . 265 (26): 15361–4. doi : 10.1016 / S0021-9258 (18) 55401-6 . PMID 2394726 .
- ^ Padayatty SJ, Katz A, Wang Y, Eck P, Kwon O, Lee JH, Chen S, Corpe C, Dutta A, Dutta SK, Levine M (febrero de 2003). "La vitamina C como antioxidante: evaluación de su papel en la prevención de enfermedades" . Revista del Colegio Americano de Nutrición . 22 (1): 18–35. doi : 10.1080 / 07315724.2003.10719272 . PMID 12569111 . S2CID 21196776 .
- ^ Shigeoka S, Ishikawa T, Tamoi M, Miyagawa Y, Takeda T, Yabuta Y, Yoshimura K (mayo de 2002). "Regulación y función de las isoenzimas ascorbato peroxidasa" . Revista de botánica experimental . 53 (372): 1305-19. doi : 10.1093 / jexbot / 53.372.1305 . PMID 11997377 .
- ^ Smirnoff N, Wheeler GL (2000). "Ácido ascórbico en plantas: biosíntesis y función". Revisiones críticas en bioquímica y biología molecular . 35 (4): 291–314. doi : 10.1080 / 10409230008984166 . PMID 11005203 . S2CID 85060539 .
- ↑ a b c d Meister A, Anderson ME (1983). "Glutatión". Revisión anual de bioquímica . 52 : 711–60. doi : 10.1146 / annurev.bi.52.070183.003431 . PMID 6137189 .
- ^ Meister A (noviembre de 1988). "Metabolismo del glutatión y su modificación selectiva" . La Revista de Química Biológica . 263 (33): 17205–8. doi : 10.1016 / S0021-9258 (19) 77815-6 . PMID 3053703 .
- ^ Gaballa A, Newton GL, Antelmann H, Parsonage D, Upton H, Rawat M, Claiborne A, Fahey RC, Helmann JD (abril de 2010). "Biosíntesis y funciones del bacilitiol, uno de los principales tiol de bajo peso molecular en Bacilli" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (14): 6482–6. Código Bibliográfico : 2010PNAS..107.6482G . doi : 10.1073 / pnas.1000928107 . PMC 2851989 . PMID 20308541 .
- ^ Newton GL, Rawat M, La Clair JJ, Jothivasan VK, Budiarto T, Hamilton CJ, Claiborne A, Helmann JD, Fahey RC (septiembre de 2009). "El bacilitiol es un tiol antioxidante producido en Bacilli" . Biología química de la naturaleza . 5 (9): 625–627. doi : 10.1038 / nchembio.189 . PMC 3510479 . PMID 19578333 .
- ^ Fahey RC (2001). "Nuevos tioles de procariotas". Revisión anual de microbiología . 55 : 333–56. doi : 10.1146 / annurev.micro.55.1.333 . PMID 11544359 .
- ^ Fairlamb AH, Cerami A (1992). "Metabolismo y funciones de tripanotiona en la Kinetoplastida". Revisión anual de microbiología . 46 : 695–729. doi : 10.1146 / annurev.mi.46.100192.003403 . PMID 1444271 .
- ↑ a b Herrera E, Barbas C (marzo de 2001). "Vitamina E: acción, metabolismo y perspectivas". Revista de fisiología y bioquímica . 57 (2): 43–56. doi : 10.1007 / BF03179812 . PMID 11579997 . S2CID 7272312 .
- ^ Packer L, Weber SU, Rimbach G (febrero de 2001). "Aspectos moleculares de la acción antioxidante del alfa-tocotrienol y la señalización celular" . La Revista de Nutrición . 131 (2): 369S – 73S. doi : 10.1093 / jn / 131.2.369S . PMID 11160563 .
- ↑ a b Brigelius-Flohé R, Traber MG (julio de 1999). "Vitamina E: función y metabolismo". Revista FASEB . 13 (10): 1145–55. CiteSeerX 10.1.1.337.5276 . doi : 10.1096 / fasebj.13.10.1145 . PMID 10385606 . S2CID 7031925 .
- ^ Traber MG, Atkinson J (julio de 2007). "Vitamina E, antioxidante y nada más" . Biología y Medicina de Radicales Libres . 43 (1): 4–15. doi : 10.1016 / j.freeradbiomed.2007.03.024 . PMC 2040110 . PMID 17561088 .
- ^ Wang X, Quinn PJ (julio de 1999). "Vitamina E y su función en membranas". Progreso en la investigación de lípidos . 38 (4): 309–36. doi : 10.1016 / S0163-7827 (99) 00008-9 . PMID 10793887 .
- ^ Seiler A, Schneider M, Förster H, Roth S, Wirth EK, Culmsee C, Plesnila N, Kremmer E, Rådmark O, Wurst W, Bornkamm GW, Schweizer U, Conrad M (septiembre de 2008). "La glutatión peroxidasa 4 detecta y traduce el estrés oxidativo en muerte celular dependiente de 12/15-lipoxigenasa y mediada por AIF". Metabolismo celular . 8 (3): 237–48. doi : 10.1016 / j.cmet.2008.07.005 . PMID 18762024 .
- ^ Brigelius-Flohé R, Davies KJ (julio de 2007). "¿Es la vitamina E un antioxidante, un regulador de la transducción de señales y la expresión génica, o una comida 'chatarra'? Comentarios sobre los dos artículos adjuntos:" Mecanismo molecular de la acción del alfa-tocoferol "por A. Azzi y" Vitamina E, antioxidante y nada más "de M. Traber y J. Atkinson". Biología y Medicina de Radicales Libres . 43 (1): 2-3. doi : 10.1016 / j.freeradbiomed.2007.05.016 . PMID 17561087 .
- ^ Atkinson J, Epand RF, Epand RM (marzo de 2008). "Tocoferoles y tocotrienoles en membranas: una revisión crítica". Biología y Medicina de Radicales Libres . 44 (5): 739–64. doi : 10.1016 / j.freeradbiomed.2007.11.010 . PMID 18160049 .
- ^ Azzi A (julio de 2007). "Mecanismo molecular de la acción del alfa-tocoferol". Biología y Medicina de Radicales Libres . 43 (1): 16-21. doi : 10.1016 / j.freeradbiomed.2007.03.013 . PMID 17561089 .
- ^ Zingg JM, Azzi A (mayo de 2004). "Actividades no antioxidantes de la vitamina E" . Química Medicinal Actual . 11 (9): 1113–33. doi : 10.2174 / 0929867043365332 . PMID 15134510 . Archivado desde el original el 6 de octubre de 2011.
- ^ Sen CK, Khanna S, Roy S (marzo de 2006). "Tocotrienoles: vitamina E más allá de los tocoferoles" . Ciencias de la vida . 78 (18): 2088–98. doi : 10.1016 / j.lfs.2005.12.001 . PMC 1790869 . PMID 16458936 .
- ^ Duarte TL, Lunec J (julio de 2005). "Revisión: ¿Cuándo un antioxidante no es un antioxidante? Una revisión de las nuevas acciones y reacciones de la vitamina C". Investigación de radicales libres . 39 (7): 671–86. doi : 10.1080 / 10715760500104025 . PMID 16036346 . S2CID 39962659 .
- ↑ a b Carr A, Frei B (junio de 1999). "¿La vitamina C actúa como pro-oxidante en condiciones fisiológicas?". Revista FASEB . 13 (9): 1007–24. doi : 10.1096 / fasebj.13.9.1007 . PMID 10336883 . S2CID 15426564 .
- ^ Schneider C (enero de 2005). "Química y biología de la vitamina E". Nutrición molecular e investigación alimentaria . 49 (1): 7–30. doi : 10.1002 / mnfr.200400049 . PMID 15580660 .
- ^ Halliwell B (agosto de 2008). "¿Los polifenoles son antioxidantes o prooxidantes? ¿Qué aprendemos del cultivo celular y los estudios in vivo?". Archivos de Bioquímica y Biofísica . 476 (2): 107–112. doi : 10.1016 / j.abb.2008.01.028 . PMID 18284912 .
- ^ Ristow M, Zarse K (junio de 2010). "Cómo el aumento del estrés oxidativo promueve la longevidad y la salud metabólica: el concepto de hormesis mitocondrial (mitohormesis)". Gerontología experimental . 45 (6): 410–418. doi : 10.1016 / j.exger.2010.03.014 . PMID 20350594 . S2CID 207727334 .
- ↑ a b Ho YS, Magnenat JL, Gargano M, Cao J (octubre de 1998). "La naturaleza de los mecanismos de defensa antioxidantes: una lección de los estudios transgénicos" . Perspectivas de salud ambiental . 106 Suppl 5 (Suppl 5): 1219–28. doi : 10.2307 / 3433989 . JSTOR 3433989 . PMC 1533365 . PMID 9788901 .
- ^ Zelko IN, Mariani TJ, Folz RJ (agosto de 2002). "Familia multigénica de superóxido dismutasa: una comparación de las estructuras, evolución y expresión de los genes CuZn-SOD (SOD1), Mn-SOD (SOD2) y EC-SOD (SOD3)". Biología y Medicina de Radicales Libres . 33 (3): 337–49. doi : 10.1016 / S0891-5849 (02) 00905-X . PMID 12126755 .
- ↑ a b Bannister JV, Bannister WH, Rotilio G (1987). "Aspectos de la estructura, función y aplicaciones de la superóxido dismutasa". Revisiones críticas de CRC en bioquímica . 22 (2): 111–80. doi : 10.3109 / 10409238709083738 . PMID 3315461 .
- ^ Johnson F, Giulivi C (2005). "Superóxido dismutases y su impacto en la salud humana". Aspectos moleculares de la medicina . 26 (4–5): 340–52. doi : 10.1016 / j.mam.2005.07.006 . PMID 16099495 .
- ^ Nozik-Grayck E, Suliman HB, Piantadosi CA (diciembre de 2005). "Superóxido dismutasa extracelular". La Revista Internacional de Bioquímica y Biología Celular . 37 (12): 2466–71. doi : 10.1016 / j.biocel.2005.06.012 . PMID 16087389 .
- ^ Melov S, Schneider JA, Day BJ, Hinerfeld D, Coskun P, Mirra SS, Crapo JD, Wallace DC (febrero de 1998). "Un nuevo fenotipo neurológico en ratones que carecen de superóxido dismutasa de manganeso mitocondrial". Genética de la naturaleza . 18 (2): 159–63. doi : 10.1038 / ng0298-159 . PMID 9462746 . S2CID 20843002 .
- ^ Reaume AG, Elliott JL, Hoffman EK, Kowall NW, Ferrante RJ, Siwek DF, Wilcox HM, Flood DG, Beal MF, Brown RH, Scott RW, Snider WD (mayo de 1996). "Las neuronas motoras en ratones deficientes en superóxido dismutasa de Cu / Zn se desarrollan normalmente pero exhiben una muerte celular mejorada después de una lesión axonal". Genética de la naturaleza . 13 (1): 43–7. doi : 10.1038 / ng0596-43 . PMID 8673102 . S2CID 13070253 .
- ^ Van Camp W, Inzé D, Van Montagu M (1997). "La regulación y función de las superóxido dismutasas del tabaco". Biología y Medicina de Radicales Libres . 23 (3): 515-20. doi : 10.1016 / S0891-5849 (97) 00112-3 . PMID 9214590 .
- ^ Chelikani P, Fita I, Loewen PC (enero de 2004). "Diversidad de estructuras y propiedades entre catalasas" (PDF) . Ciencias de la vida celular y molecular (manuscrito enviado). 61 (2): 192-208. doi : 10.1007 / s00018-003-3206-5 . hdl : 10261/111097 . PMID 14745498 . S2CID 4411482 .
- ↑ Zámocký M, Koller F (1999). "Comprensión de la estructura y función de las catalasas: pistas de la evolución molecular y mutagénesis in vitro" . Avances en Biofísica y Biología Molecular . 72 (1): 19–66. doi : 10.1016 / S0079-6107 (98) 00058-3 . PMID 10446501 .
- ↑ del Río LA, Sandalio LM, Palma JM, Bueno P, Corpas FJ (noviembre de 1992). "Metabolismo de radicales de oxígeno en peroxisomas e implicaciones celulares". Biología y Medicina de Radicales Libres . 13 (5): 557–80. doi : 10.1016 / 0891-5849 (92) 90150-F . PMID 1334030 .
- ^ Hiner AN, Raven EL, Thorneley RN, García-Cánovas F, Rodríguez-López JN (julio de 2002). "Mecanismos de formación del compuesto I en hemo peroxidasas". Revista de bioquímica inorgánica . 91 (1): 27–34. doi : 10.1016 / S0162-0134 (02) 00390-2 . PMID 12121759 .
- ^ Mueller S, Riedel HD, Stremmel W (diciembre de 1997). "Evidencia directa de catalasa como la enzima predominante de eliminación de H2O2 en eritrocitos humanos" . Sangre . 90 (12): 4973–8. doi : 10.1182 / sangre.V90.12.4973 . PMID 9389716 .
- ^ Ogata M (febrero de 1991). "Acatalasemia". Genética humana . 86 (4): 331–40. doi : 10.1007 / BF00201829 . PMID 1999334 .
- ↑ Parsonage D, Youngblood D, Sarma G, Wood Z, Karplus P, Poole L (2005). "Análisis del vínculo entre la actividad enzimática y el estado oligomérico en AhpC, una peroxiredoxina bacteriana" . Bioquímica . 44 (31): 10583–92. doi : 10.1021 / bi050448i . PMC 3832347 . PMID 16060667 . PDB 1YEX
- ^ Rhee SG, Chae HZ, Kim K (junio de 2005). "Peroxiredoxinas: una descripción histórica y una vista previa especulativa de mecanismos novedosos y conceptos emergentes en la señalización celular". Biología y Medicina de Radicales Libres . 38 (12): 1543–52. doi : 10.1016 / j.freeradbiomed.2005.02.026 . PMID 15917183 .
- ^ Madera ZA, Schröder E, Robin Harris J, Poole LB (enero de 2003). "Estructura, mecanismo y regulación de peroxiredoxinas". Tendencias en Ciencias Bioquímicas . 28 (1): 32–40. doi : 10.1016 / S0968-0004 (02) 00003-8 . PMID 12517450 .
- ^ Claiborne A, Yeh JI, Mallett TC, Luba J, Crane EJ, Charrier V, Parsonage D (noviembre de 1999). "Ácidos proteína-sulfénicos: diversas funciones para un jugador poco probable en la catálisis enzimática y la regulación redox". Bioquímica . 38 (47): 15407–16. doi : 10.1021 / bi992025k . PMID 10569923 .
- ^ Jönsson TJ, Lowther WT (2007). "Las proteínas reparadoras de peroxiredoxina". Sistemas de peroxiredoxina . Bioquímica subcelular. 44 . págs. 115–41. doi : 10.1007 / 978-1-4020-6051-9_6 . ISBN 978-1-4020-6050-2. PMC 2391273 . PMID 18084892 .
- ^ Neumann CA, Krause DS, Carman CV, Das S, Dubey DP, Abraham JL, Bronson RT, Fujiwara Y, Orkin SH, Van Etten RA (julio de 2003). "Papel esencial de la peroxiredoxina Prdx1 en la defensa antioxidante de los eritrocitos y la supresión de tumores" (PDF) . Naturaleza . 424 (6948): 561–5. Código Bibliográfico : 2003Natur.424..561N . doi : 10.1038 / nature01819 . PMID 12891360 . S2CID 3570549 .
- ^ Lee TH, Kim SU, Yu SL, Kim SH, Park DS, Moon HB, Dho SH, Kwon KS, Kwon HJ, Han YH, Jeong S, Kang SW, Shin HS, Lee KK, Rhee SG, Yu DY (junio 2003). "Peroxiredoxin II es esencial para mantener la vida útil de los eritrocitos en ratones" . Sangre . 101 (12): 5033–8. doi : 10.1182 / sangre-2002-08-2548 . PMID 12586629 .
- ^ Dietz KJ, Jacob S, Oelze ML, Laxa M, Tognetti V, de Miranda SM, Baier M, Finkemeier I (2006). "La función de las peroxiredoxinas en el metabolismo redox de los orgánulos vegetales" . Revista de botánica experimental . 57 (8): 1697–709. doi : 10.1093 / jxb / erj160 . PMID 16606633 .
- ^ Nordberg J, Arnér ES (diciembre de 2001). "Especies reactivas de oxígeno, antioxidantes y el sistema de tiorredoxina de mamíferos". Biología y Medicina de Radicales Libres . 31 (11): 1287–312. doi : 10.1016 / S0891-5849 (01) 00724-9 . PMID 11728801 .
- ^ Vieira Dos Santos C, Rey P (julio de 2006). "Las tiorredoxinas vegetales son actores clave en la respuesta al estrés oxidativo". Tendencias en ciencia de las plantas . 11 (7): 329–34. doi : 10.1016 / j.tplants.2006.05.005 . PMID 16782394 .
- ^ Arnér ES, Holmgren A (octubre de 2000). "Funciones fisiológicas de tiorredoxina y tiorredoxina reductasa" . Revista Europea de Bioquímica / FEBS . 267 (20): 6102–9. doi : 10.1046 / j.1432-1327.2000.01701.x . PMID 11012661 .
- ^ Mustacich D, Powis G (febrero de 2000). "Tiorredoxina reductasa" . La revista bioquímica . 346 (1): 1–8. doi : 10.1042 / 0264-6021: 3460001 . PMC 1220815 . PMID 10657232 .
- ^ Creissen G, Broadbent P, Stevens R, Wellburn AR, Mullineaux P (mayo de 1996). "Manipulación del metabolismo del glutatión en plantas transgénicas". Transacciones de la sociedad bioquímica . 24 (2): 465–9. doi : 10.1042 / bst0240465 . PMID 8736785 .
- ^ Brigelius-Flohé R (noviembre de 1999). "Funciones específicas de tejido de glutatión peroxidasas individuales". Biología y Medicina de Radicales Libres . 27 (9-10): 951-65. doi : 10.1016 / S0891-5849 (99) 00173-2 . PMID 10569628 .
- ^ Ho YS, Magnenat JL, Bronson RT, Cao J, Gargano M, Sugawara M, Funk CD (junio de 1997). "Los ratones deficientes en glutatión peroxidasa celular se desarrollan normalmente y no muestran una mayor sensibilidad a la hiperoxia" . La Revista de Química Biológica . 272 (26): 16644–51. doi : 10.1074 / jbc.272.26.16644 . PMID 9195979 .
- ^ de Haan JB, Bladier C, Griffiths P, Kelner M, O'Shea RD, Cheung NS, Bronson RT, Silvestro MJ, Wild S, Zheng SS, Beart PM, Hertzog PJ, Kola I (agosto de 1998). "Los ratones con una mutación nula homocigótica para la glutatión peroxidasa más abundante, Gpx1, muestran una mayor susceptibilidad a los agentes inductores de estrés oxidativo paraquat y peróxido de hidrógeno" . La Revista de Química Biológica . 273 (35): 22528–36. doi : 10.1074 / jbc.273.35.22528 . PMID 9712879 .
- ^ Sharma R, Yang Y, Sharma A, Awasthi S, Awasthi YC (abril de 2004). "Papel antioxidante de las glutatión S-transferasas: protección contra la toxicidad oxidante y regulación de la apoptosis mediada por estrés". Antioxidantes y señalización redox . 6 (2): 289–300. doi : 10.1089 / 152308604322899350 . PMID 15025930 .
- ^ Hayes JD, Flanagan JU, Jowsey IR (2005). "Transferasas de glutatión". Revista anual de farmacología y toxicología . 45 : 51–88. doi : 10.1146 / annurev.pharmtox.45.120403.095857 . PMID 15822171 .
- ^ Kader AA, Zagory D, Kerbel EL (1989). "Envasado de frutas y verduras en atmósfera modificada". Revisiones críticas en ciencia de los alimentos y nutrición . 28 (1): 1–30. doi : 10.1080 / 10408398909527490 . PMID 2647417 .
- ^ Zallen EM, Hitchcock MJ, Goertz GE (diciembre de 1975). "Sistemas de alimentos refrigerados. Efectos de la conservación refrigerada sobre la calidad de los panes de res". Revista de la Asociación Dietética Estadounidense . 67 (6): 552–7. PMID 1184900 .
- ^ Iverson F (junio de 1995). "Antioxidantes fenólicos: estudios de la rama de protección de la salud sobre hidroxianisol butilado". Letras de cáncer . 93 (1): 49–54. doi : 10.1016 / 0304-3835 (95) 03787-W . PMID 7600543 .
- ^ "Índice de números E" . Guía gastronómica del Reino Unido. Archivado desde el original el 4 de marzo de 2007 . Consultado el 5 de marzo de 2007 .
- ^ Robards K, Kerr AF, Patsalides E (febrero de 1988). "Rancidez y su medición en aceites comestibles y snacks. Una revisión". El analista . 113 (2): 213–24. Código Bibliográfico : 1988Ana ... 113..213R . doi : 10.1039 / an9881300213 . PMID 3288002 .
- ^ Del Carlo M, Sacchetti G, Di Mattia C, Compagnone D, Mastrocola D, Liberatore L, Cichelli A (junio de 2004). "Contribución de la fracción fenólica a la actividad antioxidante y estabilidad oxidativa del aceite de oliva". Revista de Química Agrícola y Alimentaria . 52 (13): 4072–9. doi : 10.1021 / jf049806z . PMID 15212450 .
- ^ Boozer CE, Hammond GS, Hamilton CE, Sen JN (1955). "Oxidación atmosférica de hidrocarburos.1II. La estequiometría y destino de los inhibidores en benceno y clorobenceno". Revista de la Sociedad Química Estadounidense . 77 (12): 3233–7. doi : 10.1021 / ja01617a026 .
- ^ "Mercado global de antioxidantes (naturales y sintéticos) preparado para aumentar de USD 2,25 mil millones en 2014 a USD 3,25 mil millones en 2020, creciendo a 5.5% CAGR" . GlobalNewswire, El Segundo, CA. 19 de enero de 2016 . Consultado el 30 de enero de 2017 .
- ^ "¿Por qué utilizar antioxidantes?" . Adhesivos SpecialChem. Archivado desde el original el 11 de febrero de 2007 . Consultado el 27 de febrero de 2007 .
- ^ a b "Combustibles antioxidantes" . Productos químicos de Innospec. Archivado desde el original el 15 de octubre de 2006 . Consultado el 27 de febrero de 2007 .
- ^ Rodríguez-Amaya DB (2003). "Carotenoides alimentarios: análisis, composición y alteraciones durante el almacenamiento y procesamiento de los alimentos". Foro de Nutrición . 56 : 35–7. PMID 15806788 .
- ^ Maiani G, Castón MJ, Catasta G, Toti E, Cambrodón IG, Bysted A, Granado-Lorencio F, Olmedilla-Alonso B, Knuthsen P, Valoti M, Böhm V, Mayer-Miebach E, Behsnilian D, Schlemmer U (septiembre 2009). "Carotenoides: conocimiento real sobre fuentes de alimentos, ingesta, estabilidad y biodisponibilidad y su función protectora en los seres humanos" . Nutrición molecular e investigación alimentaria . 53 Suppl 2: S194–218. doi : 10.1002 / mnfr.200800053 . hdl : 10261/77697 . PMID 19035552 . Archivado desde el original el 27 de septiembre de 2018 . Consultado el 18 de abril de 2017 .
- ^ Henry CJ, Heppell N (febrero de 2002). "Pérdidas y ganancias nutricionales durante el procesamiento: problemas y problemas futuros" . Las actas de la Sociedad de Nutrición . 61 (1): 145–8. doi : 10.1079 / PNS2001142 . PMID 12002789 .
- ^ "Antioxidantes y prevención del cáncer: hoja informativa" . Instituto Nacional del Cáncer. Archivado desde el original el 4 de marzo de 2007 . Consultado el 27 de febrero de 2007 .
- ^ Ortega R (diciembre de 2006). "Importancia de los alimentos funcionales en la dieta mediterránea" . Nutrición en Salud Pública . 9 (8A): 1136–40. doi : 10.1017 / S1368980007668530 . PMID 17378953 .
- ^ Witschi A, Reddy S, Stofer B, Lauterburg BH (1992). "La disponibilidad sistémica de glutatión oral". Revista europea de farmacología clínica . 43 (6): 667–9. doi : 10.1007 / BF02284971 . PMID 1362956 . S2CID 27606314 .
- ^ Flagg EW, Coates RJ, Eley JW, Jones DP, Gunter EW, Byers TE, Block GS, Greenberg RS (1994). "Ingesta dietética de glutatión en seres humanos y la relación entre la ingesta y el nivel de glutatión total en plasma". Nutrición y cáncer . 21 (1): 33–46. doi : 10.1080 / 01635589409514302 . PMID 8183721 .
- ^ Dodd S, Dean O, Copolov DL, Malhi GS, Berk M (diciembre de 2008). "N-acetilcisteína para terapia antioxidante: farmacología y utilidad clínica". Opinión de expertos sobre terapia biológica . 8 (12): 1955–62. doi : 10.1517 / 14728220802517901 . PMID 18990082 . S2CID 74736842 .
- ^ van de Poll MC, Dejong CH, Soeters PB (junio de 2006). "Gama adecuada de aminoácidos azufrados y biomarcadores de su exceso: lecciones de la nutrición enteral y parenteral" . La Revista de Nutrición . 136 (6 Supl.): 1694S – 1700S. doi : 10.1093 / jn / 136.6.1694S . PMID 16702341 .
- ^ Cao G, Alessio HM, Cutler RG (marzo de 1993). "Ensayo de capacidad de absorbancia de radicales de oxígeno para antioxidantes" . Biología y Medicina de Radicales Libres . 14 (3): 303-11. doi : 10.1016 / 0891-5849 (93) 90027-R . PMID 8458588 .
- ^ Ou B, Hampsch-Woodill M, Prior RL (octubre de 2001). "Desarrollo y validación de un ensayo mejorado de capacidad de absorbancia de radicales de oxígeno utilizando fluoresceína como sonda fluorescente". Revista de Química Agrícola y Alimentaria . 49 (10): 4619-26. doi : 10.1021 / jf010586o . PMID 11599998 .
- ^ a b "Retirado: capacidad de absorbancia de radicales de oxígeno (ORAC) de alimentos seleccionados, versión 2 (2010)" . Departamento de Agricultura de los Estados Unidos, Servicio de Investigación Agrícola. 16 de mayo de 2012 . Consultado el 13 de junio de 2012 .
- ^ Prior RL, Wu X, Schaich K (mayo de 2005). "Métodos estandarizados para la determinación de la capacidad antioxidante y fenólicos en alimentos y suplementos dietéticos" (PDF) . Revista de Química Agrícola y Alimentaria . 53 (10): 4290-302. doi : 10.1021 / jf0502698 . PMID 15884874 . Archivado desde el original (PDF) el 29 de diciembre de 2016 . Consultado el 24 de octubre de 2017 .
- ^ Benzie IF (septiembre de 2003). "Evolución de los antioxidantes dietéticos". Bioquímica y Fisiología Comparativa A . 136 (1): 113–26. doi : 10.1016 / S1095-6433 (02) 00368-9 . hdl : 10397/34754 . PMID 14527634 .
- ^ Mattill HA (1947). "Antioxidantes". Revisión anual de bioquímica . 16 : 177–92. doi : 10.1146 / annurev.bi.16.070147.001141 . PMID 20259061 .
- ^ Alemán JB (1999). "Procesamiento de alimentos y oxidación de lípidos". Impacto del procesamiento en la seguridad alimentaria . Avances en Medicina y Biología Experimental. 459 . págs. 23–50. doi : 10.1007 / 978-1-4615-4853-9_3 . ISBN 978-0-306-46051-7. PMID 10335367 .
- ^ Jacob RA (1996). Tres épocas del descubrimiento de la vitamina C . Bioquímica subcelular. 25 . págs. 1-16. doi : 10.1007 / 978-1-4613-0325-1_1 . ISBN 978-1-4613-7998-0. PMID 8821966 .
- ^ Caballero JA (1998). "Radicales libres: su historia y estado actual en el envejecimiento y la enfermedad". Anales de ciencia clínica y de laboratorio . 28 (6): 331–46. PMID 9846200 .
- ↑ Moureu C, Dufraisse C (1922). "Sur l'autoxydation: Les antioxygènes". Comptes Rendus des Séances et Mémoires de la Société de Biologie (en francés). 86 : 321–322.
- ^ Wolf G (marzo de 2005). "El descubrimiento de la función antioxidante de la vitamina E: la contribución de Henry A. Mattill" . La Revista de Nutrición . 135 (3): 363–6. doi : 10.1093 / jn / 135.3.363 . PMID 15735064 .
Lectura adicional [ editar ]
- Halliwell, Barry. y John MC Gutteridge, Radicales libres en biología y medicina (Oxford University Press, 2007), ISBN 0-19-856869-X
- Lane, Nick, Oxígeno: la molécula que hizo el mundo (Oxford University Press, 2003), ISBN 0-19-860783-0
- Pokorny, Jan, Nelly Yanishlieva y Michael H. Gordon, Antioxidants in Food: Practical Applications (CRC Press, 2001), ISBN 0-8493-1222-1
Enlaces externos [ editar ]
- Medios relacionados con los antioxidantes en Wikimedia Commons
![{\ displaystyle {\ ce {{\ underset {Oxígeno} {O2}} -> {\ underset {Superóxido} {* O2 ^ {-}}} -> [{\ ce {Superóxido \ sobre dismutasa}}] {\ underset {Hidrógeno \ encima del peróxido} {H2O2}} -> [{\ ce {Peroxidasas \ encima de la catalasa}}] {\ underset {Agua} {H2O}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8feecd26377be56b431d182ea9a398ab6b5d3b7f)