terapia bacteriana
La terapia bacteriana es el uso terapéutico de bacterias para tratar enfermedades . Los productos terapéuticos bacterianos son medicamentos vivos y pueden ser bacterias de tipo salvaje (a menudo en forma de probióticos ) o bacterias modificadas genéticamente para poseer propiedades terapéuticas que se inyectan en un paciente. [1] [2]
Otros ejemplos de medicamentos vivos incluyen terapias celulares (incluidas las inmunoterapéuticas ) y terapias de fagos .
El desarrollo de terapias bacterianas es un área de investigación extremadamente activa en los campos de la biología sintética y la microbiología . [5] [6] [7] [8] [9] [10] [11] [12] [13] Actualmente, hay un gran enfoque en: 1) identificar bacterias que producen efectos terapéuticos de forma natural (por ejemplo, probióticos bacterias), y 2) bacterias programadas genéticamente para producir efectos terapéuticos. [14] [15] [16]
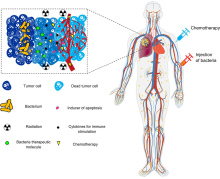
Existe un gran interés en el uso de bacterias como terapia para tratar tumores. En particular, las bacterias alojadoras de tumores que prosperan en ambientes hipóxicos son particularmente atractivas para este propósito, ya que tenderán a migrar, invadir (a través de la vasculatura con fugas en el microambiente tumoral ) y colonizar tumores. Esta propiedad tiende a aumentar su tiempo de residencia en el tumor, dándoles más tiempo para ejercer sus efectos terapéuticos, a diferencia de otras bacterias que serían eliminadas rápidamente por el sistema inmunitario. [18] [19] [20]
Existe un interés considerable en el uso de terapias bacterianas para alterar la microbiota gastrointestinal humana , lo que sería útil en el tratamiento de enfermedades como el crecimiento excesivo de bacterias en el intestino delgado y otras formas de disbiosis .

a Varios aspectos requieren consideración durante el diseño de un tratamiento bacteriano diseñado. La selección de un organismo de chasis puede guiarse por el sitio deseado de actividad y las propiedades farmacocinéticas del chasis, así como por la viabilidad de fabricación. El diseño de los circuitos genéticos también puede verse influido por los efectores del circuito, las preocupaciones pragmáticas con respecto a los compuestos inductores y la estabilidad genética de los circuitos reguladores. Críticamente, el diseño de un fármaco bacteriano diseñado también puede verse limitado por las consideraciones de las necesidades de los pacientes.
b El diseño óptimo de la cepa a menudo requiere un equilibrio entre la idoneidad de la cepa para funcionar en el microambiente objetivo y las preocupaciones por la viabilidad de la fabricación y el desarrollo clínico.
[3] 
Representación esquemática de un flujo de trabajo para desarrollar cepas diseñadas con calidad de candidatas clínicas. El flujo de trabajo de desarrollo debe incorporar tecnologías para optimizar la potencia de la cepa, así como ensayos predictivos in vitro e in vivo, así como modelos de farmacología cuantitativa, para maximizar el potencial de traducción para las poblaciones de pacientes.
[4]
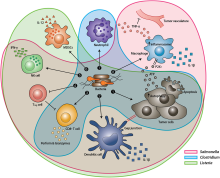
Esquema de estrategias de bacterias terapéuticas contra tumores hipóxicos

Después de la administración sistémica, las bacterias se localizan en el microambiente del tumor. Las interacciones entre las bacterias, las células cancerosas y el microambiente circundante provocan diversas alteraciones en las células inmunitarias infiltrantes del tumor, las citocinas y las quimiocinas, que facilitan aún más la regresión del tumor. ① Las toxinas bacterianas de S. Typhimurium, Listeria y Clostridium pueden destruir las células tumorales directamente al inducir la apoptosis o la autofagia. Las toxinas administradas a través de Salmonella pueden regular positivamente la Conexina 43 (Cx43), lo que lleva a uniones gap inducidas por bacterias entre el tumor y las células dendríticas (DC), lo que permite la presentación cruzada de antígenos tumorales a las DC. ② Tras la exposición a los antígenos tumorales y la interacción con los componentes bacterianos, las DC secretan grandes cantidades de la citocina proinflamatoria IL-1β, que posteriormente activa las células T CD8+. ③ La respuesta antitumoral de las células T CD8+ activadas se ve reforzada por la flagelina bacteriana (una subunidad proteica del flagelo bacteriano) a través de la activación de TLR5. Las proteínas perforina y granzima secretadas por las células T CD8+ activadas eliminan eficazmente las células tumorales en tumores primarios y metastásicos. ④ La señalización de flagelina y TLR5 también disminuye la abundancia de células T reguladoras (Treg) CD4+ CD25+, lo que posteriormente mejora la respuesta antitumoral de las células T CD8+ activadas. ⑤ La flagelina de S. Typhimurium estimula las células NK para que produzcan interferón-γ (IFN-γ), una citoquina importante para la inmunidad innata y adaptativa. ⑥ Las MDSC infectadas con Listeria cambian a un fenotipo inmunoestimulador caracterizado por una mayor producción de IL-12, lo que mejora aún más las respuestas de las células NK y T CD8+. ⑦ Ambos S. La infección por Typhimurium y Clostridium puede estimular una acumulación significativa de neutrófilos. La secreción elevada de TNF-α y ligando inductor de apoptosis relacionado con TNF (TRAIL) por parte de los neutrófilos mejora la respuesta inmunitaria y destruye las células tumorales al inducir la apoptosis. ⑧ El inflamasoma del macrófago se activa a través del contacto con componentes bacterianos (LPS y flagelina) y células cancerosas dañadas por Salmonella, lo que lleva a una secreción elevada de IL-1β y TNF-α en el microambiente tumoral. Célula NK: célula asesina natural. Célula Treg: célula T reguladora. MDSC: células supresoras derivadas de mieloides. Receptor P2X7: purinoceptor 7-receptor de ATP extracelular. LPS: lipopolisacárido La secreción elevada de TNF-α y ligando inductor de apoptosis relacionado con TNF (TRAIL) por parte de los neutrófilos mejora la respuesta inmunitaria y destruye las células tumorales al inducir la apoptosis. ⑧ El inflamasoma del macrófago se activa a través del contacto con componentes bacterianos (LPS y flagelina) y células cancerosas dañadas por Salmonella, lo que lleva a una secreción elevada de IL-1β y TNF-α en el microambiente tumoral. Célula NK: célula asesina natural. Célula Treg: célula T reguladora. MDSC: células supresoras derivadas de mieloides. Receptor P2X7: purinoceptor 7-receptor de ATP extracelular. LPS: lipopolisacárido La secreción elevada de TNF-α y ligando inductor de apoptosis relacionado con TNF (TRAIL) por parte de los neutrófilos mejora la respuesta inmunitaria y destruye las células tumorales al inducir la apoptosis. ⑧ El inflamasoma del macrófago se activa a través del contacto con componentes bacterianos (LPS y flagelina) y células cancerosas dañadas por Salmonella, lo que lleva a una secreción elevada de IL-1β y TNF-α en el microambiente tumoral. Célula NK: célula asesina natural. Célula Treg: célula T reguladora. MDSC: células supresoras derivadas de mieloides. Receptor P2X7: purinoceptor 7-receptor de ATP extracelular. LPS: lipopolisacárido célula T reguladora. MDSC: células supresoras derivadas de mieloides. Receptor P2X7: purinoceptor 7-receptor de ATP extracelular. LPS: lipopolisacárido célula T reguladora. MDSC: células supresoras derivadas de mieloides. Receptor P2X7: purinoceptor 7-receptor de ATP extracelular. LPS: lipopolisacárido
[17] Bacterias involucradas en causar y tratar cánceres
Probióticos modificados genéticamente como medicamentos vivos para tratar la inflamación intestinal