Catálisis
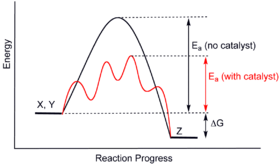
Catálisis ( / k ə t æ l ə s ɪ s / ) es el proceso de aumento de la tasa de una reacción química mediante la adición de una sustancia conocida como un catalizador [1] [2] ( / k æ t əl ɪ s t / ). Los catalizadores no se consumen en la reacción y permanecen sin cambios después de ella. Si la reacción es rápida y el catalizador se recicla rápidamente, a menudo bastan cantidades muy pequeñas de catalizador; [3]la mezcla, el área superficial y la temperatura son factores importantes en la velocidad de reacción. Los catalizadores generalmente reaccionan con uno o más reactivos para formar intermedios que posteriormente dan el producto de reacción final, en el proceso de regeneración del catalizador.
La catálisis puede clasificarse en homogénea , cuyos componentes están dispersos en la misma fase (generalmente gaseosa o líquida) que el reactivo, o heterogénea , cuyos componentes no están en la misma fase. Las enzimas y otros biocatalizadores se consideran a menudo como una tercera categoría.
La catálisis es omnipresente en la industria química de todo tipo. Se estima que el 90% de todos los productos químicos producidos comercialmente involucran catalizadores en alguna etapa del proceso de su fabricación.
El término "catalizador" se deriva del griego καταλύειν , katalúō , que significa "soltar" o "desatar". El concepto de catálisis fue inventado por la química Elizabeth Fulhame , basándose en su novedoso trabajo en experimentos de oxidación-reducción. [4] [5]
Esta reacción procede porque los productos de reacción son más estables que el material de partida. La reacción no catalizada es lenta. De hecho, la descomposición del peróxido de hidrógeno es tan lenta que las soluciones de peróxido de hidrógeno están disponibles comercialmente. Esta reacción se ve fuertemente afectada por catalizadores como el dióxido de manganeso o la enzima peroxidasa en los organismos. Tras la adición de una pequeña cantidad de dióxido de manganeso , el peróxido de hidrógeno reacciona rápidamente. Este efecto se ve fácilmente por la efervescencia del oxígeno. [6] El dióxido de manganeso no se consume en la reacción y, por lo tanto, puede recuperarse sin cambios y reutilizarse indefinidamente. En consecuencia, el dióxido de manganeso cataliza esta reacción.
La unidad derivada del SI para medir la actividad catalítica de un catalizador es el katal , que se cuantifica en moles por segundo. La productividad de un catalizador se puede describir por el número de rotación (o TON) y la actividad catalítica por la frecuencia de rotación (TOF), que es la TON por unidad de tiempo. El equivalente bioquímico es la unidad enzimática . Para obtener más información sobre la eficacia de la catálisis enzimática, consulte el artículo sobre enzimas .