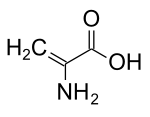
Deshidroalanina
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ácido 2-aminoprop-2-enoico | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| ChemSpider | |
| DrugBank | |
| KEGG | |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 3 H 5 NO 2 | |
| Masa molar | 87,08 g / mol |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
La dehidroalanina ( Cα, β-didehidroalanina , α, β-di-deshidroalanina , 2-aminoacrilato o 2,3-didehidroalanina ) es un deshidroaminoácido . No existe en su forma libre, pero ocurre naturalmente como un residuo que se encuentra en péptidos de origen microbiano . [1] Como residuo de aminoácido, es inusual porque tiene una columna vertebral insaturada . [2]
Estructura y reactividad
Como la mayoría de las enaminas primarias , la deshidroalanina es inestable. La deshidroalanina se hidroliza a piruvato .
Los derivados N- acilados de la deshidroalanina, tales como péptidos y compuestos relacionados, son estables. Por ejemplo, el 2-acetamidoacrilato de metilo es el derivado N-acetilado del éster. Como residuo en un péptido, se genera mediante una modificación postraduccional . Los precursores requeridos son residuos de serina o cisteína , que sufren una pérdida de agua y sulfuro de hidrógeno mediada por enzimas , respectivamente.
La mayoría de los residuos de aminoácidos no reaccionan con los nucleófilos , pero los que contienen deshidroalanina o algunos otros deshidroaminoácidos son excepciones. Estos son electrofílicos debido al carbonilo α, β-insaturado , [2] y pueden, por ejemplo, alquilar otros aminoácidos. Esta actividad ha hecho que el DHA sea útil sintéticamente para preparar lantionina .
Ocurrencia
El residuo de deshidroalanina se detectó por primera vez en nisina , un péptido cíclico con actividad antimicrobiana. [2] La deshidroalanina también está presente en algunos lantibióticos y microcistinas .
El DHA se puede formar a partir de cisteína o serina mediante catálisis básica simple sin la necesidad de una enzima, lo que puede ocurrir durante los procesos de cocción y preparación de alimentos alcalinos . A continuación, puede alquilar otros residuos de aminoácidos, como la lisina , formando enlaces cruzados de lisinoalanina y racemización de la alanina original. Las proteínas resultantes tienen menor calidad nutricional para algunas especies pero mayor calidad nutricional para otras. Algunas lisinoalaninas también pueden causar agrandamiento de los riñones en ratas. [3]
Muchos péptidos que contienen deshidroalanina son tóxicos. [2]
Durante mucho tiempo se pensó que un residuo de deshidroalanina era un residuo catalítico electrófilo importante en las enzimas histidina amoniaco liasa y fenilalanina amoniaco liasa , pero más tarde se descubrió que el residuo activo era un derivado de alanina insaturado diferente: 3,5-dihidro-5-metildieno. -4 H -imidazol-4-ona , que es aún más electrofílico. [4] [5]
Referencias
- ^ Downs, DM; Ernst, DC (abril de 2015). "De la microbiología a la biología del cáncer: la familia de proteínas Rid previene el daño celular causado por especies de nitrógeno reactivo generadas endógenamente" . Microbiología molecular . 96 (2): 211–9. doi : 10.1111 / mmi.12945 . PMC 4974816 . PMID 25620221 .
- ↑ a b c d Siodłak, Dawid (2015). "α, β-Dehidroaminoácidos en péptidos naturales" . Aminoácidos . 47 (1): 1–17. doi : 10.1007 / s00726-014-1846-4 . PMC 4282715 . PMID 25323736 .
- ^ Friedman, Mendel (1999). "Lisinoalanina en alimentos y en proteínas antimicrobianas". En Jackson, Lauren S .; Knize, Mark G .; Morgan, Jeffrey N. (eds.). Impacto del procesamiento en la seguridad alimentaria . Avances en Medicina y Biología Experimental. 459 . Saltador. págs. 145-159. doi : 10.1007 / 978-1-4615-4853-9_10 . ISBN 978-1-4615-4853-9. PMID 10335374 .
- ^ Rétey, János (2003). "Descubrimiento y papel de la metilideno imidazolona, un grupo protésico altamente electrofílico". Biochimica et Biophysica Acta (BBA) - Proteínas y proteómica . 1647 (1–2): 179–184. doi : 10.1016 / S1570-9639 (03) 00091-8 . PMID 12686130 .
- ^ Calabrese JC, Jordan DB, Boodhoo A, Sariaslani S, Vannelli T (septiembre de 2004). "Estructura cristalina de la fenilalanina amoniaco liasa: dipolos de hélice múltiple implicados en la catálisis". Bioquímica . 43 (36): 11403–16. doi : 10.1021 / bi049053 + . PMID 15350127 .
- Aminoácidos
- Aminoácidos no proteinogénicos