 | |
| Datos clinicos | |
|---|---|
| Nombres comerciales | Nimbex |
| Otros nombres | 51W89, besilato de cisatracurio ( USAN EE . UU. ) |
| AHFS / Drugs.com | Monografía |
| Datos de licencia | |
Categoría de embarazo |
|
| Vías de administración | Intravenoso |
| Código ATC | |
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | 100% (IV) |
| Metabolismo | 80% de degradación de Hofmann / hepático |
| Vida media de eliminación | 20–29 minutos |
| Excreción | 10-15% sin cambios |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| CHEBI | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA | 100.149.509 |
| Datos químicos y físicos | |
| Fórmula | C 65 H 82 N 2 O 18 S 2 |
| Masa molar | 1 243 0,49 g · mol -1 |
| Modelo 3D ( JSmol ) | |
Sonrisas
| |
InChI
| |
| | |
El besilato de cisatracurio ( DCI ; besilato de cisatracurio ( USAN ); anteriormente reconocido como 51W89; [1] nombre comercial Nimbex ) es un bisbenciltetrahidroisoquinolinio que tiene efecto como fármaco bloqueador neuromuscular o relajante del músculo esquelético en la categoría de fármacos bloqueadores neuromusculares no despolarizantes , utilizado como complemento en la anestesia para facilitar la intubación endotraqueal y para proporcionar relajación del músculo esquelético durante la cirugía o la ventilación mecánica. Muestra una duración de acción intermedia. El cisatracurio es uno de los diez isómeros de la molécula madre, el atracurio . [2] Además, el cisatracurio representa aproximadamente el 15% de la mezcla de atracurio. [3]
Historia [ editar ]
El nombre genérico cisatracurio fue concebido por científicos de Burroughs Wellcome Co. (ahora parte de GlaxoSmithKline) combinando el nombre "atracurio" con "cis" [de ahí cis atracurio] porque la molécula es uno de los tres isómeros cis - cis que comprenden los diez isómeros del padre, atracurio . [2] El atracurio en sí fue inventado en la Universidad de Strathclyde y con licencia para Burroughs Wellcome Co. , Research Triangle Park, Carolina del Norte., para un mayor desarrollo y posterior comercialización como Tracrium. A medida que se desarrollaba la farmacología secundaria del atracurio, quedó claro que la principal desventaja clínica del atracurio probablemente fuera su propensión a provocar la liberación de histamina. Para abordar este problema, se inició un programa para investigar los isómeros constituyentes individuales del atracurio para identificar y aislar los isómeros asociados con los efectos indeseables de la histamina, así como identificar el isómero que posiblemente podría retener las propiedades deseables sin la liberación de histamina. Así, en 1989, DA Hill y GL Turner, PhD (ambos químicos de Burroughs Wellcome Co., Dartford, Reino Unido) sintetizaron por primera vez cisatracurio como una molécula de isómero individual. La investigación farmacológica del cisatracurio y los otros isómeros individuales [4]luego fue desarrollado principalmente por R. Brandt Maehr y William B. Wastila, PhD (ambos farmacólogos dentro de la División de Farmacología de Burroughs Wellcome Co.) en colaboración con John J. Savarese MD (quien en ese momento era un anestesiólogo en el Departamento de Anestesia, Escuela de Medicina de Harvard en el Hospital General de Massachusetts , Boston , MA). A partir de entonces, todo el desarrollo clínico de cisatracurio se completó en un período récord corto de 1992 a 1994: el equipo de científicos fue dirigido por J. Neal Weakly PhD, Martha M. Abou-Donia PhD y Steve Quessy PhD, en la División de Neurociencias clínicas en Burroughs Wellcome Co. , Research Triangle Park, NC. En el momento de su aprobación para uso humano, en 1995, por la Administración de Drogas y Alimentos de EE. UU., Burroughs Wellcome Co. se había fusionado con Glaxo Inc. , y el cisatracurio fue aprobado para comercializarse como Nimbex por GlaxoWellcome Inc. El nombre comercial "Nimbex "se deriva de la inserción de una "i" a la propuesta original "Nmb ex ", que se mantuvo para ex cellent N euro m uscular b casillero.
Farmacología preclínica [ editar ]
Los estudios in vitro que utilizaron plasma humano indicaron que el cisatracurio se degrada espontáneamente a pH fisiológico mediante la eliminación de Hofmann para producir laudanosina y el monoacrilato cuaternario. La posterior hidrólisis del éster del monoacrilato genera el alcohol monocuaternario, aunque el paso limitante de la velocidad es la eliminación de Hofmann . [3] En el plasma de rata, el cisatracurio también es metabolizado por carboxilesterasas no específicas (un paso limitante de la velocidad) al alcohol monocuaternario y al ácido monocuaternario. [3]
Farmacología clínica [ editar ]
Como es evidente con la molécula madre, atracurio, [5] [6] cisatracurio también es susceptible de degradación por eliminación de Hofmann e hidrólisis de ésteres como componentes de los procesos metabólicos in vivo . [ cita requerida ] Consulte la página de atracurio para obtener información sobre la eliminación de Hofmann in vivo frente a la reacción química de degradación de Hofmann.
Dado que la eliminación de Hofmann es un proceso dependiente de la temperatura y del pH plasmático , la tasa de degradación del cisatracurio in vivo está muy influenciada por el pH y la temperatura corporal, al igual que ocurre con la molécula madre, el atracurio: por lo tanto, un aumento del pH corporal favorece el proceso de eliminación. , [ cita requerida ] mientras que una disminución de la temperatura ralentiza el proceso.
Uno de los metabolitos del cisatracurio a través de la eliminación de Hofmann es laudanosina; consulte la página de atracurio para obtener más información sobre el tema relacionado con este metabolito. El 80% del cisatracurio se metaboliza finalmente a laudanosina y el 20% se metaboliza por vía hepática o se excreta por vía renal. [ cita requerida ] 10-15% de la dosis se excreta sin cambios en la orina. [ cita requerida ]
Dado que la eliminación de Hofmann es un mecanismo quimiodegradativo independiente de los órganos, el uso de cisatracurio en pacientes con enfermedad hepática o renal presenta poco o ningún riesgo en comparación con otros agentes bloqueadores neuromusculares. [7]
Los dos enlaces éster inversos en el puente entre los dos grupos isoquinolinio hacen que el atracurio y el cisatracurio sean dianas pobres para la colinesterasa plasmática , a diferencia del mivacurio que tiene dos enlaces éster convencionales.
Efectos adversos [ editar ]
Liberación de histamina: hipotensión, taquicardia refleja y rubor cutáneo [ editar ]
Broncoespasmo: distensibilidad pulmonar [ editar ]
Hasta la fecha, no se ha informado que el cisatracurio provoque broncoespasmo a las dosis prescritas clínicamente.
Laudanosina: focos epilépticos [ editar ]
Cisatracurio se somete a eliminación de Hofmann como una ruta primaria de quimiodegradación: en consecuencia, uno de los metabolitos de este proceso es laudanosina , un amino alcaloide terciario reportado como un moderado estimulante del SNC con actividad epileptogénica [8] y efectos cardiovasculares como presión arterial baja y lentitud. frecuencia cardíaca . [9] Como amina terciaria, la laudanosina está sindicalizada y atraviesa fácilmente la barrera hematoencefálica. Actualmente, [ ¿cuándo? ]Existe poca evidencia de que la acumulación de laudanosina y la toxicidad relacionada probablemente se observarán alguna vez con las dosis de cisatracurio que se administran en la práctica clínica, especialmente dado que las concentraciones plasmáticas de laudanosina generada son menores con cisatracurio que con atracurio. [9]
Investigación [ editar ]
Un reciente [ ¿cuándo? ] estudio demostró que el pretratamiento con cisatracurio reduce eficazmente la incidencia y la gravedad del dolor inducido por la anestesia general con propofol .[10] Otro estudio mostró que el hipo acompañado de vómitos, insomnio y dificultad para respirar también se puede aliviar con el relajante muscular no despolarizante, cisatracurio, durante la anestesia intravenosa total. [11]
Síntesis [ editar ]
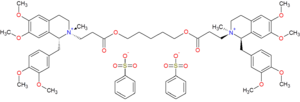
El tratamiento de 1,5-pentanodiol con cloruro de 3-bromopropionilo da el éster correspondiente; la deshidrohalogenación del éster con trietilamina da luego el bis-acrilato ( 2 ). La reacción de ese éster insaturado con tetrahidropapaverina [13] [14] ( 3 ) conduce a la adición conjugada de la amina secundaria y la formación del intermedio ( 4 ). La alquilación con bencenosulfonato de metilo forma la sal bis-cuaternaria, proporcionando cisatracuronio ( 5 ).
Referencias [ editar ]
- ^ Meretoja OA, Taivainen T, Wirtavuori K (enero de 1995). "Efectos farmacodinámicos de 51W89, un isómero de atracurio, en niños durante la anestesia con halotano". Hno. J Anaesth . 74 (1): 6–11. doi : 10.1093 / bja / 74.1.6 . PMID 7880708 .
- ↑ a b Stenlake JB, Waigh RD, Dewar GH, Dhar NC, Hughes R, Chapple DJ, Lindon JC, Ferrige AG (1984). "Agentes bloqueadores neuromusculares biodegradables. Parte 6. Estudios estereoquímicos sobre atracurio y diésteres de polialquileno relacionados". Eur J Med Chem . 19 (5): 441–450.
- ^ a b c Estimado GJ, Harrelson JC, Jones AE, Johnson TE, Pleasance S (1995). "Identificación de metabolitos conjugados urinarios y biliares del bloqueador neuromuscular 51W89 por cromatografía líquida / espectrometría de masas". Espectroma de masas de comunicación rápida . 9 (14): 1457–1464. doi : 10.1002 / rcm.1290091425 . PMID 8534894 .
- ^ Wastila WB, Maehr RB, Turner GL, Hill DA, Savarese JJ (julio de 1996). "Farmacología comparativa de cisatracurio (51W89), atracurio y cinco isómeros en gatos". Anestesiología . 85 (1): 169-177. doi : 10.1097 / 00000542-199607000-00023 . PMID 8694363 . S2CID 23963554 .
- ^ Stiller RL, Cook DR, Chakravorti S (1985). "Degradación in vitro de atracurio en plasma humano". Hno. J Anaesth . 57 (11): 1085–1088. doi : 10.1093 / bja / 57.11.1085 . PMID 3840382 .
- ^ Nigrovic V, Fox JL (1991). "Desintegración de atracurio y formación de laudanosina en humanos". Anestesiología . 74 (3): 446–454. doi : 10.1097 / 00000542-199103000-00010 . PMID 2001023 .
- ^ Katzung, Bertram G. (2011). Farmacología básica y clínica (12ª ed.). Nueva York: Mcgraw-Hill. ISBN 978-0-07-176401-8.
- ^ Standaert FG (diciembre de 1985). "Balas mágicas, ciencia y medicina". Anestesiología . 63 (6): 577–578. doi : 10.1097 / 00000542-198512000-00002 . PMID 2932980 .
- ↑ a b Fodale V, Santamaria LB (julio de 2002). "Laudanosina, un metabolito de atracurio y cisatracurio". Eur J Anaesthesiol . 19 (7): 466–473. doi : 10.1017 / s0265021502000777 . PMID 12113608 .
- ^ Kim YH (abril de 2014). "El pretratamiento de cisatracurio con torniquete reduce el dolor de la inyección de propofol: un ensayo controlado aleatorio doble ciego". J Int Med Res . 42 (2): 360–7. doi : 10.1177 / 0300060514522602 . PMID 24573971 .
- ^ Wu JP, An JX, Qian XY, Wang Y. Tratamiento exitoso del hipo idiopático intratable con cisatracurio bajo anestesia general intravenosa: informe de un caso. AA Pract. 2018; 10 (7): 171‐172. doi: 10.1213 / XAA.0000000000000651
- ^ DA Hill, GL Turner Patente de Estados Unidos 5.453.510 (1995).
- ^ Schmidt, Andreas (2003). "Betaínas mesoméricas heterocíclicas y análogos en la química de productos naturales. Alcaloides betínicos y nucleobases". Avances en química heterocíclica Volumen 85 . Avances en química heterocíclica. 85 . págs. 67-171. doi : 10.1016 / S0065-2725 (03) 85002-X . ISBN 978-0-12-020785-5.
- ^ Chandra, Ramesh; Kaur, Jaskiran; Talwar, Anita; Ghosh, Narendra N. (2001). "Síntesis y efecto antiespasmódico de N-carbamoil / tiocarbamoil isoquinolinas sustituidas con arilo" . Arkivoc . 2001 (8): 129-135. doi : 10.3998 / ark.5550190.0002.814 .
Lectura adicional [ editar ]
- Caldwell JE (1995). "Nuevos relajantes del músculo esquelético". Int Anesthesiol Clin . 33 (1): 39–60. doi : 10.1097 / 00004311-199500000-00003 . PMID 7635557 .
- Hull CJ (1995). "Farmacocinética y farmacodinamia de los relajantes musculares bencilisoquinolinio". Acta Anaesthesiol Scand . 106 Supl: 13-17. doi : 10.1111 / j.1399-6576.1995.tb04302.x . PMID 8533537 . S2CID 43784865 .
- Savarese JJ, Wastila WB (1995). "El futuro de los relajantes de bencilisoquinolinio". Acta Anaesthesiol Scand . 106 Supl: 91–93. doi : 10.1111 / j.1399-6576.1995.tb04317.x . PMID 8533554 . S2CID 39461057 .
- Esmaoglu A, Akin A, Mizrak A, Turk Y, Boyaci A (2006). "Adición de cisatracurio a lidocaína para anestesia regional intravenosa". J Clin Anesth . 18 (3): 194–7. doi : 10.1016 / j.jclinane.2005.08.003 . PMID 16731321 .
- Melloni C, De Vivo P, Launo C, Mastronardi P, Novelli G, Romano E (2006). "Cisatracurio versus vecuronio: un estudio comparativo, doble ciego, aleatorizado, multicéntrico en pacientes adultos bajo anestesia con propofol / fentanilo / N 2 O". Minerva Anestesiol . 72 (5): 299-308. PMID 16675938 .
- Serra C, Oliveira A (2006). "Cisatracurio: estudios miográficos y electrofisiológicos en el músculo de rata aislado". Fundam Clin Pharmacol . 20 (3): 291–8. doi : 10.1111 / j.1472-8206.2006.00395.x . PMID 16671964 . S2CID 11980810 .
- Katzung, Bertram G. (2011). Farmacología básica y clínica (12ª ed.). Nueva York: Mcgraw-Hill. ISBN 978-0-07-176401-8.
Enlaces externos [ editar ]
- "Besilato de cisatracurio" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.