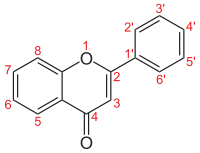
Las flavonas (del latín flavus "amarillo") son una clase de flavonoides basados en la columna vertebral de 2-fenilcromen-4-ona (2-fenil-1- benzopiran -4-ona) (como se muestra en la primera imagen de este artículo) . [1] [2]
Las flavonas son comunes en los alimentos, principalmente de especias , y en algunas frutas y verduras de color amarillo o naranja. [1] Las flavonas comunes incluyen apigenina (4 ', 5,7-trihidroxiflavona), luteolina (3', 4 ', 5,7-tetrahidroxiflavona), tangeritina (4', 5,6,7,8-pentametoxiflavona), crisina (5,7-dihidroxiflavona) y 6-hidroxiflavona . [1]
Ingesta y eliminación
La ingesta diaria estimada de flavonas es de aproximadamente 2 mg por día. [1] Las flavonas no tienen efectos fisiológicos comprobados en el cuerpo humano y no tienen valor alimenticio antioxidante . [1] [3] Después de la ingestión y el metabolismo , las flavonas, otros polifenoles y sus metabolitos se absorben mal en los órganos del cuerpo y se excretan rápidamente en la orina , lo que indica mecanismos que influyen en su presunta ausencia de funciones metabólicas en el cuerpo. [1] [4]
Interacciones con la drogas
Las flavonas tienen efectos sobre la actividad de CYP ( P450 ), [5] [6] que son enzimas que metabolizan la mayoría de los fármacos en el cuerpo.
Química Orgánica
En química orgánica existen varios métodos para la síntesis de flavonas:
- Reacción de Allan-Robinson
- Síntesis de auwers
- Reordenamiento de Baker-Venkataraman
- Reacción de Algar-Flynn-Oyamada
Otro método es la ciclación deshidratante de ciertas 1,3-diaril dicetonas. [7]
Reordenamiento de Wessely-Moser
El reordenamiento de Wessely-Moser (1930) [8] ha sido una herramienta importante en la elucidación de la estructura de los flavonoides. Implica la conversión de 5,7,8-trimetoxiflavona en 5,6,7-trihidroxiflavona por hidrólisis de los grupos metoxi a grupos fenol . También tiene potencial sintético, por ejemplo: [9]
Esta reacción de transposición tiene lugar en varios pasos: un anillo que se abre a la dicetona , rotación del enlace B con formación de una interacción favorable acetilacetona -fenil-cetona e hidrólisis C de dos grupos metoxi y cierre del anillo.
Flavonas comunes
| Nombre | Estructura | R 3 | R 5 | R 6 | R 7 | R 8 | R 2 ' | R 3 ' | R 4 ' | R 5 ' | R 6 ' |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Espina dorsal de flavona | - | - | - | - | - | - | - | - | - | - | |
| Primuletina | - | -OH | - | - | - | - | - | - | - | - | |
| Crisina | - | -OH | - | -OH | - | - | - | - | - | - | |
| Tectocrisina | - | -OH | - | –OCH 3 | - | - | - | - | - | - | |
| Primetin | - | -OH | - | - | -OH | - | - | - | - | - | |
| Apigenina | - | -OH | - | -OH | - | - | - | -OH | - | - | |
| Acacetina | - | -OH | - | -OH | - | - | - | –OCH 3 | - | - | |
| Genkwanin | - | -OH | - | –OCH 3 | - | - | - | -OH | - | - | |
| Echioidinin | - | -OH | - | –OCH 3 | - | -OH | - | - | - | - | |
| Baicalein | - | -OH | -OH | -OH | - | - | - | - | - | - | |
| Oroxylon | - | -OH | –OCH 3 | -OH | - | - | - | - | - | - | |
| Negletein | - | -OH | -OH | –OCH 3 | - | - | - | - | - | - | |
| Norwogonin | - | -OH | - | -OH | -OH | - | - | - | - | - | |
| Wogonin | - | -OH | - | -OH | –OCH 3 | - | - | - | - | - | |
| Geraldone | - | - | - | -OH | - | - | –OCH 3 | -OH | - | - | |
| Titonina | - | - | - | –OCH 3 | - | - | -OH | –OCH 3 | - | - | |
| Luteolina | - | -OH | - | -OH | - | - | -OH | -OH | - | - | |
| 6-hidroxiluteolina | - | -OH | -OH | -OH | - | - | -OH | -OH | - | - | |
| Crisoeriol | - | -OH | - | -OH | - | - | –OCH 3 | -OH | - | - | |
| Diosmetina | - | -OH | - | -OH | - | - | -OH | –OCH 3 | - | - | |
| Pilloin | - | -OH | - | –OCH 3 | - | - | -OH | –OCH 3 | - | - | |
| Velutin | - | -OH | - | –OCH 3 | - | - | –OCH 3 | -OH | - | - | |
| Norartocarpetin | - | -OH | - | -OH | - | -OH | - | -OH | - | - | |
| Artocarpetin | - | -OH | - | –OCH 3 | - | -OH | - | -OH | - | - | |
| Scutellarein | - | -OH | -OH | -OH | - | - | - | -OH | - | - | |
| Hispidulina | - | -OH | –OCH 3 | -OH | - | - | - | -OH | - | - | |
| Sorbifolina | - | -OH | -OH | –OCH 3 | - | - | - | -OH | - | - | |
| Pectolinarigenina | - | -OH | –OCH 3 | -OH | - | - | - | –OCH 3 | - | - | |
| Cirsimaritina | - | -OH | –OCH 3 | –OCH 3 | - | - | - | -OH | - | - | |
| Mikanin | - | -OH | –OCH 3 | –OCH 3 | - | - | - | –OCH 3 | - | - | |
| Isoscutellareína | - | -OH | - | -OH | -OH | - | - | -OH | - | - | |
| Zapotinin | - | -OH | –OCH 3 | - | - | –OCH 3 | - | - | - | –OCH 3 | |
| Zapotin | - | –OCH 3 | –OCH 3 | - | - | –OCH 3 | - | - | - | –OCH 3 | |
| Cerrosilina | - | –OCH 3 | –OCH 3 | - | - | - | –OCH 3 | - | –OCH 3 | - | |
| Alnetina | - | -OH | –OCH 3 | –OCH 3 | –OCH 3 | - | - | - | - | - | |
| Tricetina | - | -OH | - | -OH | - | - | -OH | -OH | -OH | - | |
| Tricina | - | -OH | - | -OH | - | - | –OCH 3 | -OH | –OCH 3 | - | |
| Coribosina | - | -OH | - | –OCH 3 | - | - | –OCH 3 | –OCH 3 | –OCH 3 | - | |
| Nepetin | - | -OH | –OCH 3 | -OH | - | - | -OH | -OH | - | - | |
| Pedalitina | - | -OH | -OH | –OCH 3 | - | - | -OH | -OH | - | - | |
| Nodifloretina | - | -OH | -OH | -OH | - | - | –OCH 3 | -OH | - | - | |
| Jaceosidina | - | -OH | –OCH 3 | -OH | - | - | –OCH 3 | -OH | - | - | |
| Cirsiliol | - | -OH | –OCH 3 | –OCH 3 | - | - | -OH | -OH | - | - | |
| Eupatilin | - | -OH | –OCH 3 | -OH | - | - | –OCH 3 | –OCH 3 | - | - | |
| Cirilineol | - | -OH | –OCH 3 | –OCH 3 | - | - | –OCH 3 | -OH | - | - | |
| Eupatorin | - | -OH | –OCH 3 | –OCH 3 | - | - | - | –OCH 3 | -OH | - | |
| Sinensetin | - | –OCH 3 | –OCH 3 | –OCH 3 | - | - | - | –OCH 3 | –OCH 3 | - | |
| Hipolaetina | - | -OH | - | -OH | -OH | - | -OH | -OH | - | - | |
| Onopordin | - | -OH | - | -OH | –OCH 3 | - | -OH | -OH | - | - | |
| Wightin | - | -OH | - | –OCH 3 | –OCH 3 | –OCH 3 | -OH | - | - | - | |
| Nevadensina | - | -OH | –OCH 3 | -OH | –OCH 3 | - | - | –OCH 3 | - | - | |
| Xantomicrol | - | -OH | –OCH 3 | –OCH 3 | –OCH 3 | - | - | -OH | - | - | |
| Tangeretina | - | –OCH 3 | –OCH 3 | –OCH 3 | –OCH 3 | - | - | –OCH 3 | - | - | |
| Serpyllin | - | -OH | - | –OCH 3 | –OCH 3 | –OCH 3 | –OCH 3 | –OCH 3 | - | - | |
| Sudaquitina | - | -OH | –OCH 3 | -OH | –OCH 3 | - | –OCH 3 | -OH | - | - | |
| Acerosina | - | -OH | –OCH 3 | -OH | –OCH 3 | - | -OH | –OCH 3 | - | - | |
| Himenoxina | - | -OH | –OCH 3 | -OH | –OCH 3 | - | –OCH 3 | –OCH 3 | - | - | |
| Gardenin D | - | -OH | –OCH 3 | –OCH 3 | –OCH 3 | - | -OH | –OCH 3 | - | - | |
| Nobiletin | - | –OCH 3 | –OCH 3 | –OCH 3 | –OCH 3 | - | –OCH 3 | –OCH 3 | - | - | |
| Scaposin | - | -OH | –OCH 3 | -OH | –OCH 3 | - | –OCH 3 | –OCH 3 | -OH | ||
| Nombre | Estructura | R 3 | R 5 | R 6 | R 7 | R 8 | R 2 ' | R 3 ' | R 4 ' | R 5 ' | R 6 ' |
Referencias
- ^ a b c d e f "Flavonoides" . Centro de información sobre micronutrientes, Instituto Linus Pauling, Universidad Estatal de Oregón, Corvallis, Oregón. Noviembre de 2015 . Consultado el 30 de marzo de 2018 .
- ^ "Flavone" . ChemSpider, Real Sociedad de Química. 2015 . Consultado el 30 de marzo de 2018 .
- ^ Lotito, S; Frei, B (2006). "Consumo de alimentos ricos en flavonoides y aumento de la capacidad antioxidante del plasma en humanos: ¿causa, consecuencia o epifenómeno?". Biología y Medicina de Radicales Libres . 41 (12): 1727–46. doi : 10.1016 / j.freeradbiomed.2006.04.033 . PMID 17157175 .
- ^ David Stauth (5 de marzo de 2007). "Los estudios fuerzan una nueva visión sobre la biología de los flavonoides" . EurekAlert !; Adaptado de un comunicado de prensa emitido por la Universidad Estatal de Oregon.
- ^ Cermak R, Wolffram S., El potencial de los flavonoides para influir en el metabolismo y la farmacocinética de los fármacos mediante mecanismos gastrointestinales locales, Curr Drug Metab. Octubre de 2006; 7 (7): 729-44.
- ^ Si D, Wang Y, Zhou YH, et al. (Marzo de 2009). "Mecanismo de inhibición de CYP2C9 por flavonas y flavonoles". Drug Metab. Dispos . 37 (3): 629–34. doi : 10.1124 / dmd.108.023416 . PMID 19074529 . [1]
- ^ Sarda SR, Pathan MY, Paike VV, Pachmase PR, Jadhav WN, Pawar RP (2006). "Una síntesis fácil de flavonas utilizando líquido iónico reciclable bajo irradiación de microondas" . Arkivoc . xvi (16): 43–8. doi : 10.3998 / ark.5550190.0007.g05 .
- ^ Wessely F, Moser GH (diciembre de 1930). "Synthese und Konstitution des Skutellareins". Monatshefte für Chemie . 56 (1): 97-105. doi : 10.1007 / BF02716040 .
- ^ Larget R, Lockhart B, Renard P, Largeron M (abril de 2000). "Una extensión conveniente del reordenamiento de Wessely-Moser para la síntesis de alquilaminoflavonas sustituidas como agentes neuroprotectores in vitro". Bioorg. Medicina. Chem. Lett . 10 (8): 835–8. doi : 10.1016 / S0960-894X (00) 00110-4 . PMID 10782697 .
- ^ Harborne, Jeffrey B .; Marby, Helga; Marby, TJ (1975). Los flavonoides - Springer . doi : 10.1007 / 978-1-4899-2909-9 . ISBN 978-0-12-324602-8.
enlaces externos
- Flavonas en los títulos de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- Flavonas