| |
 Estructuras químicas de tetrahidrocannabinol (arriba) y cannabidiol (abajo) | |
| Combinación de | |
|---|---|
| Tetrahidrocannabinol | Cannabinoide |
| Cannabidiol | Cannabinoide |
| Datos clinicos | |
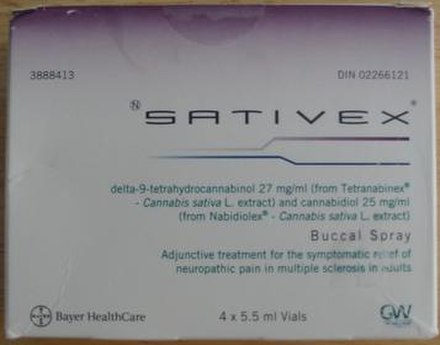
| Nombres comerciales | Sativex |
| Vías de administración | Aerosol bucal |
| Código ATC | |
| Estatus legal | |
| Estatus legal |
|
| Identificadores | |
| Número CAS | |
| PubChem CID | |
| UNII | |
| Tablero CompTox ( EPA ) | |
| | |
Nabiximols ( USAN , [1] nombre comercial Sativex ) es un extracto de cannabis específico que fue aprobado en 2010 como fármaco botánico en el Reino Unido a pesar de la falta de evidencia convincente de efectividad para la reducción de la espasticidad (ver más abajo). Nabiximols se vende como un aerosol bucal destinado a aliviar el dolor neuropático , la espasticidad , la vejiga hiperactiva y otros síntomas de la esclerosis múltiple ; fue desarrollado por la empresa británica GW Pharmaceuticals . [2] [3]En 2019 se propuso que después de la aplicación del aerosol, los nabiximols se eliminen de la mucosa oral por el flujo de saliva y se ingieran en el estómago, con posterior absorción en el tracto gastrointestinal. [4] [5] Nabiximols es un fármaco de combinación estandarizado en composición, formulación y dosis. Sus principales componentes cannabinoides activos son los cannabinoides: tetrahidrocannabinol (THC) y cannabidiol (CBD). Cada spray proporciona una dosis de 2,7 mg de THC y 2,5 mg de CBD.
En mayo de 2003, GW Pharmaceuticals y Bayer firmaron un acuerdo de comercialización exclusivo para el producto de extracto medicinal a base de cannabis de GW, que se comercializará con la marca Sativex. "Bayer ha obtenido los derechos exclusivos para comercializar Sativex en el Reino Unido. Además, Bayer tiene la opción durante un período limitado de negociar los derechos de comercialización en otros países de la Unión Europea y en otros países seleccionados del mundo".
En abril de 2011, GW concedió la licencia a Novartis de los derechos para comercializar nabiximols en Asia (excluyendo China y Japón), África y Oriente Medio (excluyendo Israel). [6]
Disponibilidad [ editar ]
En junio de 2010, la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido autorizó a los nabiximols como un medicamento de venta con receta para el tratamiento de la espasticidad debida a la esclerosis múltiple. Esta autorización reglamentaria representa la primera aprobación reglamentaria completa del mundo para el medicamento. Bayer Schering Pharma comercializa el spray en el Reino Unido. Muchas personas con EM no pueden recibir nabiximols debido a la resistencia local del Servicio Nacional de Salud (NHS) a su financiación; [7] [8] pero, en agosto de 2014, el NHS de Gales acordó financiar Sativex para personas con esclerosis múltiple. [9]
Nabiximols también fue aprobado en España para la espasticidad de EM en el segundo semestre de 2010 y fue lanzado en ese país en marzo de 2011. Fue aprobado en la República Checa en abril de 2011, en Alemania en mayo de 2011, en Dinamarca en junio de 2011 y en Suecia en enero de 2012 a personas con EM que no han respondido adecuadamente a otros medicamentos para la espasticidad. [10] También se ha recomendado para su aprobación en Italia y Austria con aprobaciones formales previstos en estos países durante 2011. En España y otros mercados europeos (excluyendo el Reino Unido), Sativex serán comercializados por Almirall .
En Canadá, Health Canada ha aprobado los nabiximols para el tratamiento de la espasticidad de la EM. También ha recibido una licencia con condiciones (NOC / c) para dos usos adicionales: como tratamiento adyuvante para el alivio sintomático del dolor neuropático en la esclerosis múltiple, [11] y también para el dolor debido al cáncer. [12] [13]
Nabiximols está disponible en varios países como un medicamento sin licencia, lo que permite a los médicos recetar el producto a las personas que consideran que pueden beneficiarse. El producto se ha exportado desde el Reino Unido a un total de 28 países hasta la fecha.
En febrero de 2007, GW y Otsuka Pharmaceutical anunciaron un acuerdo exclusivo para que Otsuka desarrollara y comercializara el medicamento en Estados Unidos. El primer ensayo de fase IIb a gran escala de EE. UU., Spray Trial, para personas con cáncer informó resultados positivos en marzo de 2010. GW y Otsuka han comenzado ahora el desarrollo de fase III de nabiximols en el dolor por cáncer .
En diciembre de 2012, Sativex fue aprobado en Polonia . [14]
En 2013, Francia legalizó el uso de cannabinoides en medicina, Sativex es el primero que se vende con receta. [15] Sin embargo, en junio de 2016, este medicamento aún no se había vendido en las farmacias de ese país. [dieciséis]
Efectividad [ editar ]
De los dos estudios preliminares de fase III que investigan el tratamiento de personas con EM, uno mostró una reducción de la espasticidad de 1,2 puntos en la escala de calificación de 0 a 10 puntos (frente a 0,6 puntos con placebo ), el otro mostró una reducción de 1,0 frente a 0,8 puntos . Solo el primer estudio alcanzó significación estadística. El estudio de aprobación de la Fase III consistió en una fase inicial en la que se determinó la respuesta de los individuos al fármaco. Los que respondieron (42% de los sujetos) mostraron un efecto significativo en la segunda fase del ensayo, controlada con placebo. [17] Un metaanálisis de 2009 de seis estudios encontró grandes variaciones de efectividad, con una tendencia, estadísticamente no significativa, hacia una reducción de la espasticidad. [18]Una revisión sistemática realizada en 2014 por la Academia Estadounidense de Neurología encontró que los nabiximols eran `` probablemente efectivos '' para la espasticidad, el dolor y la disfunción urinaria, pero no tenían respaldo para los temblores. [19]
Los nabiximols también se han estudiado para el dolor del cáncer resistente a los opioides. El uso de adyuvantes fue seguro y eficaz en 3 ensayos para el dolor por cáncer, [20] [21] [22] sin embargo, el fármaco no logró su criterio de valoración principal para este propósito en su primer ensayo de fase III. [23]
Efectos secundarios [ editar ]
En los primeros ensayos clínicos, los nabiximols generalmente se toleraron bien. [24] [25] [26] Los efectos adversos más comunes en los ensayos de fase III fueron mareos (25%), somnolencia (8%) y desorientación (4%); El 12% de los sujetos dejaron de tomar el fármaco debido a los efectos secundarios. No se dispone de investigaciones sobre el potencial de dependencia , pero tal potencial es poco probable considerando las propiedades farmacológicas de los dos componentes. [17]
Licencias [ editar ]
GW Pharmaceuticals obtuvo una licencia única para cultivar cannabis para la fabricación de Sativex en el Reino Unido, otorgándoles el derecho legal exclusivo de investigar en terapias derivadas del cannabis en aerosol, que en abril de 2013 se volvió comercialmente viable cuando el gobierno del Reino Unido programó la formulación de Sativex para su separación. IV de la Ley de Drogas del Reino Unido. [27]
Ver también [ editar ]
- Cannabis medicinal
- Nabilona
- Dronabinol
- Hortapharm BV
Referencias [ editar ]
- ^ Consejo de Nombres Adoptados de Estados Unidos: Declaración sobre un nombre común
- ^ UK Medicines Online Nabiximols [ enlace muerto permanente ] Página consultada el 3 de febrero de 2016
- ^ Confianza de la esclerosis múltiple. Octubre de 2014 Sativex (nabiximols) - ficha informativa
- ^ Itin, Constantin; Barasch, Dinorah; Domb, Abraham; Hoffman, Amnon (2020). "Entrega transmucosa oral prolongada de cannabidiol fármaco altamente lipofílico". Int J Pharm . 581 : 119276. doi : 10.1016 / j.ijpharm.2020.119276 . PMID 32243971 .
- ^ Itin, Constantin; Domb, Abraham; Hoffman, Amnon (2019). "Una meta opinión: los cannabinoides administrados a la mucosa oral mediante un aerosol para la absorción sistémica se ingieren más bien en el tracto gastrointestinal: las influencias de los estados de ayuno / alimentación". Opinión de expertos Drug Deliv . 16 (10): 1031-1035. doi : 10.1080 / 17425247.2019.1653852 . PMID 31393180 . S2CID 199505274 .
- ^ "GW firma un acuerdo de drogas a base de cannabis Sativex con Novartis" . El Telégrafo. 11 de abril de 2011 . Consultado el 12 de julio de 2012 .
- ^ Ryan, Siobhan (4 de junio de 2011). "Los pacientes de Sussex MS piden financiación para las drogas" . Argus (Sussex, Reino Unido) . Consultado el 8 de junio de 2011 .
- ^ "Sativex rechazado por el proveedor de atención médica" . Lincolnshire . 20 de junio de 2011. Archivado desde el original el 22 de junio de 2011 . Consultado el 20 de junio de 2011 .
- ^ "Gales NHS para ofrecer droga de cannabis MS Sativex" . 15 de agosto de 2014 . Consultado el 18 de agosto de 2014 .
- ^ Sativex (nabiximols), Agencia Sueca de Productos Médicos. Archivado el 1 de enero de 2014 en la Wayback Machine.
- ^ GW Pharmaceuticals. " Esclerosis múltiple archivado el 11 de agosto de 2011 en la Wayback Machine ". Consultado el 24 de julio de 2011.
- ^ GW Pharmaceuticals. " Cancer Pain Archivado el 27 de septiembre de 2011en la Wayback Machine " Consultado el 24 de julio de 2011.
- ^ "Sativex - tratamiento basado en cannabis en investigación para la tecnología de desarrollo de fármacos para el dolor y la esclerosis múltiple" . www.drugdevelopment-technology.com . Consultado el 8 de agosto de 2008 .
- ^ Olszewska, Dorota; Kidawa Michał. "Sativex - lek z marihuany" . Krajowe Biuro Do Spraw Przeciwdziałania Narkomanii.
- ^ "Francia legaliza la droga a base de marihuana para tratar la esclerosis múltiple" . HunffingtonPost . Consultado el 4 de junio de 2015 .
- ^ "Cannabis thérapeutique: pourquoi le Sativex n'est-il toujours pas vendu en France?" . Sciences et Avenir. Archivado desde el original el 10 de mayo de 2016 . Consultado el 6 de junio de 2016 .
- ^ a b Schubert-Zsilavecz, M, Wurglics, M, Neue Arzneimittel 2011/2012 (en alemán)
- ^ Lakhan, Shaheen E; Rowland, Marie (2009). "Extractos de cannabis de plantas enteras en el tratamiento de la espasticidad en la esclerosis múltiple: una revisión sistemática" . BMC Neurol . 9 : 59. doi : 10.1186 / 1471-2377-9-59 . PMC 2793241 . PMID 19961570 .
- ^ Koppel, Barbara S .; Brust, John CM; Fife, Terry; Bronstein, Jeff; Youssof, Sarah; Gronseth, Gary; Gloss, David (29 de abril de 2014). "Revisión sistemática: eficacia y seguridad de la marihuana medicinal en trastornos neurológicos seleccionados: informe del Subcomité de desarrollo de directrices de la Academia Americana de Neurología" . Neurología . 82 (17): 1556-1563. doi : 10.1212 / WNL.0000000000000363 . ISSN 1526-632X . PMC 4011465 . PMID 24778283 .
- ^ Portenoy, Russell K .; Ganae-Motan, Elena Doina; Allende, Silvia; Yanagihara, Ronald; Shaiova, Lauren; Weinstein, Sharon; McQuade, Robert; Wright, Stephen; Fallon, Marie T. (1 de mayo de 2012). "Nabiximols para pacientes con cáncer tratados con opioides con dolor crónico mal controlado: un ensayo aleatorizado, controlado con placebo, de dosis graduada". El diario del dolor . 13 (5): 438–449. doi : 10.1016 / j.jpain.2012.01.003 . ISSN 1528-8447 . PMID 22483680 .
- ^ Lynch, Mary E .; Cesar-Rittenberg, Paula; Hohmann, Andrea G. (1 de enero de 2014). "Un ensayo piloto cruzado, doble ciego, controlado con placebo con extensión utilizando un extracto de cannabinoides de la mucosa oral para el tratamiento del dolor neuropático inducido por quimioterapia" . Revista de manejo del dolor y los síntomas . 47 (1): 166-173. doi : 10.1016 / j.jpainsymman.2013.02.018 . ISSN 1873-6513 . PMID 23742737 .
- ^ Johnson, Jeremy R .; Lossignol, Dominique; Burnell-Nugent, Mary; Fallon, Marie T. (1 de agosto de 2013). "Un estudio de extensión de etiqueta abierta para investigar la seguridad y tolerabilidad a largo plazo del aerosol oromucoso de THC / CBD y el aerosol de THC oromucoso en pacientes con dolor terminal relacionado con el cáncer refractario a analgésicos opioides fuertes" . Revista de manejo del dolor y los síntomas . 46 (2): 207–218. doi : 10.1016 / j.jpainsymman.2012.07.014 . ISSN 1873-6513 . PMID 23141881 .
- ^ "Fallo de la última etapa de Otsuka y GW Cancer Pain Drug" . Pharmafile . 2015-09-01 . Consultado el 7 de diciembre de 2016 .
- ^ Wade D, Makela P, Robson P, Casa H, Bateman C (2004). "¿Los extractos medicinales a base de cannabis tienen efectos generales o específicos sobre los síntomas de la esclerosis múltiple? Un estudio doble ciego, aleatorizado y controlado con placebo en 160 pacientes". Mult Scler . 10 (4): 434–41. doi : 10.1191 / 1352458504ms1082oa . PMID 15327042 . S2CID 1378674 .
- ^ Wade D, Makela P, Casa H, Bateman C, Robson P (2006). "Uso a largo plazo de un medicamento a base de cannabis en el tratamiento de la espasticidad y otros síntomas de la esclerosis múltiple". Mult Scler . 12 (5): 639–45. doi : 10.1177 / 1352458505070618 . PMID 17086911 . S2CID 16175440 .
- ^ Wade D, Robson P, Casa H, Makela P, Aram J (2003). "Un estudio preliminar controlado para determinar si los extractos de cannabis de plantas enteras pueden mejorar los síntomas neurogénicos intratables". Clin Rehabil . 17 (1): 21–9. doi : 10.1191 / 0269215503cr581oa . PMID 12617376 . S2CID 1414988 .
- ^ "Copia archivada" . Archivado desde el original el 29 de octubre de 2013 . Consultado el 27 de noviembre de 2013 .Mantenimiento de CS1: copia archivada como título ( enlace )
Enlaces externos [ editar ]
- Sitio web de GW Pharmaceuticals