 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC sistemático Metanoato de sodio | |||
| Otros nombres ácido fórmico, sal de sodio, dióxido de hidrocarburo de sodio | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.004.990 | ||
| Número CE |
| ||
| Número e | E237 (conservantes) | ||
PubChem CID | |||
| UNII | |||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| HCOONa | |||
| Masa molar | 68,007 g / mol | ||
| Apariencia | gránulos blancos delicuescentes | ||
| Densidad | 1,92 g / cm 3 (20 ° C) | ||
| Punto de fusion | 253 ° C (487 ° F; 526 K) | ||
| Punto de ebullición | se descompone | ||
| 43,82 g / 100 ml (0 ° C) 97,2 g / 100 ml (20 ° C) 160 g / 100 ml (100 ° C) | |||
| Solubilidad | insoluble en éter soluble en glicerol , alcohol , ácido fórmico | ||
| Termoquímica | |||
Capacidad calorífica ( C ) | 82,7 J / mol K | ||
Entropía molar estándar ( S | 103,8 J / mol K | ||
| -666,5 kJ / mol | |||
Energía libre de Gibbs (Δ f G ˚) | -599,9 kJ / mol | ||
| Peligros | |||
| no enlistado | |||
| NFPA 704 (diamante de fuego) |  1 0 0 | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
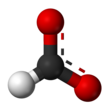
El formato de sodio , HCOONa, es la sal de sodio del ácido fórmico , HCOOH. Suele aparecer como un polvo delicuescente blanco .
Preparación [ editar ]
Para uso comercial, el formiato de sodio se produce absorbiendo monóxido de carbono bajo presión en hidróxido de sodio sólido a 130 ° C y 6-8 bares de presión: [1]
- CO + NaOH → HCO 2 Na
Debido al bajo costo y la disponibilidad a gran escala de ácido fórmico por carbonilación de metanol e hidrólisis del formiato de metilo resultante, el formiato de sodio se prepara normalmente neutralizando el ácido fórmico con hidróxido de sodio . El formiato de sodio también se forma inevitablemente como subproducto en la etapa final de la síntesis de pentaeritritol y en la reacción de Cannizzaro cruzada de formaldehído con el producto de reacción aldólico trimetilol acetaldehído [3-hidroxi-2,2-bis (hidroximetil) propanal]. [2]
En el laboratorio, el formiato de sodio se puede preparar neutralizando el ácido fórmico con carbonato de sodio . También se puede obtener haciendo reaccionar cloroformo con una solución alcohólica de hidróxido de sodio .
- CHCl 3 + 4 NaOH → HCOONa + 3 NaCl + 2 H 2 O
o haciendo reaccionar hidróxido de sodio con hidrato de cloral .
- C 2 HCl 3 (OH) 2 + NaOH → CHCl 3 + HCOONa + H 2 O
El último método es, en general, se prefiere a la primera porque la baja solubilidad acuosa de CHCl 3 hace que sea más fácil separar hacia fuera de la solución de formiato de sodio, por cristalización fraccionada , que el soluble NaCl sería.
El formiato de sodio también se puede crear mediante la reacción de haloformo entre etanol e hipoclorito de sodio en presencia de una base . Este procedimiento está bien documentado para la preparación de cloroformo .
Propiedades [ editar ]
Propiedades físicas [ editar ]
El formiato de sodio cristaliza en un sistema cristalino monoclínico con los parámetros de red a = 6,19 Å, b = 6,72 Å, c = 6,49 Å y β = 121,7 °. [3]
Propiedades químicas [ editar ]
Al calentarlo, el formiato de sodio se descompone para formar oxalato de sodio e hidrógeno. [4] El oxalato de sodio resultante se puede convertir mediante calentamiento adicional en carbonato de sodio tras la liberación de monóxido de carbono: [5] [4]
Como sal de un ácido débil (ácido fórmico ) y una base fuerte ( hidróxido de sodio), el formiato de sodio reacciona en soluciones acuosas básicas:
Por tanto, se puede utilizar una solución de ácido fórmico y formiato de sodio como solución tampón .
El formiato de sodio es ligeramente peligroso para el agua e inhibe algunas especies de bacterias, pero otras lo degradan.
Usos [ editar ]
El formiato de sodio se utiliza en varios procesos de teñido e impresión de telas. También se utiliza como agente tamponador de ácidos minerales fuertes para aumentar su pH , como aditivo alimentario (E237) y como agente descongelante .
En biología estructural , el formiato de sodio se puede utilizar como crioprotector para experimentos de difracción de rayos X en cristales de proteínas, [6] que normalmente se realizan a una temperatura de 100 K para reducir los efectos del daño por radiación .
El formiato de sodio juega un papel en la síntesis de ácido fórmico , se convierte en ácido sulfúrico a través de la siguiente ecuación de reacción:
- El formiato de sodio se convierte con ácido sulfúrico en ácido fórmico y sulfato de sodio .
El pelo urticante de las ortigas contiene formiato de sodio y ácido fórmico.
El formiato de sodio sólido se utiliza como agente no corrosivo en los aeropuertos para el deshielo de pistas en mezcla con inhibidores de corrosión y otros aditivos, que penetran rápidamente las capas sólidas de nieve y hielo, las desprenden del asfalto o el hormigón y derriten el hielo rápidamente. El formiato de sodio también se utilizó como descongelante de carreteras en la ciudad de Ottawa de 1987 a 1988. [7]
La alta depresión del punto de congelación, por ejemplo, en comparación con la urea que todavía se usa con frecuencia (que es eficaz pero problemática debido a la eutrofización ) evita eficazmente el nuevo congelamiento, incluso a temperaturas inferiores a -15 ° C. El efecto de descongelación del formiato de sodio sólido puede incluso aumentarse humedeciéndolo con soluciones acuosas de formiato de potasio o acetato de potasio . La degradabilidad del formiato de sodio es particularmente ventajosa con una demanda química de oxígeno (DQO) de 211 mg O 2 / g en comparación con los agentes descongelantes acetato de sodio (740 mg O 2 / g) y urea con (> 2000 mg O 2 / gramo). [8]
Las soluciones saturadas de formiato de sodio (así como las mezclas de otros formiatos de metales alcalinos como el formiato de potasio y cesio) se utilizan como importantes ayudas de perforación y estabilización en la exploración de gas y petróleo debido a su densidad relativamente alta. Mediante la mezcla de las correspondientes soluciones de formiato de metal alcalino saturados cualquier densidades entre 1,0 y 2,3 g / cm 3 puede ajustarse. Las soluciones saturadas son biocidas y estables a largo plazo frente a la degradación microbiana. Diluidos, en cambio, son rápidos y completamente biodegradables. Dado que los formiatos de metales alcalinos como ayudas de perforación hacen que sea innecesario agregar rellenos sólidos para aumentar la densidad (como baritas ) y las soluciones de formiato se pueden recuperar yreciclados en el sitio de perforación, los formiatos representan un avance importante en la tecnología de exploración. [9]
Ver también [ editar ]
- Acetato de sodio
Referencias [ editar ]
- ^ Arnold Willmes, Taschenbuch Chemische Substanzen , Harri Deutsch, Frankfurt (M.), 2007.
- ^ H.-J. Arpe, Industrielle Organische Chemie , 6., vollst. überarb. Aufl., Wiley-VCH Verlag, 2007, ISBN 978-3-527-31540-6
- ^ WH Zachariasen: "La estructura cristalina del formiato de sodio, NaHCO 2 " en J. Am. Chem. Soc. , 1940 , 62 (5), S. 1011-1013. doi : 10.1021 / ja01862a007
- ^ a b T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "La descomposición térmica de formiatos de metales alcalinos" en Journal of Thermal Analysis and Calorimetry 1975 , 7 (1). S. 73-80. doi : 10.1007 / BF01911627
- ^ T. Yoshimori, Y. Asano, Y. Toriumi, T. Shiota: "Investigación sobre el secado y descomposición del oxalato de sodio" en Talanta 1978 , 25 (10) S. 603-605. doi : 10.1016 / 0039-9140 (78) 80158-1
- ↑ Bujacz, G .; Wrzesniewska, B .; Bujacz, A. (2010), "Propiedades de crioprotección de sales de ácidos orgánicos: un estudio de caso de un cristal tetragonal de lisozima HEW", Acta Crystallographica Sección D: Cristalografía biológica , 66 (7), págs. 789–796, doi : 10.1107 / S0907444910015416 , PMID 20606259
- ^ Frank M. D'Itr (1992). Descongeladores químicos y medio ambiente . Libros de Google . pag. 167. ISBN 9780873717052.
- ^ Descongelador Antihielo Derretimiento de la nieve Fabricantes de productos químicos para descongelar
- ^ William Benton y Jim Turner, Cabot Specialty Fluids: El fluido de formiato de cesio tiene éxito en las pruebas de campo de HPHT en el Mar del Norte (PDF; 88 kB); En: Contratista de perforación, mayo / junio de 2000.

![{\ displaystyle {\ ce {2HCOONa -> [\ Delta] {(COO) 2Na2} + H2 \! \ uparrow}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f655fb700d42dd45179a6f9ba1b54f298981f72)
![{\ displaystyle {\ ce {(COO) 2Na2 -> [{} \ encima> \ {\ ce {290 ^ {o} C}}] {Na2CO3} + CO \! \ uparrow}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/656e79ddc9dcbfe37e82e16400c3bbddd8371b07)

