| Gamma-secretasa | ||||||||
|---|---|---|---|---|---|---|---|---|
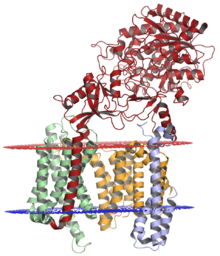 El complejo de gamma secretasa, con nicastrina (rojo), presenilina-1 (naranja), PEN-2 (azul) y APH-1 (verde); la membrana lumenal se muestra en rojo y la membrana citoplasmática se muestra en azul. La estructura se resolvió mediante microscopía crioelectrónica . [1] | ||||||||
| Identificadores | ||||||||
| Símbolo | Gamma-secretasa | |||||||
| Pfam | PF05450 | |||||||
| InterPro | IPR008710 | |||||||
| Superfamilia OPM | 244 | |||||||
| Proteína OPM | [5fn5 [ | |||||||
| Membranome | 155 | |||||||
| ||||||||
La gamma secretasa es un complejo de proteasa de múltiples subunidades , en sí mismo una proteína de membrana integral , que escinde proteínas transmembrana de un solo paso en los residuos dentro del dominio transmembrana. Las proteasas de este tipo se conocen como proteasas intramembrana . El sustrato más bien conocido de gamma secretasa es la proteína precursora amiloide , una gran proteína integral de membrana que, cuando se escinde por tanto gamma y beta secretasa , produce un corto 37-43 [ verificación necesaria ] amino ácido péptido llamado beta amiloide cuya anormalmente dobladaLa forma fibrilar es el componente principal de las placas amiloides que se encuentran en el cerebro de los pacientes con enfermedad de Alzheimer . La gamma secretasa también es fundamental en el procesamiento relacionado de varias otras proteínas integrales de membrana de tipo I, como Notch , [2] ErbB4 , [3] E-cadherina , [4] N-cadherina , [5] efrina-B2 , [6 ] o CD44 . [7]
Subunidades y montaje [ editar ]
El complejo de gamma secretasa consta de cuatro proteínas individuales: PSEN1 (presenilina-1), [8] nicastrina , APH-1 (faringe anterior defectuosa 1) y PEN-2 (potenciador de presenilina 2). [9] La evidencia reciente sugiere que una quinta proteína, conocida como CD147 , es un regulador no esencial del complejo cuya ausencia aumenta la actividad. [10] [11] La presenilina , una aspartil proteasa , es la subunidad catalítica ; Se ha demostrado que las mutaciones en el gen de la presenilina son un factor de riesgo genético importante para la enfermedad de Alzheimer [12].y modula la actividad de las células inmunes. [13] En los seres humanos, se han identificado en el genoma dos formas de presenilina y dos formas de APH-1 ; uno de los homólogos de APH también se puede expresar en dos isoformas mediante empalme alternativo , lo que conduce a al menos seis posibles complejos de gamma secretasa diferentes que pueden tener especificidad de tipo celular o tisular. [14]
Las proteínas del complejo gamma secretasa se modifican en gran medida por la proteólisis durante el ensamblaje y la maduración del complejo; un paso de activación requerido es en la escisión autocatalítica de presenilina en fragmentos N- y C-terminales. La función principal de Nicastrin es mantener la estabilidad del complejo ensamblado y regular el tráfico de proteínas intracelulares. [15] PEN-2 se asocia con el complejo mediante la unión de un dominio transmembrana de presenilina [16] y, entre otras posibles funciones, ayuda a estabilizar el complejo después de que la proteólisis de presenilina haya generado los fragmentos activados N-terminal y C-terminal . [17]APH-1, que se requiere para la actividad proteolítica, se une al complejo a través de un motivo de interacción de hélice alfa conservada y ayuda a iniciar el ensamblaje de componentes prematuros. [18]
Investigaciones recientes han demostrado que la interacción del complejo gamma secretasa con la proteína activadora de γ-secretasa facilita la escisión gamma de la proteína precursora amiloide en β-amiloide . [19]
Tráfico celular [ editar ]
Se cree que el complejo de gamma secretasa se ensambla y madura mediante proteólisis en el retículo endoplásmico temprano . [20] Los complejos luego se transportan al RE tardío donde interactúan y escinden sus proteínas de sustrato. [21] También se han observado complejos de gamma secretasa localizados en las mitocondrias , donde pueden desempeñar un papel en la promoción de la apoptosis . [22]
Función [ editar ]
La gamma secretasa es una proteasa interna que se escinde dentro del dominio que atraviesa la membrana de sus proteínas sustrato , incluida la proteína precursora amiloide (APP) y Notch . El reconocimiento del sustrato se produce mediante la unión del ectodominio de nicastrina al extremo N-terminal de la diana, que luego se pasa a través de un proceso poco conocido entre los dos fragmentos de presenilina a un sitio activo que contiene agua donde se encuentra el residuo de aspartato catalítico . El sitio activo debe contener agua para realizar la hidrólisis dentro de un ambiente hidrofóbico en el interior de la membrana celular., aunque no se comprende bien cómo se efectúa el intercambio de agua y protones , y todavía no se dispone de una estructura de cristalografía de rayos X de la gamma secretasa. [23] Las reconstrucciones de microscopía electrónica de baja resolución han permitido la visualización de los poros internos hipotéticos de aproximadamente 2 nanómetros. [24] En 2014, se determinó una estructura tridimensional de un complejo de gamma-secretasa humana intacto mediante análisis de partículas individuales por microscopía crioelectrónica con una resolución de 4,5 angstrom [25] y en 2015 una crio- Se informó la estructura EM. [1]
El complejo de gamma secretasa es inusual entre las proteasas porque tiene un sitio de escisión "descuidado" en el sitio C-terminal en la generación de beta amiloide ; La gamma secretasa puede escindir la APP en cualquiera de los múltiples sitios para generar un péptido de longitud variable, más típicamente de 39 a 42 aminoácidos de longitud, siendo Aβ40 la isoforma más común y Aβ42 la más susceptible a cambios conformacionales que conducen a fibrilogénesis amiloide . Ciertas mutaciones tanto en APP como en ambos tipos de presenilina humana están asociadas con una mayor producción de Aβ42 y la forma genética de inicio temprano de la enfermedad de Alzheimer familiar . [26]Aunque los datos más antiguos sugirieron que diferentes formas del complejo gamma secretasa podrían ser diferencialmente responsables de generar diferentes isoformas de beta amiloide, [27] la evidencia actual indica que el extremo C de la beta amiloide se produce por una serie de escisiones de un solo residuo por el mismo complejo de gamma secretasa. [28] [29] [30] Los sitios de escisión anteriores producen péptidos de longitud 46 (escisión zeta) y 49 (escisión épsilon). [29]
Ver también [ editar ]
- DAPT (químico) , un inhibidor de la γ-secretasa
Referencias [ editar ]
- ^ a b Bai, Xiao-chen; Yan, Chuangye; Yang, Guanghui; Lu, Peilong; Ma, Dan; Sun, Linfeng; Zhou, Rui; Scheres, Sjors HW ; Shi, Yigong (17 de agosto de 2015). "Una estructura atómica de la γ-secretasa humana" . Naturaleza . 525 (7568): 212–217. doi : 10.1038 / nature14892 . PMC 4568306 . PMID 26280335 .
- ^ De Strooper B, Annaert W, Cupers P, Saftig P, Craessaerts K, Mumm JS, Schroeter EH, Schrijvers V, Wolfe MS, Ray WJ, Goate A, Kopan R (1999). "Una proteasa similar a gamma-secretasa dependiente de presenilina-1 media la liberación del dominio intracelular de Notch". Naturaleza . 398 (6727): 518–22. doi : 10.1038 / 19083 . PMID 10206645 .
- ^ Ni CY, Murphy MP, Golde TE, Carpenter G (2001). "Escisión de gamma-secretasa y localización nuclear del receptor de tirosina quinasa ErbB-4". Ciencia . 294 (5549): 2179–81. doi : 10.1126 / science.1065412 . PMID 11679632 .
- ^ Marambaud P, Shioi J, Serban G, Georgakopoulos A, Sarner S, Nagy V, Baki L, Wen P, Efthimiopoulos S, Shao Z, Wisniewski T, Robakis NK (2002). "Una escisión de presenilina-1 / gamma-secretasa libera el dominio intracelular de E-cadherina y regula el desmontaje de las uniones adherentes" . EMBO J . 21 (8): 1948–56. doi : 10.1093 / emboj / 21.8.1948 . PMC 125968 . PMID 11953314 .
- ^ Marambaud P, Wen PH, Dutt A, Shioi J, Takashima A, Siman R, Robakis NK (2003). "Un represor transcripcional de unión a CBP producido por la escisión de PS1 / épsilon de N-cadherina es inhibido por mutaciones de PS1 FAD". Celular . 114 (5): 635–45. doi : 10.1016 / j.cell.2003.08.008 . PMID 13678586 .
- ^ Georgakopoulos A, Litterst C, Ghersi E, Baki L, Xu C, Serban G, Robakis NK (2006). "El procesamiento de metaloproteinasa / presenilina1 de ephrinB regula la fosforilación y señalización de Src inducida por EphB" . EMBO J . 25 (6): 1242–52. doi : 10.1038 / sj.emboj.7601031 . PMC 1422162 . PMID 16511561 .
- ^ Lammich S, Okochi M, Takeda M, Kaether C, Capell A, Zimmer AK, Edbauer D, Walter J, Steiner H, Haass C (2002). "La proteólisis intramembrana dependiente de presenilina de CD44 conduce a la liberación de su dominio intracelular y la secreción de un péptido similar a Abeta" . J Biol Chem . 277 (47): 44754–9. doi : 10.1074 / jbc.M206872200 . PMID 12223485 .
- ^ Sobhanifar, S; Schneider, B; Löhr, F; Gottstein, D; Ikeya, T; Mlynarczyk, K; Pulawski, W; Ghoshdastider, U; Kolinski, M; Filipek, S; Güntert, P; Bernhard, F; Dötsch, V (25 de mayo de 2010). "Investigación estructural del fragmento catalítico C-terminal de presenilina 1" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (21): 9644–9. doi : 10.1073 / pnas.1000778107 . PMC 2906861 . PMID 20445084 .
- ^ Kaether C, Haass C, Steiner H (2006). "Montaje, tráfico y función de gamma-secretasa" (PDF) . Neurodegener Dis . 3 (4–5): 275–83. doi : 10.1159 / 000095267 . PMID 17047368 .
- ^ Zhou S, Zhou H, Walian PJ, Jap BK (abril de 2006). "El descubrimiento y el papel de CD147 como una subunidad del complejo gamma-secretasa". Perspectiva de noticias sobre drogas . 19 (3): 133–8. doi : 10.1358 / dnp.2006.19.3.985932 . PMID 16804564 .
- ^ Zhou S, Zhou H, Walian PJ, Jap BK (mayo de 2005). "CD147 es una subunidad reguladora del complejo γ-secretasa en la producción de péptido β amiloide de la enfermedad de Alzheimer" . Proc. Natl. Acad. Sci. USA . 102 (21): 7499–504. doi : 10.1073 / pnas.0502768102 . PMC 1103709 . PMID 15890777 .
- ^ Chen F, Hasegawa H, Schmitt-Ulms G, Kawarai T, Bohm C, Katayama T, Gu Y, Sanjo N, Glista M, Rogaeva E, Wakutani Y, Pardossi-Piquard R, Ruan X, Tandon A, Checler F, Marambaud P, Hansen K, Westaway D, St George-Hyslop P, Fraser P (abril de 2006). "TMP21 es un componente complejo de presenilina que modula la gamma-secretasa pero no la actividad épsilon-secretasa". Naturaleza . 440 (7088): 1208–12. doi : 10.1038 / nature04667 . PMID 16641999 .
- ^ Farfara D, Trudler D, Segev-Amzaled N, Galron R, Stein R, Frenkel D (noviembre de 2010). "La presenilina del componente de g secretasa es importante para la eliminación de microglia b-amiloide". Annals of Neurology . 69 (1): 170–80. doi : 10.1002 / ana.22191 . PMID 21280087 .
- ^ Shirotani K, Edbauer D, Prokop S, Haass C, Steiner H (2004). "Identificación de distintos complejos de gamma-secretasa con diferentes variantes de APH-1" . J Biol Chem . 279 (40): 41340–5. doi : 10.1074 / jbc.M405768200 . PMID 15286082 .
- ^ Zhang YW, Luo WJ, Wang H, Lin P, Vetrivel KS, Liao F, Li F, Wong PC, Farquhar MG, Thinakaran G, Xu H (abril de 2005). "La nicastrina es fundamental para la estabilidad y el tráfico, pero no la asociación de otros componentes de presenilina / γ-secretasa" . J. Biol. Chem . 280 (17): 17020–6. doi : 10.1074 / jbc.M409467200 . PMC 1201533 . PMID 15711015 .
- ^ Watanabe N, Tomita T, Sato C, Kitamura T, Morohashi Y, Iwatsubo T (diciembre de 2005). "La pen-2 se incorpora al complejo gamma-secretasa mediante la unión al dominio transmembrana 4 de la presenilina 1" . J. Biol. Chem . 280 (51): 41967–75. doi : 10.1074 / jbc.M509066200 . PMID 16234244 .
- ^ Prokop S, Shirotani K, Edbauer D, Haass C, Steiner H (mayo de 2004). "Requisito de PEN-2 para la estabilización del heterodímero del fragmento N- / C-terminal de presenilina dentro del complejo gamma-secretasa" . J. Biol. Chem . 279 (22): 23255–61. doi : 10.1074 / jbc.M401789200 . PMID 15039426 .
- ^ Lee SF, Shah S, Yu C, Wigley WC, Li H, Lim M, Pedersen K, Han W, Thomas P, Lundkvist J, Hao YH, Yu G (febrero de 2004). "Un motivo GXXXG conservado en APH-1 es fundamental para el ensamblaje y la actividad del complejo gamma-secretasa" . J. Biol. Chem . 279 (6): 4144–52. doi : 10.1074 / jbc.M309745200 . PMID 14627705 .
- ^ He G, Luo W, Li P, Remmers C, Netzer WJ, Hendrick J, Bettayeb K, Flajolet M, Gorelick F, Wennogle LP, Greengard P (septiembre de 2010). "Proteína activadora de gamma-secretasa, una diana terapéutica para la enfermedad de Alzheimer" . Naturaleza . 467 (2): 95–98. doi : 10.1038 / nature09325 . PMC 2936959 . PMID 20811458 . Resumen de Lay - New York Times .
- ^ Capell A, Beher D, Prokop S, Steiner H, Kaether C, Shearman MS, Haass C (febrero de 2005). "Ensamblaje del complejo gamma-secretasa dentro de la vía secretora temprana" . J. Biol. Chem . 280 (8): 6471–8. doi : 10.1074 / jbc.M409106200 . PMID 15591316 .
- ^ Kim SH, Yin YI, Li YM, Sisodia SS (noviembre de 2004). "Evidencia de que el ensamblaje de un complejo de gamma-secretasa activo se produce en los primeros compartimentos de la vía secretora" . J. Biol. Chem . 279 (47): 48615–9. doi : 10.1074 / jbc.C400396200 . PMID 15456788 .
- ^ Hansson CA, Frykman S, Farmery MR, Tjernberg LO, Nilsberth C, Pursglove SE, Ito A, Winblad B, Cowburn RF, Thyberg J, Ankarcrona M (diciembre de 2004). "Nicastrin, presenilin, APH-1 y PEN-2 forman complejos gamma-secretasa activos en las mitocondrias" . J. Biol. Chem . 279 (49): 51654–60. doi : 10.1074 / jbc.M404500200 . PMID 15456764 .
- ^ Wolfe MS (julio de 2006). "El complejo gamma-secretasa: conjunto proteolítico incrustado en membrana". Bioquímica . 45 (26): 7931–9. doi : 10.1021 / bi060799c . PMID 16800619 .
- ^ Lazarov VK, Fraering PC, Ye W, Wolfe MS, Selkoe DJ, Li H (mayo de 2006). "La estructura microscópica electrónica de la γ-secretasa activa y purificada revela una cámara intramembrana acuosa y dos poros" . Proc. Natl. Acad. Sci. USA . 103 (18): 6889–94. doi : 10.1073 / pnas.0602321103 . PMC 1458989 . PMID 16636269 .
- ^ Lu P, Bai XC, Ma D, Xie T, Yan C, Sun L, Yang G, Zhao Y, Zhou R, Scheres SH, Shi Y (agosto de 2014). "Estructura tridimensional de la γ-secretasa humana" . Naturaleza . 512 (7513): 166-170. doi : 10.1038 / nature13567 . PMC 4134323 . PMID 25043039 .
- ^ Wiley JC, Hudson M, Kanning KC, Schecterson LC, Bothwell M (septiembre de 2005). "Las mutaciones de la enfermedad de Alzheimer familiar inhiben la liberación mediada por gamma-secretasa del fragmento carboxi-terminal de la proteína precursora beta-amiloide" . J. Neurochem . 94 (5): 1189–201. doi : 10.1111 / j.1471-4159.2005.03266.x . PMID 15992373 .
- ^ Jankowsky JL, Fadale DJ, Anderson J, Xu GM, Gonzales V, Jenkins NA, Copeland NG, Lee MK, Younkin LH, Wagner SL, Younkin SG, Borchelt DR (enero de 2004). "Las presenilinas mutantes elevan específicamente los niveles del péptido beta-amiloide de 42 residuos in vivo: evidencia del aumento de una gamma secretasa específica de 42" . Tararear. Mol. Genet . 13 (2): 159–70. doi : 10.1093 / hmg / ddh019 . PMID 14645205 .
- ^ Zhao G, Tan J, Mao G, Cui MZ, Xu X (marzo de 2007). "La misma gamma-secretasa explica las múltiples escisiones intramembrana de APP" . J. Neurochem . 100 (5): 1234–46. doi : 10.1111 / j.1471-4159.2006.04302.x . PMID 17241131 .
- ^ a b Zhang, H; Ma, Q; Zhang, YW; Xu, H (enero de 2012). "Procesamiento proteolítico de la proteína precursora β-amiloide de Alzheimer" . Revista de neuroquímica . 120 Supl. 1: 9-21. doi : 10.1111 / j.1471-4159.2011.07519.x . PMC 3254787 . PMID 22122372 .
- ^ Haass, C; Kaether, C; Thinakaran, G; Sisodia, S (mayo de 2012). "Trata y tratamiento proteolítico de APP" . Perspectivas de Cold Spring Harbor en Medicina . 2 (5): a006270. doi : 10.1101 / cshperspect.a006270 . PMC 3331683 . PMID 22553493 .